木犀草素可减轻异丙肾上腺素诱导的心力衰竭大鼠心肌细胞线粒体的损伤
刘昕,林琳,倪雅娟,魏瑾,张超英
(西安交通大学第二附属医院心血管内科,西安 710004)
心力衰竭(heart failure,HF)是大多数心血管疾病的终末状态,具有高再住院率、致残率及致死率的特点,给社会和家庭带来了极大的经济负担。线粒体是细胞进行正常生理活动的主要能量来源,线粒体损伤不仅可以导致能量代谢异常,还会造成过度氧化应激、细胞凋亡、线粒体自噬及线粒体融合分裂失衡等病理改变。研究认为,损伤的线粒体代谢产物可通过激活肾素-血管紧张素系统促进HF的发病及进展,因此线粒体损伤是导致HF患者心功能异常的重要机制[1]。木犀草素(luteolin,Lu)是一种黄酮类化合物,可从多种天然药材和瓜果蔬菜中分离出来,具有抗炎、抗氧化、抗肿瘤和抗病毒等多种药理学活性。多项研究表明,Lu可减少冠心病患者死亡率、抑制糖尿病心肌病的心肌损伤,对心血管具有保护作用[2]。我们的前期研究初步发现Lu能减轻异丙肾上腺素诱导的HF大鼠外周淋巴细胞线粒体DNA损伤,并且可以一定程度上改善HF大鼠的心脏功能,而对正常大鼠心脏功能及心肌线粒体无明显损伤[3]。因此,我们推断线粒体功能损伤及线粒体途径细胞凋亡可能是异丙肾上腺素诱导的大鼠心功能障碍的重要病理机制,也是Lu发挥心肌保护作用的重要途径之一。本研究以异丙肾上腺素诱导建立HF模型,观察Lu对HF大鼠心肌细胞线粒体膜电位(mitochondrial membrane potential,MMP)、呼吸链酶活性、线粒体途径凋亡的影响,为寻找和开发新的HF治疗药物提供理论研究基础。
1 材料与方法
1.1 材料与试剂
6~7周龄雄性SD大鼠,体质量250~300 g(西安交通大学实验动物中心);Lu(Sigma,491-70-3);冷冻离心机(TGL-16, 湖南湘仪实验室仪器开发有限公司);彩色多普勒超声诊断仪(iE33,Philips公司);PCR 仪(9700型Gene AmP,美国应用生物系统公司);透射电子显微镜(H-7650,日本HITACHI公司);动物硬组织线粒体粗提分离试剂盒、纯化线粒体溶解试剂盒、纯化MMP荧光测定试剂盒、细胞色素C氧化酶(cytochrome C oxidase,COX)活性测定试剂盒(上海杰美基因医药科技有限公司);琥珀酸脱氢酶(succinate dehydrogenase,SDH)活性测定试剂盒(南京建成生物工程研究所)。
1.2 方法
1.2.1 HF大鼠模型建立 将30只SD大鼠按随机数表法分为对照组、模型组(HF)和Lu干预组(HF + Lu),每组10只。所有实验大鼠在相同条件下喂养,环境温度(22±2) ℃,湿度 35%~70%,大鼠可自由取食和饮水。参考文献[4]中HF大鼠模型的制作,HF组和HF + Lu组大鼠给予异丙肾上腺素50 mg/kg腹腔注射,对照组给予等量生理盐水腹腔注射。注射药物同时HF + Lu组大鼠给予Lu 50 mg/(kg·d)灌胃(体积3 ml),对照组和HF组给予50 g/L羧甲基纤维素钠3 ml灌胃。均干预10 d后,于第11天行超声心动图检测心功能。
1.2.2 超声心动图检测 大鼠腹腔注射10%水合氯醛麻醉(3 ml/kg)后,剔去胸前毛发,固定于操作台上,采用彩色多普勒超声诊断仪(频率 22 MHz)检测。取心脏左室长轴切面和左室乳头肌水平测量M型曲线,测量分析并记录左室收缩末期内径(left ventricular end-systolic diameter,LVEDs)、左室舒张末期内径(left ventricular end-diastolic diameter,LVEDd)、左室短轴缩短率(left ventricular fraction shortening,LVFS)和左室射血分数(left ventricular ejection fraction,LVEF)。连续测量3个心动周期取其平均值。
1.2.3 RT-PCR检测凋亡相关基因Bax、caspase3、caspase9表达 将所有大鼠处死,取30 mg心肌组织,按照TRIzol试剂说明书提取细胞总RNA,紫外光吸收法检测RNA纯度及含量,调整各组样品总RNA浓度。RT-PCR反转录合成cDNA。扩增条件:94℃预变性5 min;随后95℃变性30 s,退火58 s,65℃延伸30 s,共35个循环;最后72℃延伸7 min。每次实验以GAPDH作为内参。PCR引物均由大连TaKaRa生物公司合成。引物序列见表1。

表1 RT-PCR引物序列
GAPDH: glyceraldehyde-3-phosphate dehydrogenase.
1.2.4 心肌线粒体超微结构观察 取心尖部心肌,约 4~5 mm3,滴注1~2 ml 预冷戊二醛固定剂,将组织切成1 mm3大小,置入盛有 2~3 ml预冷的 2.5%戊二醛中过夜固定。经漂洗包埋后,在超薄切片机上切片,获得厚度为70~90 nm的切片;经柠檬酸铅和醋酸铀双重染色各15 min;在H-7650透射电子显微镜下观察心肌组织及线粒体结构。
1.2.5 心肌组织线粒体提取及线粒体功能检测 按试剂盒说明书,称取 500 mg 心肌组织用于线粒体提取;组织经 PBS 缓冲液冲洗后用剪刀充分剪碎并转移入 5 ml EP 管中,加入 2.5 ml 酶解液,充分混匀;冰上孵育10 min后在 4℃下 1 000转/min离心2 min,弃上清后加入清理液及稀释液充分混匀;再次在 4℃下1 000转/min离心2 min,弃上清;将沉淀移入10 ml匀浆器,加入裂解工作液彻底匀浆20~40次左右;将匀浆物进行离心沉淀加入0.5 ml线粒体储存液以溶解线粒体,混匀备用;按MMP、SDH及COX试剂盒加入稀释液及反应工作液,采用荧光酶标仪对荧光强度值进行检测,并与对照组进行标准化。
1.3 统计学处理

2 结 果
2.1 3组大鼠心脏超声指标比较
超声心动图结果显示,HF组大鼠心脏超声各指标明显受损,Lu + HF组大鼠心脏功能明显改善。与对照组比较,HF组大鼠LVEF(P=0.023)和LVFS(P=0.002)均明显降低;而 LVEDs(P=0.010)和LVEDd (P=0.034)均明显增加,差异均具有统计学意义。与HF组相比,HF + Lu大鼠组LVEF(P=0.028)和LVFS(P=0.006)均明显增加,而 LVEDs(P=0.043)和LVEDd(P=0.019)均明显降低,差异亦有统计学意义(表2)。
表2 3组大鼠心功能相关指标比较


Group LVEF(%)LVFS(%)LVEDd(mm)LVEDs(mm)Control86.0±4.543.0±2.55.87±0.353.20±0.27HF68.0±3.1∗32.0±3.7∗7.10±0.34∗4.10±0.29∗HF+Lu78.0±5.8#39.0±1.5#5.65±0.21#3.40±0.23#
HF: heart failure; Lu: luteolin; LVEF: left ventricular ejection fraction; LVFS: left ventricular fraction shortening; LVEDd: left ventricular end-diastolic diameter; LVEDs: left ventricular end-systolic diameter. Compared with control group,*P<0.05; compared with HF group,#P<0.05.
2.2 3组大鼠心肌线粒体超微结构改变
透射电子显微镜下可见,对照组大鼠心肌细胞结构清楚,Z线清晰,粗细肌丝排列整齐、有序,细胞核形态规整,大小相对均一的线粒体在肌丝之间密集分布,线粒体形状多为圆形或椭圆形。而HF组大鼠心肌组织内可见脂质沉积,肌丝排列紊乱,伴有肌丝断裂与溶解,其中充满大量线粒体伴有空泡变性,肌浆网腔扩张。HF + Lu组大鼠上述形态改变较HF组明显减轻(图1)。
2.3 3组大鼠心肌线粒体MMP、SDH及COX酶活性比较
与对照组比较,HF组大鼠心肌MMP 水平显著降低(P=0.033),给予Lu干预后,HF + Lu组大鼠MMP水平较HF组显著升高(P=0.021),差异有统计学意义(图2A)。与对照组比较,HF组大鼠心肌线粒体 COX(P=0.032)和SDH(P=0.040)的活性均明显低于对照组,差异具有统计学意义;给予Lu干预后,HF + Lu组大鼠COX (P=0.007)和 SDH (P=0.011)活性较HF组显著升高,差异有统计学意义(图2B)。
2.4 3组大鼠心肌Bax、caspase3及caspase9 mRNA水平比较
结果显示,与对照组比较,HF组大鼠心肌组织中Bax(P=0.026)、caspase3(P=0.046)及caspase9(P=0.009)mRNA表达水平均显著高于对照组;给予Lu干预后,HF + Lu组大鼠心肌组织Bax(P=0.012)、caspase3(P=0.024)及caspase9(P=0.039)mRNA较HF组表达水平显著降低,差异具有统计学意义(图3)。
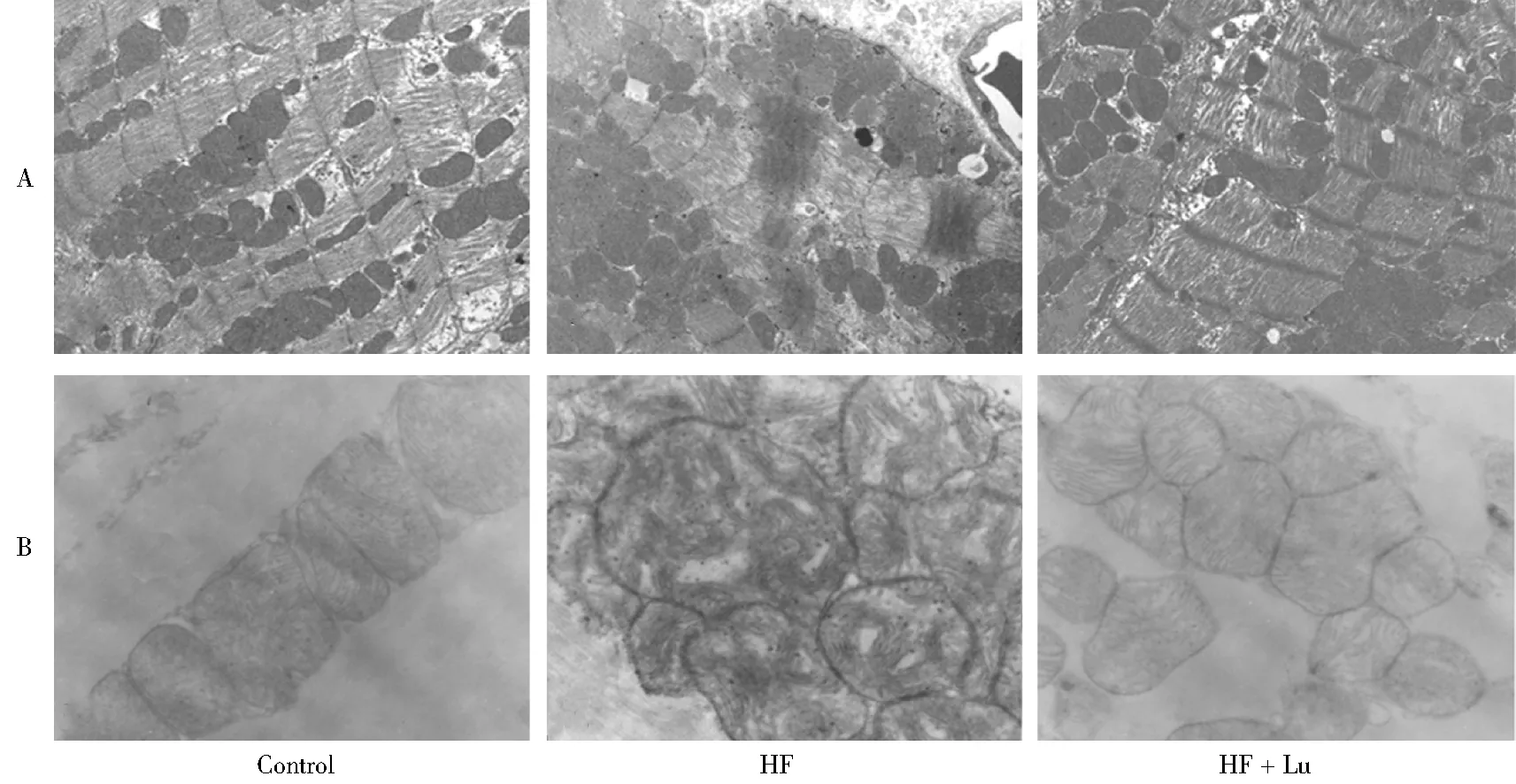
图1 3组大鼠心肌组织线粒体超微结构
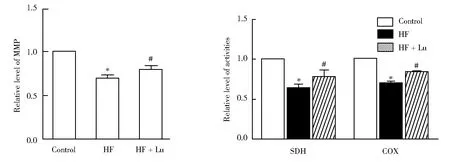
图2 3组大鼠心肌线粒体MMP、SDH及COX比较

图3 3组大鼠心肌Bax、caspase3及caspase9 mRNA表达水平
3 讨 论
HF是由心室充盈或射血过程中任何结构或功能损害引起的复杂性终末期临床常见综合征,其特征包括能量代谢异常、活性氧生成增加以及兴奋-收缩耦合缺陷等[5]。线粒体对代谢底物的摄取、ATP合成、电子传递链活性、活性氧水平、离子稳态、线粒体生物发生、线粒体动力学及活性氧含量的影响[6]以及线粒体DNA损伤[7]的调节异常是HF发生和发展的重要病理机制[8],是促进HF病程进展的重要因素。
线粒体结构和功能的完整与健康是保证细胞能量供应、维持细胞内环境、调节细胞凋亡、炎症应答等多种生命活动的基础。线粒体的能量供应依赖于维持其内膜的化学渗透梯度。这种梯度,也称为质子动力,是由呼吸链复合酶产生的,它们利用电子传输过程中释放的自由能将质子从线粒体基质转移到膜间隙。其中,MMP是由正电荷在膜上的净运动和pH梯度产生的,贡献了梯度中存储的大部分能量,而线粒体呼吸酶活性能促进能量的产生及传递[9]。因此,MMP、线粒体酶复合物活性被认为是线粒体能量状态的重要指标之一。在氧化应激、酸中毒、钙超载、ATP耗竭等情况下,MMP可在一定程度上降低,若MMP下降不超过15%可能有利于自由基的清除[10],但MMP进一步下降可能导致线粒体通透性转换孔的开放,进一步加重MMP的消散,从而导致ATP产生完全终止,并进一步启动细胞凋亡起点。大量功能损伤的线粒体可导致细胞色素C(Cytochrome C,Cyt-C)释放,并与 ATP、细胞内Ca2+、凋亡蛋白酶激活因子-1(apoptotic protease activating factor 1,Apaf-1)和其他因子之间相互作用,促进Bax转位,从而激活caspase3、caspase9途径的级联反应,最终导致细胞凋亡。我们在研究中发现HF大鼠心肌线粒体呼吸链酶活性降低,线粒体凋亡相关基因Bax、caspase3、caspase9表达增加,这显然与既往结论是相符的。然而,在部分研究中发现HF模型中SDH活性是增加的,考虑可能与疾病程度不同、线粒体功能处于代偿性增加有关[11]。同样的,细胞凋亡是致心肌病心肌细胞丢失、左心室功能逐渐下降、充血性HF的重要原因,研究表明,心肌病患者心肌存在线粒体Cyt-C释放诱导的caspase3激活及心肌细胞凋亡,与心功能尚能维持的患者相比,其凋亡的心肌细胞数量显著增加[12],因此,心肌细胞凋亡是HF进展的重要促进因素。
在本研究中,我们主要观察了Lu对HF大鼠心肌细胞线粒体相关指标的影响,发现Lu可减缓异丙肾上腺素诱导的HF大鼠心肌线粒体MMP、线粒体呼吸链复合酶SDH及COX活性的降低,同时线粒体相关凋亡因子Bax、caspase3、caspase9表达显著降低,提示Lu可通过减轻异丙肾上腺素诱导的HF大鼠心肌线粒体损伤及凋亡,改善线粒体呼吸功能,发挥心肌保护作用。Lu是一种具有抗氧化、抗凋亡、抗炎作用的黄酮类化合物,可增加心肌中超氧化物歧化酶、过氧化氢酶和谷胱甘肽还原酶等抗氧化酶的活性,降低丙二醛、乳酸脱氢酶的释放以及线粒体通透性转换孔的开放,对心脏具有心肌保护作用[13]。有学者在缺血再灌注大鼠的研究中发现Lu可减少心肌细胞凋亡及坏死,从而发挥心肌保护作用[14];Re等[15]研究报道,Rho亚家族蛋白A/相关卷曲螺旋形成蛋白激酶(Ras homolog family member A/Rho-associated coiled-coil containing protein kinase 2,RhoA/ROCK2)信号通路可引起抑癌基因p53介导的Bax 表达上调,Bax 激活后大量转移到线粒体中,导致线粒体中前凋亡因子释放,引起caspase3 和 caspase9 激活,最终导致心肌细胞的凋亡。而王雷等[16]发现,Lu可能通过抑制RhoA/ROCK2 信号通路减少糖尿病小鼠心肌细胞凋亡,从而减轻糖尿病心肌损伤。本研究尽管未进一步对凋亡细胞进行组织学检测,但我们证实了Lu可减少衰竭心肌Bax、caspase3、caspase9的表达,且根据上述研究我们认为,Lu很可能是通过减少衰竭心肌细胞的凋亡从而改善心脏功能。
综上,Lu可能通过减轻线粒体损伤及抑制线粒体途径的心肌细胞凋亡,对异丙肾上腺素诱导的HF大鼠心肌损伤起到保护作用,但仍需对其具体分子机制进行更深入研究,为Lu治疗HF提供临床理论依据。

