HBeAg与抗-HBe双阳性的慢性乙型肝炎患者临床特征分析
罗琳 张廷超 刘书刚
乙型肝炎病毒(hepatitis B virus,HBV)感染呈全球性分布。我国是慢性乙型肝炎的高发地区,2014年世界卫生组织发布中国一般人群的乙肝病毒表面抗原阳性流行率估计为5.49%,约7 400 万例乙肝病毒携带者[1]。乙型肝炎e 抗原(HBeAg)是人体感染HBV 后出现的第2 个血清学抗原标志物,提示肝细胞有较严重的损伤,患者有很强的传染性。抗-HBe 即e 抗体,是继乙肝核心抗体产生而出现的另一抗体。既往认为乙肝五项中的抗原与抗体出现有一定的规律,一般在急性感染期,表面抗体、e抗体与核心抗体均为阳性时提示处于乙肝恢复期;而e 抗体与表面抗原、核心抗体同时阳性,表明在慢性持续感染期,患者具有传染性。既往临床上较少见到e 抗原与e 抗体同时阳性的情况,随着检测方法敏感性、准确性的提高,目前临床上常常会出现乙肝五项阳性与既往不同的规律,临床上可出现e抗原与e 抗体同时阳性的情况,并且有研究认为其与肝脏慢性损伤、抗原转换、变异、病毒复燃等有关[2]。也有学者认为e 抗原与e 抗体同时阳性的慢性乙肝患者干扰素治疗的最终HBsAg 转阴率以及HBeAg 血清学转换率均高于恩替卡韦治疗的患者,对临床治疗有一定的指导意义[3]。随着e 抗原与e 抗体同时阳性病例在临床上的增加,了解此类患者的临床特征,对临床诊断、病情判断、治疗方案等均具有重要的临床意义。本研究分析慢性乙型肝炎患者e 抗原与e 抗体同时阳性者的临床特征,以期为临床诊断及治疗提供参考。现将结果报道如下。
1 资料与方法
1.1 一般资料
选择2016年1月至2017年12月在本院诊断治疗的慢性乙型肝炎患者500 例为研究对象。纳入标准:符合慢性乙型肝炎防治指南的诊断标准[4];对本次研究知情同意。排除标准:近6 个月内应用免疫调节剂治疗者、抗病毒治疗者、合并其他病毒感染,肝硬化,肝癌,妊娠,糖尿病血糖控制欠佳,甲亢,其他免疫系统疾病,心肝肾内分泌系统疾病,精神疾病史,神经疾病史。根据患者乙肝五项检测结果将所有病例分为3 组,其中HBeAg 与抗-HBe 均为阳性122 例纳入双阳性组,抗-HBe 阴性173 例纳入e抗原阳性组,205 例纳入HBeAg 阴性,抗-HBe 阳性组(e 抗体阳性组)。双阳性组男69 例,女53 例,年龄22~52 岁,平均(41.4±10.5)岁;e 抗原阳性组男91例,女82 例,年龄20~55 岁,平均(42.1±13.3)岁;e 抗体阳性组男108 例,女97 例,年龄21~58 岁,平均(42.8±14.8)岁。3 组一般资料比较差异无统计学意义(P>0.05),具可比性。
1.2 检测指标
1.2.1 试剂/仪器
HBsAg、HBeAg、HBeAb 试剂盒由Abbott Ireland Diagnostics Division 提供。AFP 试剂盒由Roche Diagnostics GmbH。检测仪器为罗氏Elecsys2010 免疫测定分析仪。HBV DNA 试剂盒购自中山大学达安基因股份有限公司(单位已经换算成拷贝/mL),仪器为Applied Biosystems 实时荧光定量PCR 检测仪。肝功能指标采用西门子全自动生化分析仪ADVIA2400 检测。
1.2.2 检测方法
HBsAg 检测采用微粒子化学发光法,>0.05 IU/mL 为阳性(说明书);HBeAg 与抗-HBe 采用电化学发光免疫分析法检测,参考范围:HBeAg>1.0 COI为阳性,抗-HBe<1.0 COI 为阳性(说明书)。肝功能指标检测:ALT、AST、ALP、GGT、TBIL、DBIL、TBA。AFP 采用流式荧光发光法检测。HBV DNA检测采用PCR 方法检测。
1.3 分析方法
比较3 组HBeAg 1~10.0 COI、~100.0 COI、以及>100.0 COI 比例,抗-HBe 0~0.1 COI、0~0.5 COI、0~1.0 COI 的比例;比较各组不同HBV DNA 拷贝水平分布情况;比较各组肝功能指标、AFP 结果异常比例。
1.4 统计学方法
采用SPSS 17.0 统计学软件分析。计数资料采用n或%表示,行χ列卡方检验;计量资料采用()表示,采用F检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 双阳性组与e 抗原阳性组HBeAg 分布比较
双阳性组68.0%的患者HBeAg 水平为1~10.0 COI,31.1%的患者为1~100.0 COI,只有0.8%患者为>100.0 COI,与e 抗原阳性组比较差异有统计学意义(P<0.05),见表1。

表1 双阳性组与e 抗原阳性组HBeAg 分布比较[n(%)]Table 1 Comparison of HBeAg distribution in double positive group and HBeAg positive group[n(%)]
2.2 双阳性组与e 抗体阳性组抗-HBe 分布比较
双阳性组63.9%的患者抗-HBe 水平为~1.0 COI,23.8%的患者为~0.5 COI,只有12.3%患者为0~0.1 COI,与e 抗原阳性组比较差异有统计学意义(P<0.05),见表2。

表2 双阳性组与e 抗体阳性组抗-HBe 分布情况比较[n(%)]Table 2 Comparison of anti-HBe distribution between double positive group and e antibody positive group[n(%)]
2.3 3 组HBV DNA 定量水平构成比比较
双阳组64.8%患者HBV DNA 定量水平在500~1×107拷贝/mL,30.3%的患者<5×102拷贝/mL,4.9%>1×107拷贝/mL;e 抗原阳性组18.9%>1×107拷贝/mL,e 抗体阳性组无>1×107拷贝/mL 病例,三组比较差异有统计学意义(P<0.05),见表3。

表3 3 组HBV DNA 定量水平构成比比较[n(%),拷贝/mL]Table 3 Comparison of the ratio of HBV DNA quantitative levels in 3 groups[n(%),拷贝/mL]
2.4 各组肝功能指标、AFP 异常率
双阳组ALT 异常率40.2%,TBA 异常率为43.4%,AFP 异常率为32.0%,显著高于e 抗原阳性组与e 抗体阳性组,差异有统计学意义(P<0.05),见表4。
3 讨论
HBeAg 是HBV 活跃复制的重要标志,抗-HBe常在HBeAg 消失不久后在血清中出现,提示HBV复制减少,传染性降低,也可提示病毒有变异[5-6]。感染HBV 后,常于第6 周血清出现HBV DNA,同时HBsAg、HBeAg 相继呈现阳性,抗HBcAg 大多于第6~8 周出现[7]。HBeAg 阳性提示病毒复制活跃,具有较强的传染性[8-9]。随着HBsAg、HBeAg效价下降并消失,抗-HBs 是保护性抗体,通常意味着疾病趋于康复,并能防止在感染;抗-HBe 的出现提示HBV 复制减少,肝脏炎症趋于消退[10-12]。随着检测方法敏感性的提高,目前临床上常常见到e抗原与e 抗体同时阳性的情况,给临床诊断及指导治疗造成了一定程度的干扰[13]。王菲等[14]的研究中,双阳性率为7.16%,本次研究结果中的阳性率显著高于上述研究结果,可能与检测方法、纳入样本量、纳入样本群体存在差异等有关。
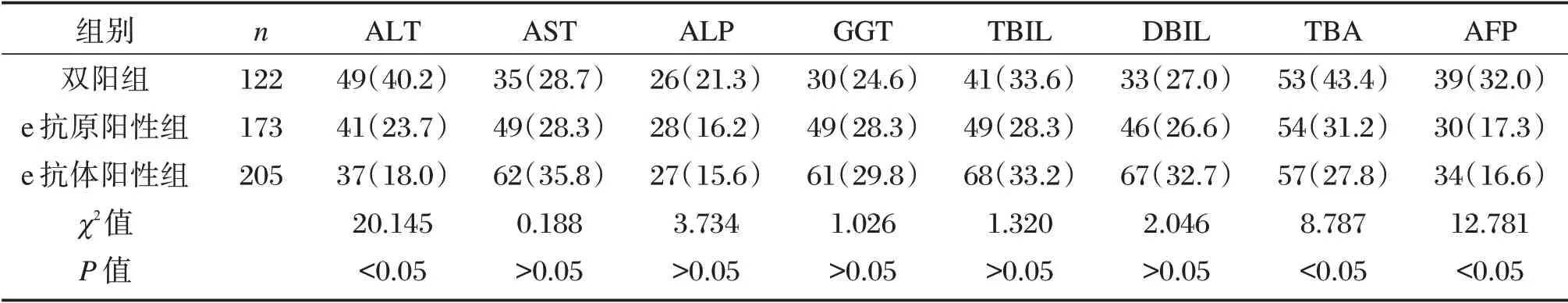
表4 肝功能指标、AFP 异常率[n(%)]Table 4 Liver function index and AFP abnormality rate[n(%)]
在本次研究结果提示大部分双阳性患者两者均处于较低的水平,处于抗原、抗体转换过程中,这个过程在时间上有重叠,因此被同时检测出[2]。另外HBV 发生变异,不同免疫的非耐受HBeAg 消长有差异,因此出现抗-HBe 同时存在的情况[15]。HBV DNA 定量结果也显示,双阳性患者病毒水平在中低水平,但病毒仍然在复制,有传染性,有少部分患者病毒水平较高。肝功能指标提示肝脏的损伤情况,在本次研究中,双阳性患者ALT 异常率最高,e 抗体阳性患者异常率最低,提示双阳性患者虽然已经出现e 抗体,处于恢复期,但是患者仍然存在肝脏的慢性损伤。AFP 的异常提示了肝癌及肝硬化风险,双阳性患者最高,e 抗体阳性患者最低。e 抗原的血清学转换是慢性乙肝恢复的重要目标之一[16]。目前临床上也有通过检测患者治疗过程中出现双阳性时HBeAg、HBeAb 时间、滴度以及ALT 水平来判断抗病毒治疗药物的效果。有学者研究显示对乙二醇干扰素首次出现双阳性及发生HBeAg 血清学转换时间明显早于恩替卡韦,认为干扰素有恩替卡韦布不具备的免疫调节作用[3]。在张健等[17]的研究中,双阳性患者HBV DNA 阴转率,HBeAg 阴转率以及HBeAg 血清转换率均较高。本次研究除了对双阳性患者HBV DNA 水平进行了分析,还对肝功能、AFP、抗-HBe 水平进行分析,探讨了双阳性患者病毒复制情况、肝脏损害情况、肝癌的风险性等。但本文不足之处是未分析经过治疗后患者的转归,以及不同治疗方法的效果,期待在今后的研究中收集资料进行分析,进而能为临床治疗提供参考。
综上所述,在临床工作中,部分慢性乙型肝炎患者HBeAg 与抗-HBe 同时阳性,在这个过程中,患者仍然有病毒复制,具有传染性,也会存在肝脏损伤,并且相较于单纯HBeAg 阳性或者抗-HBe 阳性,其AFP 水平更高,应引起足够重视。

