高敏与普通荧光定量PCR技术在慢乙肝患者抗病毒疗效监测中的对比研究
卢建华 杨莉 赵召霞 李芊璘 李敏然 刘玉珍 戴二黑 陈秀丽
近年来,世界卫生组织、美国肝病研究学会(American Association for the study of liver disease,AASLD)、欧洲肝脏研究协会(European Association for the Study of the Liver,EASL)、亚太肝病研究学会(Asia Pacific association for the study of liver,APASL)以及中华医学会肝病学分会等制订的慢性乙型肝炎防治指南均推荐采用灵敏度和精确度高的实时定量聚合酶链反应(real-time quantitative PCR)法,最低检测下限为10~15 IU/mL[1-4]。然而,目前国内各单位常用的HBV DNA定量检测方法的检测灵敏度在100~1 000 IU/mL之间,往往不能很好地满足临床对CHB 管理的需要。高灵敏度的HBV DNA 试剂推广速度缓慢的原因除了进口试剂价格昂贵外,还包括临床对高灵敏度的HBV DNA 检测的临床意义了解不深刻。本研究选取141 份接受乙型肝炎(chronic hepatitis B,CHB)抗病毒治疗慢性患者普通PCR 检测HBV DNA 阴性标本,采用高灵敏度的HBV DNA试剂进行复检,分析低值HBV DNA 的分布特征,并探索高灵敏度HBV DNA 检测在慢乙肝患者抗病毒疗效监测中的意义。
1 资料与方法
1.1 一般资料
49 例初治CHB 患者,均为2017年1月至2019年6月在石家庄市第五医院就诊患者。入选标准:年龄为18 周岁及以上,性别不限;HBsAg 阳性至少6 个月;未接受过任何治疗的HBeAg 阳性CHB患者。排除标准:合并其他肝炎病毒、人类免疫缺陷病毒(HIV)感染的患者;合并自身免疫性疾病的患者;其他原因所致的慢性肝病患者;肝硬化患者;原发性肝癌患者;妊娠或哺乳期患者;合并其他严重的慢性疾病患者;目前正在参与其它临床试验研究患者。本研究通过了石家庄市第五医院伦理委员会审批,所有患者均签署了知情同意书。
1.2 治疗方法
所有患者均符合《慢性乙型肝炎防治指南(2015年更新版)》[1]中抗病毒治疗的适应证。抗病毒治疗方案:恩替卡韦(苏州东瑞制药有限公司)0.5 mg,每日一次。
1.3 观察指标
治疗开始前(基线)、治疗开始后4、12、24、36、48 周检测HBV 血清学标志物和HBV DNA 定量水平,血清丙氨酸氨基转移酶(Alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(Aspartic aminotransferase,AST)。采用高敏PCR 试剂对141份采用普通PCR 检测HBV DNA 定量结果阴性(<500 IU/mL)的标本,进行复查。
1.3.1 主要仪器与试剂
DA3200 全自动核酸提取仪购自中山大学达安基因股份有限公司,ABI7500 型荧光定量PCR仪购自美国Life Technologies 公司,低温高速离心机购自德国Eppendorf 公司;HBV DNA 普通检测试剂盒购自中山大学达安基因股份有限公司,其说明书声明的灵敏度为500 IU/mL,线性范围为500~5.0×108IU/mL。HBV DNA 高敏检测试剂盒购自中山大学达安基因股份有限公司,其说明书声明的灵敏度为20 IU/mL,线性范围为20~1.0×109IU/mL。autolumo A2000plus 型全自动化学发光测定仪购自郑州安图生物工程股份有限公司。H7600 型全自动生化分析仪购自日本日立公司。
1.3.2 血清HBV DNA 检测
采用荧光定量PCR 技术检测血清HBV DNA含量。
1.3.3 HBV 血清学标志物检测
采用化学发光免疫分析技术定量检测血清HBsAg、抗-HBs、HBeAg、抗-HBe、抗-HBc 水平。
1.3.4 肝功能检测
采用全自动生化分析仪检测血清ALT、AST水平。
1.4 统计学方法
将研究对象的临床数据导入Excel 表格中,采用SPSS 17.0 软件对数据进行统计分析,计量资料以()表示,组间比较用方差分析;计数资料以例数(n)或百分率(%)表示,组间比较用卡方分析。P<0.05 为差异有统计学意义。
2 结果
2.1 高敏PCR 与普通PCR 检测CHB 患者血清HBV DNA 结果比较
141 份采用普通PCR 检测结果阴性CHB 患者标本中,采用高敏PCR 试剂进行复查,根据血清HBV DNA 定量水平IU/mL,存在以下5 种结果,即>500、20~500、10~20、<10 IU/mL 和阴性,比例分别为13.5%、31.9%、18.4%、30.5%和5.7%,见表1。
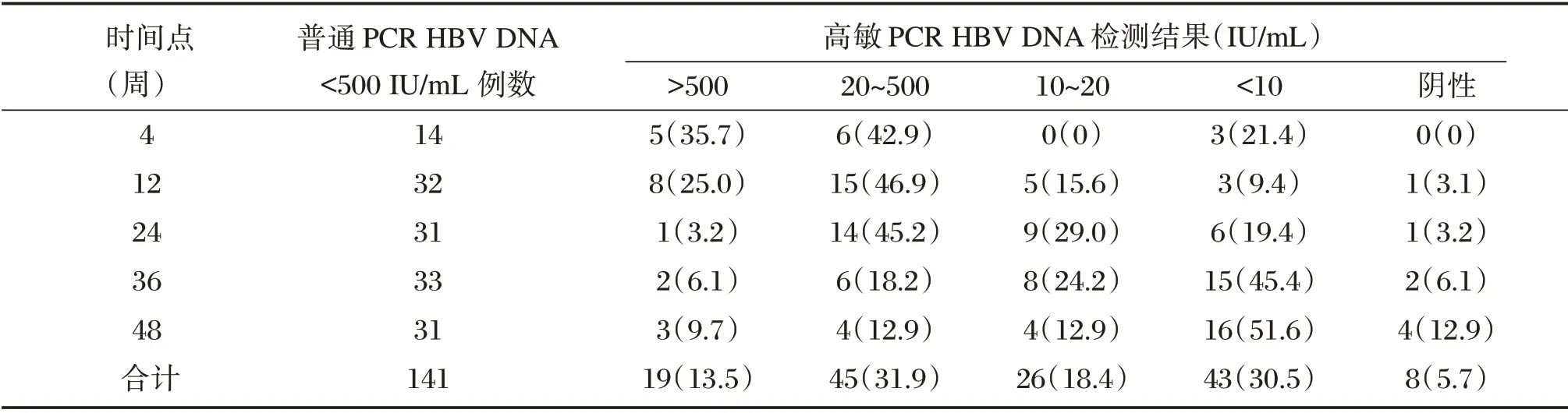
表1 高敏PCR 与普通PCR 检测CHB 患者血清HBV DNA 结果比较[n(%)]Table 1 Comparison of serum HBV DNA results between high sensitivity and normal PCR in CHB patients[n(%)]
2.2 CHB 患者血清HBV DNA 载量与ALT、AST水平的关系
按照高敏PCR 试剂血清HBV DNA 的检测结果分组,各组ALT、AST 的状况见表2。随着血清HBV DNA 水平增高各组ALT 水平呈逐渐升高的趋势,但差异无统计学意义(P>0.05)。HBV DNA阴性组、<10 IU/mL 组和10~20 IU/mL 组与HBV DNA>500 IU/mL 组CHB 患者AST 水平相比较,差异均有统计学意义(P值分别为0.010、0.012、0.023)。其余各组之间比较,差异均无统计学意义(P>0.05)。随着血清HBV DNA 水平增高,各组ALT、AST 异常升高率也存在逐渐增加的趋势,但差异无统计学意义(P>0.05)。
表2 CHB 患者血清HBV DNA 与ALT、AST 的关系[(±s)]Table 2 Relationship between serum HBV DNA and ALT and AST in CHB patients[(±s)]
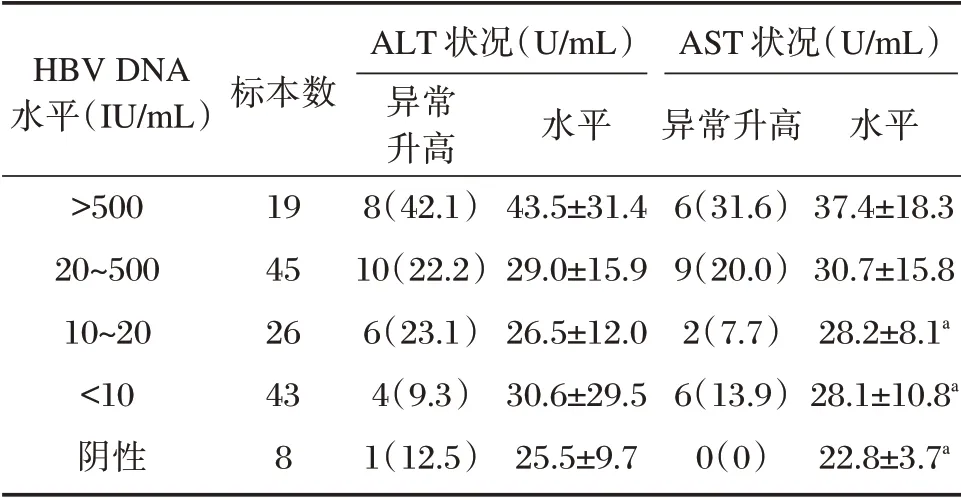
表2 CHB 患者血清HBV DNA 与ALT、AST 的关系[(±s)]Table 2 Relationship between serum HBV DNA and ALT and AST in CHB patients[(±s)]
与>500 IU/mL 组比较,P<0.05。
HBV DNA水平(IU/mL)>500 20~500 10~20<10阴性标本数19 45 26 43 8 ALT 状况(U/mL)异常升高8(42.1)10(22.2)6(23.1)4(9.3)1(12.5)水平43.5±31.4 29.0±15.9 26.5±12.0 30.6±29.5 25.5±9.7 AST 状况(U/mL)异常升高6(31.6)9(20.0)2(7.7)6(13.9)0(0)水平37.4±18.3 30.7±15.8 28.2±8.1a 28.1±10.8a 22.8±3.7a
2.3 CHB 患者血清HBV DNA 与血清HBV 标志物的关系
随着血清HBV DNA 水平逐渐降低,各组血清HBeAg 阳性率和水平也存在逐渐降低的趋势。其中,HBV DNA 阴性组血清HBeAg 阳性率显著低于10~20 IU/mL 和>500 IU/mL,差异有统计学意义(P值分别为0.033、0.006),但各组HBeAg 水平之间差异无统计学意义(P>0.05),见表3。
表3 CHB 患者血清HBV DNA 载量与HBeAg 和抗-HBc状况的关系[(±s)]Table 3 Relationship between serum HBV DNA load and HBeAg and anti-hbc status in CHB patients[(±s)]
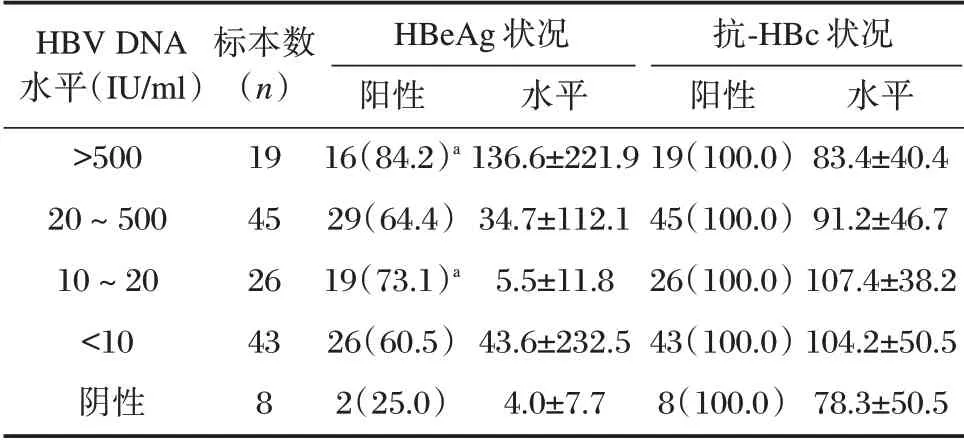
表3 CHB 患者血清HBV DNA 载量与HBeAg 和抗-HBc状况的关系[(±s)]Table 3 Relationship between serum HBV DNA load and HBeAg and anti-hbc status in CHB patients[(±s)]
与HBV DNA 阴性组比较,P<0.05。
HBV DNA水平(IU/ml)>500 20~500 10~20<10阴性标本数(n)19 45 26 43 8 HBeAg 状况阳性16(84.2)a 29(64.4)19(73.1)a 26(60.5)2(25.0)水平136.6±221.9 34.7±112.1 5.5±11.8 43.6±232.5 4.0±7.7抗-HBc 状况阳性19(100.0)45(100.0)26(100.0)43(100.0)8(100.0)水平83.4±40.4 91.2±46.7 107.4±38.2 104.2±50.5 78.3±50.5
3 讨论
本文对比了同一公司的普通和高敏乙型肝炎病毒核酸定量检测试剂盒(PCR-荧光探针法)的检测结果,结果显示141 份采用普通HBV 核酸定量检测试剂盒检测结果阴性(<500 IU/mL)的CHB 患者标本中,采用高敏PCR 试剂盒检测仅有8 份(5.7%)为阴性。HBV 复制的一个最显著的特点是经mRNA 中间体进行逆转录,这一过程由于缺乏校对酶的作用而容易发生错误,核苷酸替代率约为1~3×10-5/nt/年[6]。HBV 变异率高于其他DNA病毒4 个数量级,而低于RNA 病毒1~2 个数量级。普通PCR 试剂一般采用S 或C 区等保守段基因进行单靶标扩增,因此,不可避免的存在定量值偏低甚至漏检可能[7]。一项179 例HBV 临床样本研究显示,6.1%(11 例)Roche CAP/CTM 定量值显著低于(差值≥1.0 log10 IU)双靶标扩增定量值,其中4 例在nt1827-nt1970 位突变,位于Roche试剂扩增靶区[8]。有研究显示双靶标扩增曲线荧光值高于单靶标,CT 值略有提前[9]。本文研究结果再次证实了这一结论,有19 份(13.5%)检测结果高于500 IU/mL,范围在696~41 500 IU/mL之间。
本文进一步分析了这些低病毒载量(<500 IU/mL)标本的临床特征,随着血清HBV DNA 水平的逐渐增高,各组ALT、AST 水平和异常升高率也存在逐渐增加的趋势,但是仅仅各组AST 水平差异有显著意义(P<0.05)。而且,随着血清HBV DNA水平逐渐降低,各组血清HBeAg 阳性率和水平也存在逐渐降低的趋势。其中,HBV DNA 阴性组血清HBeAg 阳性率显著低于10~20 IU/mL 组和>500 IU/mL 组(P<0.05),提示高灵敏度的HBV DNA 定量检测结果在CHB 患者抗病毒治疗监测中发挥的重要作用。HBV DNA 定量检测主要用于判断慢性HBV 感染的病毒复制水平,可用于抗病毒治疗适应证的选择及疗效的判断[5]。有文献报道治疗早期HBV DNA 是核苷(酸)类药物疗效的预测因子,治疗第24 周时的HBV DNA 值可预测长期治疗的VR 率,第24 周时HBV DNA <2.3 log10IU/mL的患者3年VR 达到98.6%,治疗24 周时HBV DNA 值可预测HBeAg 清除率[10],第24 周时HBV DNA<63 IU/mL 的 患 者2年HBeAg 清 除 率 达43.2%[11]。而且,对抗病毒治疗耐药的最初临床表现是病毒学突破,病毒学突破可早于生化学数月甚至数年[12-13]。所有这些研究结果均提示灵敏度和精确度高的HBV DNA 检测方法的重要性和必要性。普通PCR 检测方法由于灵敏度差,一般检测下限仅为500 IU/mL,远远不能满足临床慢乙肝管理的需求,因此,需要大力推广高敏HBV DNA定量检测技术。
本文发现了一些非常有临床价值的结果,但由于例数偏少,还需要多中心、大样本临床研究以及连续长期随访加以证实。本院牵头7 个临床研究中心,已经开展了为期2年的恩替卡韦抗病毒治疗队列研究,期望对高灵敏度HBV DNA定量检测技术的临床价值有更深入的探讨和评价。

