大鼠急性一氧化碳中毒后心脏缝隙连接的重构
王学惠,李慧丹,朱秀英,刘慧兵,张永春△
(新乡医学院第一附属医院:1.心血管内科;2.急诊科,河南卫辉 453100)
急性一氧化碳中毒(acute carbon monoxide poisoning,ACOP)是我国北方冬季最常见的急性中毒性疾病,也是病死率最高的职业中毒[1-2]。在许多国家是家庭事故和自杀的主要原因,主要是由于对心脏和中枢神经系统的损害[3-5]。国内外屡见报道ACOP引起的神经系统损害,而对心脏损害关注不够。ACOP引起心肌损伤表现为心律失常、心力衰竭等,早期表现以心律失常为主,其确切发病机制不清。而关于ACOP条件下心肌缝隙连接的改变,国内外鲜见报道。本研究采用大鼠为实验动物,应用腹腔内注射纯一氧化碳气体,制备ACOP动物模型,观察心肌缝隙连接的改变,拟探讨ACOP导致心肌损害的发病机制。
1 材料与方法
1.1材料 动物:健康雄性青年Wistar大鼠40只,3~5月龄,体质量(300±25)g,购于新乡医学院实验动物中心。试剂:小鼠缝隙连接蛋白(connexin,Cx)43多克隆抗体购自美国Zymed,山羊抗小鼠IgG购自北京中山生物公司。二氨基联苯胺(DAB)试剂盒,两步免疫组织化学(IHC)检测试剂盒购自北京中杉金桥生物技术有限公司。
1.2方法
1.2.1动物分组 将40只健康雄性青年Wistar大鼠分为ACOP组和对照组,每组20只。
1.2.2一氧化碳气体的制备 制备一氧化碳气体采用甲酸加浓硫酸,浓硫酸用作脱水剂,可得纯净的一氧化碳气体,将一氧化碳气体收集在负压引流袋中备用,于应用前新鲜制备。
1.2.3ACOP动物模型的建立 参照PENNEY[6]报道方法并改进。ACOP组大鼠腹腔内注射一氧化碳气体170 mL/kg, 对照组大鼠腹腔内注射空气 170 mL/kg。
1.2.4大鼠心电图的描记 腹腔注射2 h后,通过腹膜内注射水合氯醛(300 mg/kg)麻醉动物。将大鼠固定在手术台上,用普通的单通道心电图机,将输出肢体导线的4个电极转换成鳄鱼夹。走纸速度为25 mm/s,电压为10 mv/mm。选择抗干扰,记录Ⅱ导联30 s。
1.2.5测定尾血碳氧血红蛋白(HbCO)水平 中毒后2 h,通过尾切法采集大鼠的尾血,并通过改进的Rodkey FL微量定量法测量血液HbCO水平。
1.2.6ACOP评价标准 观察大鼠反应和检测尾血HbCO的水平来确定中毒程度。重度ACOP大鼠表现为精神萎靡,四肢瘫软,运动少,呼吸急促,有便溺。
1.2.7心肌组织Cx43 IHC染色 取左心室心肌组织,脱水后冰冻切片,厚度7 μm。采用IHC染色方法,操作步骤如下:玻片复温后磷酸盐缓冲液(PBS)漂洗3 min,0.3% Triton-100室温孵育10 min, PBS漂洗3次×3 min,再0.3%过氧化氢室温孵育10 min, PBS漂洗3次×3 min,用5%驴血清室温封闭1 h,滴加1∶100稀释的 Cx43多克隆抗体,4 ℃孵育过夜, PBS漂洗3次×min,滴加二抗,室温孵育30 min, PBS漂洗3次×3 min,应用 DAB溶液显色,用蒸馏水冲洗,用苏木精复染,用乙醇梯度脱水,用二甲苯透明,并用中性胶封片。以抗体稀释液代替一抗作为阴性对照。阳性结果判断:Cx43表达阳性是深棕色颗粒,苏木精复染的细胞核是淡蓝色的。
1.2.8左心室心肌组织Cx43定量检测 取约30 mg的心肌组织置于研钵内,用液氮研磨,并加入裂解液,离心后取上清液,应用二喹啉甲酸(BCA)法检测蛋白浓度。加入5×上样缓冲液后,每孔上样蛋白50 μg,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS- PAGE)分离后,采用Western blot将蛋白质转至氯二氟乙烯(PVDF)膜,用5%脱脂牛奶室温封闭1 h, 然后分别加入抗 Cx43和 GAPDH的抗体,4 ℃摇床孵育过夜。用 TBST漂洗3次×10 min,洗膜后加入二抗,室温孵育1 h,用 TBST漂洗3次×10 min,加入电化学发光(ECL)显色,凝胶成像仪扫描拍照,用 Image J软件进行条带灰度分析, 以 Cx43与 GAPDH条带的比值来评定 Cx43表达水平。
1.2.9透射电镜观察心肌超微结构 麻醉后立即开胸取出心脏,将左心室心肌组织切成1 mm3的大小块状,快速置于4%戊二醛溶液中固定,固定24 h后,将标本送至西安交通大学电镜实验中心进行检测。先将组织块冲洗,应用1%锇酸固定1 h,再梯度丙酮脱水,应用环氧树脂浸透,然后包埋,聚合,切片,片厚约50 nm。应用醋酸铀和柠檬酸铅双重染色,日立 H-7650型透射电子显微镜下观察心肌组织的超微结构。
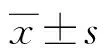
2 结 果
2.1两组大鼠血液HbCO水平比较 ACOP组大鼠中毒后,5~10 min出现烦躁、撞笼,15~25 min出现活动减少、抽搐和昏迷。嘴唇的黏膜、肢端的皮肤颜色转为樱桃红色,部分大鼠出现角弓反张。 对照组大鼠无上述表现。 2 h后采大鼠尾血检测HbCO水平,ACOP组为(65.13±4.02)%,对照组为(5.22±0.89)%, 两组比较差异有统计学意义(P<0.05)。
2.2两组大鼠心电图比较 ACOP组大鼠出现心率减慢,窦性心动过缓、心房纤颤及S-T段压低或抬高的改变。心电图异常总发生率为80.00%,与对照组比较差异有统计学意义(P<0.05),见图1。
2.3两组大鼠心肌组织Cx43 IHC染色比较 对照组光镜下观察,Cx43表达阳性的棕色颗粒,呈高度规律性排列、分布密集。在心肌纤维纵切面,棕色颗粒呈簇状,多数分布在垂直于心肌细胞长轴的端-端连接处,而少数分布于与长轴平行的侧-侧连接处。ACOP组光镜下观察,Cx43表达阳性的棕色颗粒,呈无序、紊乱分布,端-端处棕色颗粒分布减少,侧-侧处及细胞表面分布增加,见图2。

a:P<0.05,与对照组比较
图1两组大鼠心电图相关指标比较

A:对照组;B:ACOP组
图2大鼠心肌组织Cx43 IHC染色(×400)
2.4两组大鼠左心室心肌组织Cx43水平比较 ACOP组与对照组大鼠总Cx43(T-Cx43)表达水平比较,差异无统计学意义(P>0.05);而ACOP组大鼠磷酸化Cx43(P-Cx43)表达明显降低(P<0.05),且P-Cx43/T-Cx43两组比较差异有统计学意义(0.9039vs.0.4905,P<0.05),见图3。

a:P<0.05,与对照组比较
图3两组大鼠左心室心肌组织Cx43水平比较
2.5两组大鼠心肌组织超微结构比较 电子显微镜观察显示,对照组大鼠心肌细胞肌丝排列整齐,结构清晰,肌节规则,线粒体水平丰富,脊呈板层状横向排列且致密;闰盘结构清晰,糖原水平丰富。ACOP组大鼠肌原纤维水肿,排列紊乱,电子密度降低,部分肌原纤维溶解,部分肌节断裂;线粒体肿胀,基质密度淡,线粒体脊排列紊乱;闰盘结构模糊,部分闰盘融合消失,见图4。
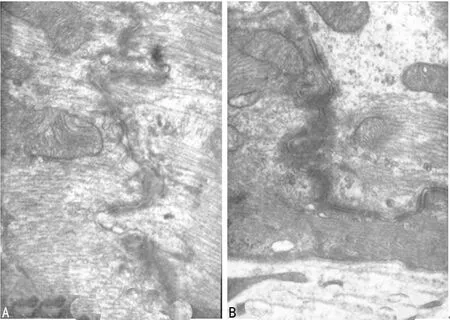
A:对照组;B:ACOP组
图4两组大鼠左心室心肌组织的超微结构(×20 000)
3 讨 论
一氧化碳中毒对机体的损害主要是缺氧。一氧化碳中毒可引起心肌缺氧,加上一氧化碳对心肌细胞的直接毒性作用,更容易引起心肌损伤[7]。ACOP引起心肌缺血或梗死的机制有[8]:(1)由于一氧化碳和Hb结合形成HbCO,血液的携氧能力降低,O2-Hb解离曲线向左移,使氧气不能释放到组织,导致组织缺氧;(2)一氧化碳和肌红蛋白结合使心肌线粒体受损,它与线粒体中的细胞色素氧化酶相结合,可抑制细胞呼吸链,可以引起细胞呼吸抑制,造成组织进一步缺氧,血管内皮细胞肿胀,血液循环发生障碍,血栓形成,可阻断冠状动脉血管,导致心肌梗死。ACOP引起各种心律失常的机制[8]:当ACOP引起心肌细胞急性缺氧时,会导致心肌细胞缺乏能量,局部酸性代谢产物增加,导致细胞膜的离子转运功能受损,细胞内钾丢失,而钠潴留。特殊传导系统的潜在起搏膜电位降低,去激化速度减慢,自律性增高,而传导性降低。引起电兴奋传导产生单向阻滞、折返,也可产生异位节律,发生各种心律失常。
ACOP后出现心肌损伤,临床特征以心电图异常为主,ACOP后心电图无特异性改变。常见心电图异常为T波低平、倒置、S-T段压低或抬高、Q-T间期延长,可出现早搏、心房颤动、房室和室内传导阻滞、低电压等[9-10]。本研究在ACOP组大鼠的心电图中观察到心肌受损和多种心律失常,与文献一致。
缝隙连接主要存在于闰盘处,是心肌细胞间连接的主要方式。缝隙连接使心脏成为功能上的整体,使各部位协调运动。在成年心脏,缝隙连接主要位于细胞两端闰盘处,由连接蛋白组成的两个连接子对接而成,而连接子又由6个亚单位-连接蛋白组成[11]。多种心血管疾病的发生、发展与缝隙连接通道功能的受损有关,也与Cx表达改变有关,尤其在心律失常发生中的作用[12]。哺乳类动物心室肌主要表达连接蛋白是Cx43,Cx43属于磷蛋白,P-Cx43对缝隙连接通道功能有非常重要的影响[13]。
缝隙连接的分布和功能状态与心肌细胞的传导方向和速度密切相关。在心房肌,电兴奋通过缝隙连接纵向传导速度较横向传导速度快10~20倍,而在心室肌中传导速度快3倍,与Cx主要分布在心肌细胞两端特点相一致;利用Cx43基因的定标突变技术发现,杂合子小鼠(Cx43-/+)比野生型小鼠(Cx43+/+)心室肌外膜的电传导速度下降30%~40%,QRS波的复极时间明显延长;体外培养的大鼠心肌细胞,随着细胞缝隙连接增加,细胞间的不规则收缩趋于同步;研究发现,心肌梗死、缺血/再灌注、心肌炎与心肌病等心肌中均出现与心律失常相关Cx43表达的降低与分布紊乱[14]。而UZZAMAN等[15]还发现,这种改变可伴随纵向传导速度下降30%。
李玉光等[16]研究发现,Cx43在急性心肌缺血时迅速降解,端-端连接处的降解比侧-侧连接处明显,中层心肌细胞间的Cx43比心内膜和心外膜更易降解。Cx43在端-端处分布减少引起心肌细胞纵向传导的速度明显下降,传导各向异性发生明显改变。这些改变会引起细胞间传导阻滞和折返,而导致发生心律失常。
本研究IHC染色结果显示,ACOP组心肌Cx43表达的分布发生了明显变化。细胞间端-端处Cx43减少,细胞侧面及细胞质内分布增加,且由纵轴向横轴重新分布,分布散乱、无序。与急性缺血时心肌Cx43分布特点相同。急性缺血时心肌的Cx43表达下降,而本文ACOP组大鼠Cx43分布密度不均匀,有些部位稀疏,有些部位密集,可能与ACOP后血管内皮细胞发生肿胀,血循环发生障碍,形成血栓,阻塞冠状动脉血管,引起心肌梗死,使Cx43在局部心肌降解有关。Cx43表达密度不均,提示Cx43在心肌细胞中各部位分布不均一,会导致心肌细胞间电偶联不均一性增大,导致兴奋传导速度和扩布路径发生复杂的变化,会诱导各种心律失常。
研究报道,急性缺血性心肌组织中的P-Cx43水平下降而去磷酸化Cx43(NP-Cx43)水平升高,这使细胞间脱偶联,导致传导异常而出现心律失常[17]。YUNIS等[18]在研究扩张型心肌病心律失常机制时认为,P-Cx43水平、分布改变与疾病发生明显相关。Cx43磷酸化也参与心肌缺血的病理过程。BEARDSLEE等[17]研究发现,正常情况下心肌中的Cx43是磷酸化状态。当进行缺血预处理时,Cx43出现去磷酸化,而NP-Cx43的比例随着缺血时间的增加而增加。再灌注时,P-Cx43表达增加,心肌细胞功能逐渐恢复。因此,缺血诱导的解偶联与Cx43的去磷酸化,缝隙连接内的NP-Cx43的累积及Cx43从缝隙连接向细胞内的转移相关。
本研究对T-Cx43和P-Cx43水平均进行检测,发现ACOP时心肌组织的P-Cx43/T-Cx43的比值明显降低,说明Cx43的磷酸化程度明显降低,与急性缺血心肌组织表现相似。
赵立明等[19]研究发现一氧化碳中毒后大鼠心肌细胞出现弥漫性心肌细胞线粒体肿胀,线粒体嵴减少,有些嵴溶解消失而变空。而本研究中观察到ACOP组大鼠心肌的超微结构病理变化类似TRITAPEPE等[20]的报道。可见心肌肌原纤维水肿,肌节断裂,糖原颗粒减少。闰盘结构模糊不清,部分闰盘融合消失。与本课题组近期研究的容量超负荷心力衰竭大鼠左心室心肌缝隙连接/Cx43的重构相似:心力衰竭时心肌的缝隙连接受损,连续性中断,部分缝隙连接溶解消失,电子密度降低;Cx43分布模式发生明显改变,不是集中于细胞闰盘处,而散在分布在细胞侧面和细胞质内;Cx43表达总量明显下降[21]。闰盘及缝隙连接结构的改变与IHC显示的Cx43分布变化相符,与文献[22]报道一致。ACOP组大鼠心肌细胞部分闰盘消失,提示ACOP可导致细胞间连接结构出现改变,导致脱偶联,且其改变呈非均匀性、非均质性,这种非均质性的缝隙连接改变较均质性明显增加折返性心律失常发生的可能性。
心脏是ACOP后最易受到损伤的器官,心肌组织中Cx43无序、紊乱分布,在ACOP后发生心律失常的机制中起着非常重要的作用,而心肌细胞和缝隙连接超微结构的变化是其发病的解剖学基础。缝隙连接/Cx43将成为ACOP后心肌损害的防控靶点。

