SU11274逆转肝细胞生长因子诱导的PC-9肺癌细胞株对吉非替尼耐药及其机制研究
张 佳,尹海莲,宋 勉,安昌善
(延边大学附属医院呼吸内科,吉林延吉 133000)
吉非替尼开创了非小细胞肺癌(non small cell lung cancer,NSCLC)新的靶向治疗模式,但因其尚不明确的耐药机制,致使肺癌的5年生存率仍不容乐观[1-3]。间质表皮转化因子(c-mesenchymal-epithelial transition factor,c-Met)被证实是唯一能结合肝细胞生长因子(hepatocyte growth factor,HGF)的高亲受体, HGF与c-Met结合后,c-Met自体磷酸化,激活细胞内多种信号通路[4-6],促使肿瘤的进展、侵袭、转移和血管生成[7]。c-Met抑制剂主要包括小分子抑制剂、抗c-Met抗体、生物性抑制剂、HGF拮抗剂[8-13]。SU11274是一种靶向c-Met小分子的酪氨酸激酶抑制剂,具有抗肿瘤细胞增殖、侵袭和抗血管生成作用。本研究旨在进一步探讨 SU11274 在裸鼠体内逆转 HGF诱导的 PC-9 肺癌细胞株对吉非替尼耐药及其机制。
1 材料与方法
1.1材料 (1)细胞:PC-9细胞由同济大学附属上海市肺科医院中心实验室提供;人胚肺成纤维细胞MRC-5由上海生命科学院细胞库提供。(2)药物及试剂:吉非替尼原料购自济南汇丰达化工有限公司;四甲基偶氮唑盐(MTT)粉购自美国Amresco公司;SU11274(相对分子质量为568.09)购自美国Sigma公司。磷酸化c-Met(p-Met,Tyr1234/1235,145×103)、c-Met(140,170×103)、细胞外信号调节激酶1/2(Erk1/2,42/44×103)、磷酸化Erk1/2(p-Erk1/2,Tyr202/Y204,42/44×103)购自美国CST公司。(3)动物:4周龄、SPF级、雌性BALB/c裸鼠49只,购买于上海斯莱克实验动物有限公司,许可证号SCXK(沪)2003-0003。食物120 ℃高压蒸气灭菌45 min,每日使其维持14 h无光、10 h光照的明暗周期,饮水过氯化为12~15 ppm。
1.2方法
1.2.1细胞培养及药物配制 将PC-9细胞悬浮液放入含10%胎牛血清达尔伯克改良伊格尔培养基(DMEM)的离心管内,离心、洗涤,弃上清液,加入适当培养基,37 ℃、5%CO2恒温细胞培养箱中孵育,24 h后更换1次细胞培养液,每2~3天待细胞长满培养瓶时传液换代。取SU11274 10 mg,用220 μL二甲基亚砜(DMSO)溶解配制成最终浓度小于0.1%。
1.2.2MTT法检测HGF、吉非替尼、SU11274单独或联合处理后PC-9细胞增殖 取对数生长期的PC-9细胞用胰酶消化后,以5×103个/孔细胞接种在96孔板,细胞贴壁后,加入干预药物及细胞因子,细胞培养箱中孵育72 h。将20 μL MTT(5 mg/mL)加入每孔内,继续放进细胞培养箱中孵育4 h。1 200 r/min离心10 min,弃上清液, 200 μL DMSO再加入每孔中,充分混匀约30 min至结晶完全溶解。用酶标仪测量波长530 nm时光密度(OD)值,以上步骤重复进行3次。
1.2.3流式细胞仪检测HGF、吉非替尼和SU11274单独或联合处理后PC-9细胞凋亡 取对数生长期的PC-9细胞按1×105个/孔接种于6孔板,培养24 h。细胞贴壁后弃原培养液,给予相应药物及细胞因子处理。72 h后,收集全部细胞,1 500 r/min离心5 min,弃去上清液,磷酸盐缓冲液(PBS)洗涤细胞1次,再用1×Binding Buffer缓冲液调整细胞浓度为1×106个/mL,取100 μL(1×105个/孔细胞)到新的5 mL试管,各管内加入5 μL异硫氰酸荧光素(FITC)和5 μL碘化丙锭(PI),轻轻摇匀,室温(20~25 ℃)、避光15 min。上机前加入1×Binding Buffer缓冲液400 μL,1 h后进行检测。按以上步骤重复进行3次。
1.2.4Western blot检测不同浓度的SU11274处理后及HGF、吉非替尼和SU11274单独或联合处理后PC-9细胞内c-Met及其下游通道蛋白表达 取5×105个/孔对数生长期的PC-9细胞,给予相应处理后-20 ℃保存。立即冰上裂解细胞,离心收集各组蛋白裂解液。用二喹啉甲酸(BCA)蛋白定量法蛋白定量。取30~40 μg蛋白经8%~10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,转印至NC膜上,用5%脱脂奶粉封闭1 h,一抗孵育TBST洗膜,二抗室温摇床孵育再次TBST洗膜,化学发光(ECL)试剂显色、曝光成像。
1.2.5裸鼠移植瘤模型的建立及药物抑瘤的分析(SU11274+吉非替尼) 将PC-9细胞和MRC-5细胞消化后,吹打,混匀,使其分别悬浮在DMEM 培养基,制成最终密度PC-9为5×106个/mL、MRC-5为5×106个/mL的细胞悬液。将49只4周龄裸鼠分为7组,每组7只,即对照组(C组)、HGF组(H组)、HGF+SU11274组(HS组)、HGF+0.1% DMSO组(HD组)、吉非替尼组(G组)、HGF+吉非替尼组(HG组)、HGF+吉非替尼+SU11274组(HGS组)。C组和G组每只裸鼠右侧肋下皮下接种PC-9细胞悬液100 μL,H组、HS组、HD组、HG组、HGS组每只裸鼠右侧肋下皮下接种PC-9+MRC-5细胞悬液混合液100 μL。当肿瘤直径达到4 mm时,C组、H组、HS组和HD组给予1% Tween-80灌胃,G组、HG组、HGS组接受25 mg·kg-1·d-1的吉非替尼灌胃,同时,HS组、HGS组接受100 μg/d的SU11274瘤内注射,HD组接受100 μL的0.1% DMSO瘤内注射,每周给药5 d,连续4周。每天测量1次裸鼠的质量,每隔3~4 d用游标卡尺测量肿瘤直径(L)、短径(D),计算肿瘤体积,肿瘤体积(V)=0.5×L×D2,绘制肿瘤生长曲线。末次给药后断颈处死裸鼠,剥离肿瘤组织,称取质量计算抑瘤率。抑瘤率=(对照组瘤体质量-实验组瘤体质量)/对照组瘤体质量×100%。
1.2.6免疫组织化学(IHC)法检测SU11274处理后PC-9细胞移植瘤组织中c-Met及其下游通道蛋白表达 将已经剥离的肿瘤组织按常规方法进行固定、包埋,并制成石蜡切片。石蜡切片脱蜡并水化后用PBS洗涤3次×3 min。用3%的过氧化氢PBS溶液孵育切片30 min后PBS溶液洗涤3次×3 min。将石蜡切片用微波法进行抗原修复,5%羊血清室温孵育30 min后甩去羊血清,加入一抗室温孵育1 h后4 ℃过夜,孵育二抗后室温孵育2 h。快速加入二氨基联苯胺(DAB),孵育约5 min,PBS溶液洗3次×3 min。苏木素染色,PBS返蓝5 min,脱水,透明,以中性树胶封片。拍摄所有切片,每组中随机抽取10张照片,用IPP6.0图像分析软件进行定量分析。
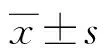
2 结 果
2.1MRC-5细胞分泌HGF 酶联免疫吸附测定(ELISA)法检测的结果显示,PC-9细胞培养上清液中未检测到HGF,而在MRC-5细胞的培养上清液中检测到HGF水平为(1 262.07±89.78) pg/mL,二者比较差异有统计学意义(P<0.04)。
2.2MRC-5细胞分泌的HGF对NSCLC细胞中c-Met及其下游通道蛋白表达的影响 Western blot检测结果显示,PC-9细胞与MRC-5细胞培养上清液混合培养前后,PC-9细胞中的c-Met 及其下游蛋白的表达差异无统计学意义(P>0.05);而其磷酸化的蛋白表达活性明显增加(P<0.05)。定量检测也可见与MRC-5细胞培养上清液混合培养后,PC-9细胞中c-Met及其下游蛋白表达水平差异无统计学意义(P>0.05),而p-Met及其下游蛋白水平明显增加(P<0.05),见图1。

图1 HGF刺激NSCLC细胞中c-Met及其下游蛋白表达
2.3SU11274作用下吉非替尼对PC-9细胞各组移植瘤生长的抑制作用 PC-9细胞移植瘤的C、H、HS、HD组在治疗开始时至第25天,组间肿瘤体积比较差异无统计学意义(P>0.05)。在治疗开始第7~25天,G、HG、HGS组移植瘤体积均明显缩小(P<0.05),G、HGS组移植瘤体积在第25天为(84.3±15.69) mm3、(66.11±17.79) mm3,而HG组为(201.57±48.52) mm3。各组裸鼠PC-9细胞移植瘤体积不同时期比较,见表1、图2。
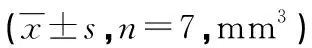
表1 各组裸鼠PC-9细胞移植瘤体积不同时期比较
a:P<0.01,与G组比较;b:P<0.01,与HG组比较;c:P<0.01,与HGS组比较;d:P<0.05,与HG组比较
2.4SU11274对吉非替尼抑制裸鼠PC-9细胞移植瘤质量的影响 第25天时裸鼠处死后称取瘤质量。在PC-9细胞的移植瘤中,其瘤质量C组为(680±373) mg,H组为(805±492) mg,HS组为(713±258) mg,HD组为(566±364) mg,C、H、HS、HD组裸鼠移植瘤质量组间比较差异无统计学意义(P>0.05)。G组瘤质量为(29±12) mg,HG组为(66±10) mg,HGS组为(33±17) mg,G组的瘤体质量明显小于C组和HG组,其差异有统计学意义(P<0.05);HG组肿瘤质量小于H组,差异有统计学意义(P<0.05);HGS组肿瘤质量小于HS组及HG组,其差异均有统计学意义(P<0.05);而HGS组肿瘤质量与G组比较差异无统计学意义(P>0.05),见图2。吉非替尼对PC-9细胞G组、HGS组抑瘤率分别为95.80%和95.15%,而对HG组的抑瘤率为90.30%。
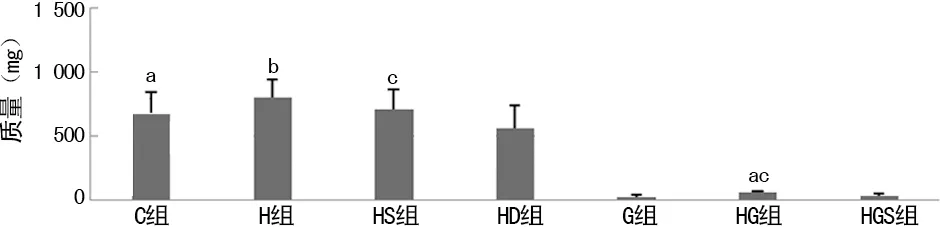
a:P<0.05,与G组比较;b:P<0.05,与HG组比较;c:P<0.05,与HGS组比较
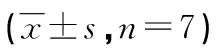
2.5SU11274对PC-9细胞移植瘤组织中c-Met及其下游通道蛋白表达的影响 将剥离出的裸鼠移植瘤组织进行IHC检测发现c-Met和p-Met是位于细胞膜和细胞质的蛋白。与HS、HGS组比较,p-Met在C、H、HD、G、HG组的表达强度明显升高(P<0.05);与C、G组比较,H、HD、HG组p-Met的表达强度明显升高(P<0.05)。Stat3在细胞内位于细胞质,Stat3经磷酸化后进入细胞核。各组Stat3的表达强度比较差异无统计学意义(P>0.05);而H、HD、HG组中可见p-Stat3的表达强度,与C、HS、G、HGS组比较明显增高(P<0.05)。Akt和p-Akt均存在于细胞质,各组Akt的表达强度比较,差异无统计学差异(P>0.05);而p-Akt在H、HD、HG组中的表达强度,明显高于C、HS、G、HGS组(P<0.05)。Erk1/2在细胞内的定位在细胞质,其经磷酸化后,生成p-Erk1/2进入细胞核,各组Erk1/2表达强度差异无统计学意义(P>0.05);而p-Erk1/2表达强度在H、D、HG组明显高于C、HS、G、HGS组(P<0.05),见图3、表2。
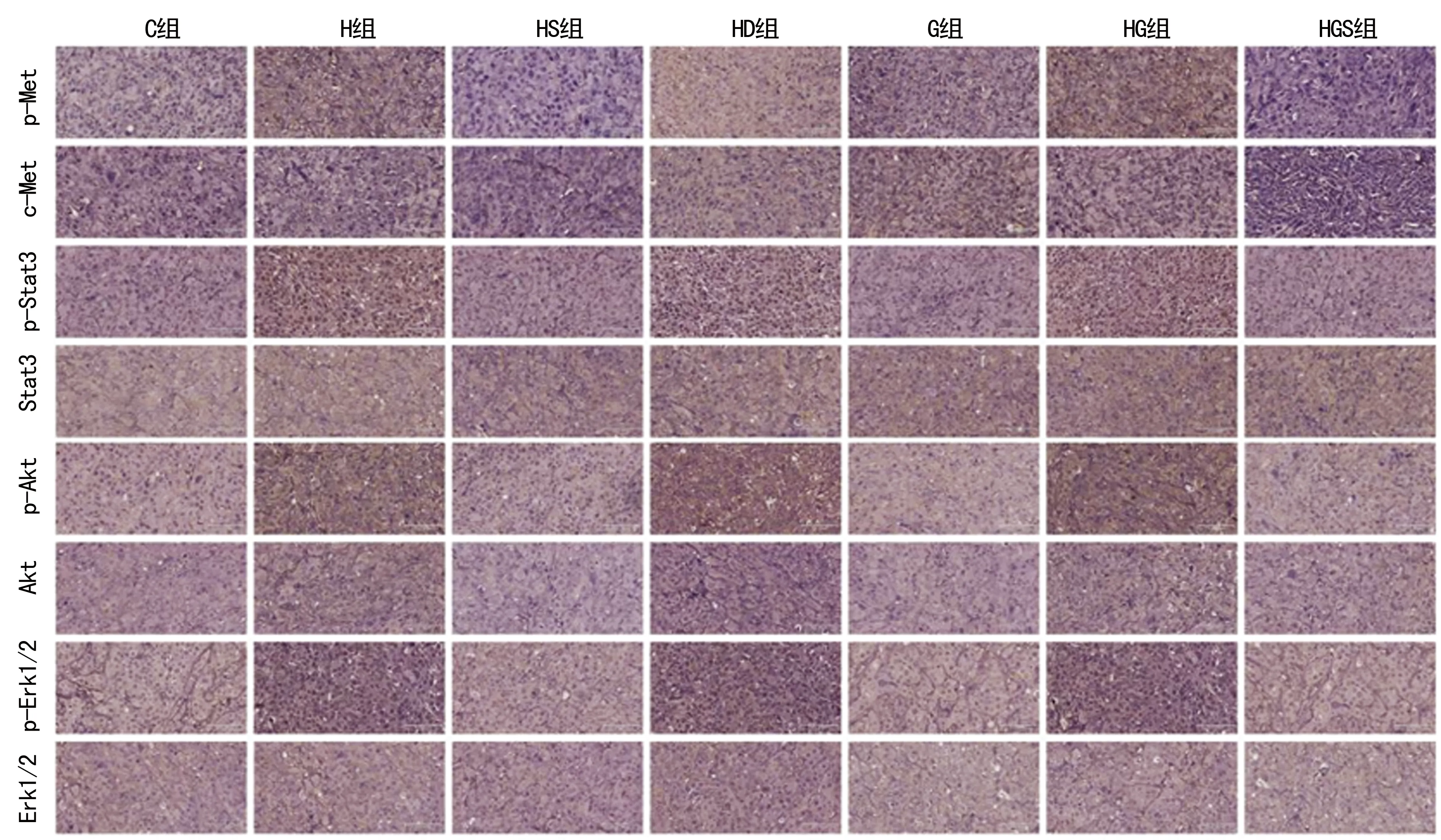
图3 各组PC-9细胞移植瘤组织中c-Met及其下游通道蛋白的表达(IHC,×200)

组别p-Metc-Metp-Stat3Stat3p-AktAktp-Erk1/2Erk1/2C组0.167±0.032a0.139±0.022a0.100±0.0420.132±0.0320.157±0.0110.101±0.0240.121±0.0110.113±0.015H组0.225±0.012ab0.150±0.024a0.233±0.025ab0.140±0.0100.225±0.004ab0.102±0.0280.216±0.034ab0.122±0.017HS组0.028±0.0160.053±0.0340.114±0.0510.125±0.0110.146±0.0060.100±0.0440.123±0.0080.130±0.023HD组0.172±0.007ab0.154±0.005a0.244±0.029ab0.122±0.0100.244±0.006ab0.102±0.0370.221±0.038ab0.137±0.024G组0.154±0.018a0.153±0.017a0.096±0.0190.141±0.0300.151±0.0040.098±0.0120.101±0.0080.115±0.005HG组0.218±0.017ab0.147±0.042a0.252±0.022ab0.140±0.0170.228±0.017ab0.110±0.0290.210±0.041ab0.116±0.012HGS组0.026±0.0090.031±0.0160.091±0.0220.129±0.0130.153±0.0090.109±0.0410.108±0.0080.121±0.005
a:P<0.05,与HS、HGS组比较;b:P<0.05,与C、G组比较
3 讨 论
在NSCLC的治疗中,表皮生长因子受体酪氨酸酶抑制剂(EGFR-TKIs)有着不可替代的重要地位。高水平的HGF通过促进具有c-Met扩增的细胞亚群生长、活化c-Met及下游信号通路及影响T790M突变等方式使EGFR-TKIs产生获得性耐药[14-15]。因此针对HGF/c-Met继发突变的靶向治疗,可能逆转EGFR-TKIs的耐药。
本实验中,当用SU11274处理由HGF诱导的PC-9细胞时,被激活的c-Met和其下游的通道蛋白的磷酸化开始受到抑制。而MTT法测定细胞存活率显示,HGF诱导PC-9细胞后存活率增加,而在用SU11274处理72 h之后恢复到原来水平。检测细胞凋亡的结果示HGS组与HG组间存在明显差异,这表明,在c-Met抑制剂SU11274的作用下,吉非替尼对HGF诱导的PC-9细胞的凋亡率都出现显著提高。免疫印迹结果显示HGF可明显刺激c-Met磷酸化及磷酸化的Akt、Stat3、Erk1/2等下游通道蛋白的表达。PC-9细胞中,HGF在吉非替尼作用下仍可刺激c-Met、Akt、Stat3、Erk1/2的磷酸化,SU11274可抑制其表达。综上表明,c-Met的抑制剂SU11274能够逆转由HGF诱导的PC-9肺癌细胞株对吉非替尼的耐药,其机制可能与抑制HGF活化的c-Met及其下游通道蛋白表达有关。
进一步体内实验中,将PC-9细胞与MRC-5细胞混合种植于裸鼠右侧肋下皮下,部分组再分别以吉非替尼、SU11274处理,检测肿瘤的体积及质量,吉非替尼能够抑制PC-9细胞G、HG、HGS组移植瘤的生长,但是对G、HGS组的抑制作用更加明显。表明吉非替尼能够抑制PC-9细胞移植瘤的生长(P<0.01),HGF可抑制其作用,SU11274又可逆转HGF的抑制作用(P<0.01)。IHC检测结果显示PC-9细胞中HS、HGS组p-Met及c-Met表达明显低于其余各组,而H、HD、HG组中p-Met、p-Stat3、p-Akt、p-Erk1/2表达高于C、HS、G、HGS组。Akt、Stat3、Erk1/2在各组间表达水平比较,差异无统计学意义(P>0.05)。表明c-Met的抑制剂SU11274能够逆转由HGF诱导的PC-9肺癌细胞株对EGFR-TKIs的耐药,其机制可能与抑制HGF活化的c-Met及其下游通道蛋白表达有关。
EGFR-TKIs在NSCLC的治疗中意义重大,因其耐药的出现限制了其疗效及应用,改善这种限制,提高患者的疗效是目前最有意义的工作之一。本实验通过体内、外实验研究发现经c-Met的抑制剂SU11274处理后,抑制了c-Met及其下游的通道蛋白c-Met、Stat3、Akt、Erk1/2的磷酸化,从而逆转了HGF诱导的敏感NSCLC细胞株对吉非替尼的耐药。表明针对HGF/c-Met靶点的治疗为NSCLC患者能够获得更有效的个体化靶向治疗提供了很大的可能性,有望为肺癌患者提供新的生机。

