冲泡条件对湘西黄金茶生物活性成分及其抗氧化活性的影响
陈 亮 余 佶 游湘淘 金旋鹭 丁家云 麻成金 姚茂君
(1. 吉首大学林产化工工程湖南省重点实验室,湖南 张家界 427000;2. 吉首大学茶叶科学研究所,湖南 吉首 416000)
绿茶具有缓解动脉粥样硬化、预防癌症、抗炎抑菌、抗衰老等[1-4]功效,其抗氧化能力是体现其功效的重要指标[5]。目前,普遍认为的功效因子有茶多酚、氨基酸、黄酮等生物活性成分,可有效清除自由基,抑制活性氧的形成[6],从而对涉及氧化应激的病理起作用。在绿茶冲泡过程中,抗氧化物质通过冲泡浸出而进入茶汤,从而起抗氧化作用,而抗氧化物质因组成、含量的不同,表现出的抗氧化性能也不同。Draženka等[7]发现绿茶中总酚类物质的浸出量与冲泡温度呈正相关,且茶汤的抗氧化能力与总酚类物质的浸出量直接相关。Pérez-Burillo等[8]发现白茶多酚类物质的浸出量随冲泡时间和水温的增加而增加,茶汤清除自由基的能力呈线性增长,且在水温98 ℃,冲泡时间7 min时,茶汤的感官品质及清除自由基的能力较好。以上研究主要集中在不同冲泡条件对茶汤中滋味成分浸出量、感官品质及抗氧化性能的影响,尚未见对绿茶(如黄金茶)中生物活性成分浸出规律及抗氧化性能的研究报道。
湘西黄金茶起源于湘西自治州保靖县葫芦镇黄金村,是湖南省优良的地方群体品种,也是湘西古老、特异、珍稀的地方茶树品种资源[9]。湘西黄金茶以其高氨基酸含量(高达7.47%)[10]的特点,受国内外广大茶叶爱好者的青睐。试验拟以湘西黄金茶为研究对象,考察不同冲泡温度、时间下茶多酚、游离氨基酸的浸出量,并建立浸出动力学模型;采用ABTS法、DPPH法测定茶汤体外抗氧化性能,并探讨不同冲泡温度、时间对其抗氧化性能的影响。旨在深入了解湘西黄金茶的营养价值,为湘西黄金茶深加工产品的开发提供指导。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
湘西黄金茶:湘西自治州保靖县葫芦镇黄金村提供;
茶多酚标准品:江苏永健医药科技有限公司;
L-谷氨酸标准品:合肥博美生物科技有限责任公司;
1,1-二苯基-2-三硝基(DPPH)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS):阿拉丁试剂有限公司;
碳酸钠、Folin-酚试剂、没食子酸、无水乙醇、茚三酮等:分析纯。
1.1.2 仪器与设备
紫外可见—分光光度计:UV-2450型,日本岛津公司;
集热式恒温加热磁力搅拌器:DF-101T型,上海力辰邦西仪器科技有限公司;
电子天平:FA224型,上海舜宇恒平科学仪器有限公司;
数字恒温水浴锅:HH-2型,常州智博瑞仪器有限公司。
1.2 方法
1.2.1 茶汤的制备 准确称取黄金茶8 g,迅速加入到1 600 mL 蒸馏水中,水温分别为60,70,80,90 ℃,以一定转速搅拌并保持恒温。分别在1,2,3,4,5,10,15,20,25,30,40,50,60 min 时用无菌注射器吸取一定量的茶汤,经0.45 μm有机微孔滤膜过滤,迅速放入4 ℃保存。
1.2.2 茶多酚含量的测定 采用何健等[11]方法并稍作修改。以没食子酸为标准品,分别配置10,20,30,40,50 μg/mL 没食子酸标准溶液,绘制标准曲线(y=3.761x+0.006 5,R2=0.997 5)。取1 mL茶汤样品加入5.0 mL体积分数 10% Folin-酚试剂,摇匀,反应10 min,加入4.0 mL质量分数7.5%碳酸钠溶液,用蒸馏水定容至刻度,摇匀,于30 ℃水浴恒温1 h,避光冷却10 min,测定765 nm处吸光值,以没食子酸当量GAE表示(mg GAE/mL)。
1.2.3 游离氨基酸含量的测定 采用Yin等[12]方法并稍作修改。以谷氨酸为标准品,分别配置40,60,80,100,120 μg/mL的谷氨酸标准溶液,绘制标准曲线(y=2.394 2x-0.097 9,R2=0.997 1)。吸取茶汤样品1 mL,分别加入磷酸盐缓冲液(0.05 mol/L,pH 8.0),质量分数 2%茚三酮溶液0.5 mL,沸水浴15 min,冷却至室温,蒸馏水定容至25 mL,避光反应10 min,测定570 nm处吸光值,以谷氨酸当量GLU表示(mg GLU/mL)。
1.2.4 黄金茶中生物活性成分浸出动力学模型 茶汤中茶多酚、游离氨基酸等生物活性成分在冲泡过程中为典型的固-液相扩散传质过程,满足二阶动力学方程[13],如式(1)所示。
(1)
式中:
k——二阶浸出速率常数,mL/(mg·min);
CT——t时刻茶汤中生物活性成分的浓度,mg/mL;
C∞——茶汤中生物活性成分的饱和浓度,mg/mL。
将式(1)线性变换并积分,代入边界条件t=0~t,Ct=0~C,得:
(2)
将式(2)线性变换得:
(3)
由式(3)可知,二阶浸出速率常数k由t/C、Ct、C∞决定,以t/C—t作回归直线图,由该直线的斜率与截距可求得饱和浓度C∞和二阶速率常数k。
根据Arrhenius方程可知,浸出速率常数k与温度T间的关系如式(4)所示。
(4)
式中:
A——前因子, mL/(mg·min);
R——摩尔气体常量,8.314 5 J/(mol·K);
T——热力学温度,K;
Ea——活化能,J/mol。
根据Arrhenius方程,以lnk—1/T作图可得Ea与A。
1.2.5 DPPH清除率的测定 参考郭虹雯等[14]方法并稍作修改。取0.1 mL茶汤样品与无水乙醇稀释后的DPPH 溶液3.9 mL混合均匀,室温静置30 min,测定517 nm 处吸光值。绘制没食子酸工作液标准曲线(y=1 070.8x+16.304,R2=0.992 2),样品的DPPH清除率用没食子酸当量GAE表示(mg GAE/mL)。
1.3 数据分析
各试验处理均设3次重复。采用Excel 2016、SPSS 20.0对数据进行统计学分析,并用One-way ANOVA进行多重比较分析,利用Origin 8.0软件作图。
2 结果与分析
2.1 冲泡条件对茶汤中茶多酚含量的影响
由图1可知,同一冲泡时间下,茶多酚浓度随冲泡温度的升高逐渐增加,浸出速率也逐渐增大,0~1 min,60~90 ℃水温下,茶多酚的浸出速率分别为0.029 3,0.035 2,0.059 2,0.084 7 mg GAE/(mL·min);同一冲泡温度下,黄金茶茶汤中茶多酚浓度与冲泡时间呈正相关,浸出速率与冲泡时间呈负相关。当水温为90 ℃时,冲泡30 min后茶多酚浓度趋于稳定,30~60 min内茶多酚浓度无明显变化,约为0.330 1 mg GAE/mL。一般来说,冲泡水温的升高、时间的延长,有利于茶多酚的浸出,但随着水温不断升高、冲泡时间不断延长,茶叶细胞破裂物质浸出的同时,茶多酚的氧化聚合反应也很剧烈,使茶多酚的浸出速率呈先增加后减小趋势[16]。
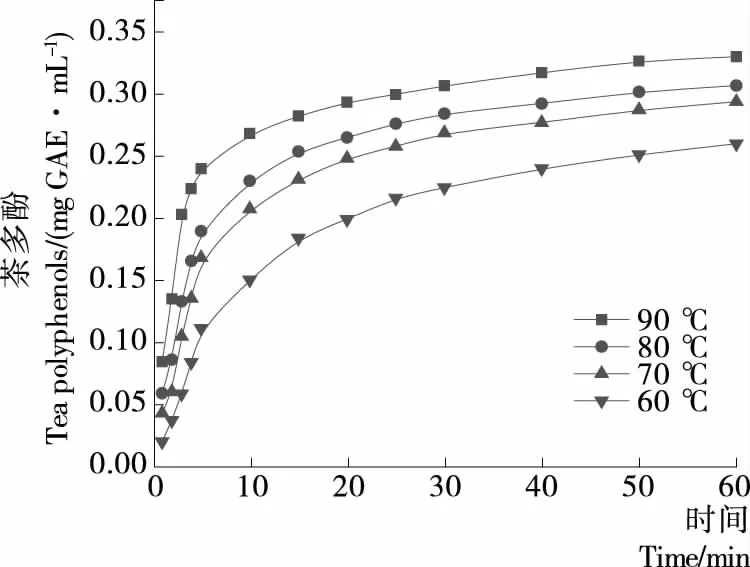
图1 冲泡温度与时间对茶汤中茶多酚的影响
Figure 1 Effect of the brewing temperature and time on tea polyphenols from Xiangxi golden tea
方差分析结果(表1)显示,冲泡时间与水温对茶多酚浸出量的影响均极显著(P<0.01),依次为冲泡温度>冲泡时间。
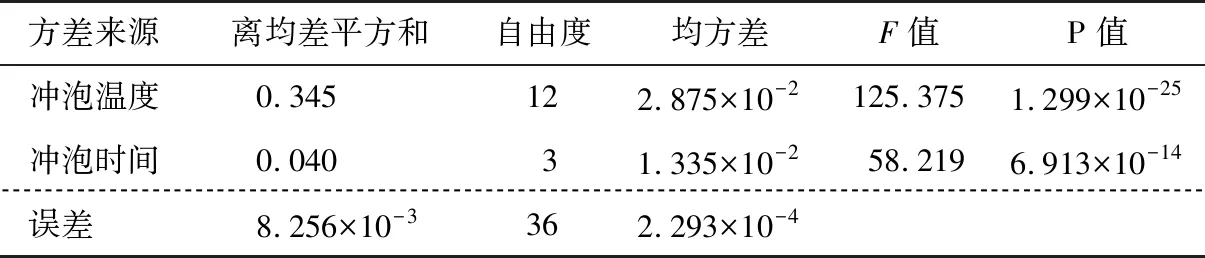
表1 茶多酚浸出量方差分析Table 1 Variance analysis of theamount of tea polyphenols
2.2 冲泡条件对茶汤中氨基酸含量的影响
由图2可知,游离氨基酸的浸出趋势与茶多酚类似。同一冲泡温度下,一定时间内,茶汤中游离氨基酸浓度随冲泡时间的延长而逐渐增加,浸出速率逐渐减小,冲泡水温为90 ℃时,0~1 min游离氨基酸浸出速率达0.092 1 mg GLU/(mL·min),4~5 min游离氨基酸浸出速率为0.021 8 mg GLU/(mL·min),25~30 min游离氨基酸浸出速率为0.001 4 mg GLU/(mL·min),30 min 后游离氨基酸浓度趋于稳定,30~60 min游离氨基酸浸出速率仅为0.000 7 mg GLU/(mL·min)。同一冲泡时间下,游离氨基酸浓度随冲泡温度的升高而增大,且温度越高,氨基酸浸出速率越大。60~90 ℃水温冲泡,0~1 min游离氨基酸浸出速率分别为0.092 1,0.060 5,0.048 9,0.041 8 mg GLU/(mL·min)。根据相似相溶原理,游离氨基酸易溶于水,随冲泡温度的升高,分子运动越活跃,越有利于游离氨基酸与水形成氢键,促使游离氨基酸浸出。
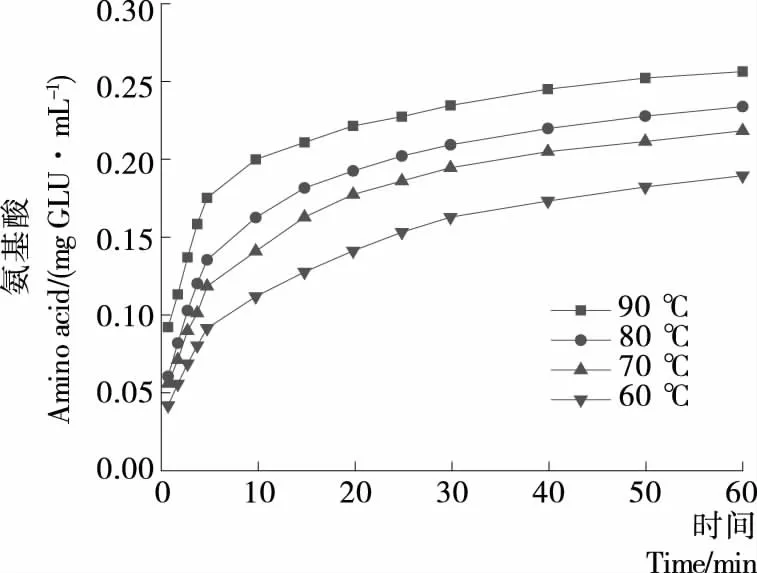
图2 冲泡温度与时间对茶汤中氨基酸的影响Figure 2 Effect of the brewing temperature and time on amino acid from Xiangxi golden tea
方差分析结果(表2)显示,冲泡温度与时间对茶汤中游离氨基酸浸出量的影响均极显著(P<0.01),依次为冲泡时间>冲泡温度。
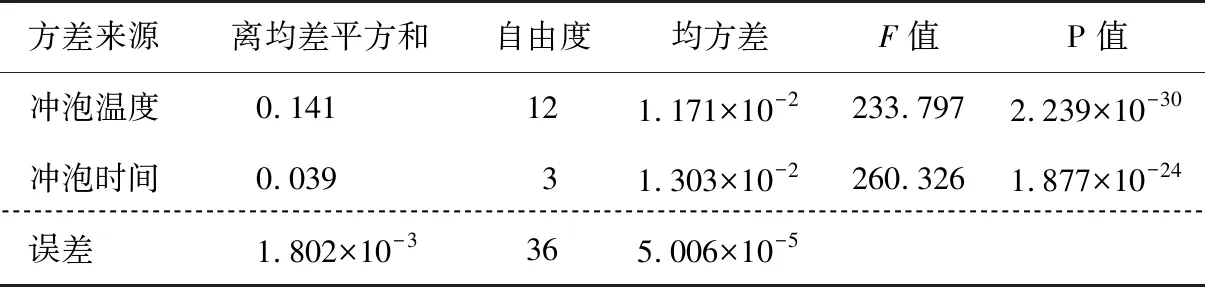
表2 游离氨基酸浸出量方差分析Table 2 Variance analysis of the amount of free amino acid
2.3 茶汤中抗氧化物质浸出动力学模型
由图3可知,不同冲泡温度下,冲泡时间与茶多酚、游离氨基酸浓度的比值(t/Ct)随冲泡时间(t)的增大基本呈直线上升趋势。各拟合曲线的相关系数均>0.99,线性关系良好,说明黄金茶茶汤中茶多酚、游离氨基酸的浸出满足二阶动力学方程,具体动力学参数见表3。
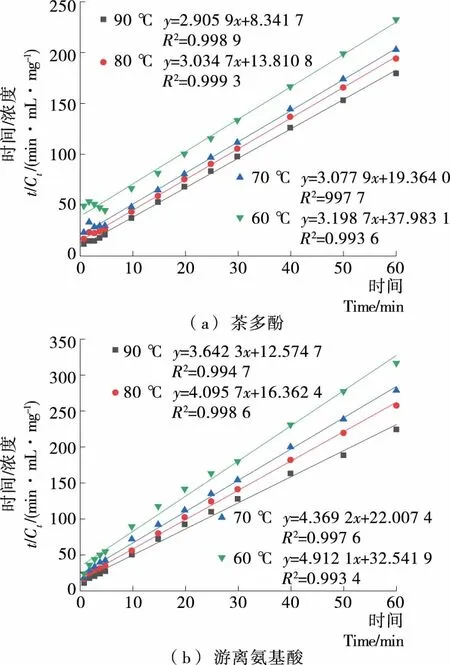
图3 不同冲泡温度下茶汤生物活性成分浓度与冲泡时间的线性关系
Figure 3 Linearized plots of tea bioactive compounds concentrations on different brewing temperatures to time
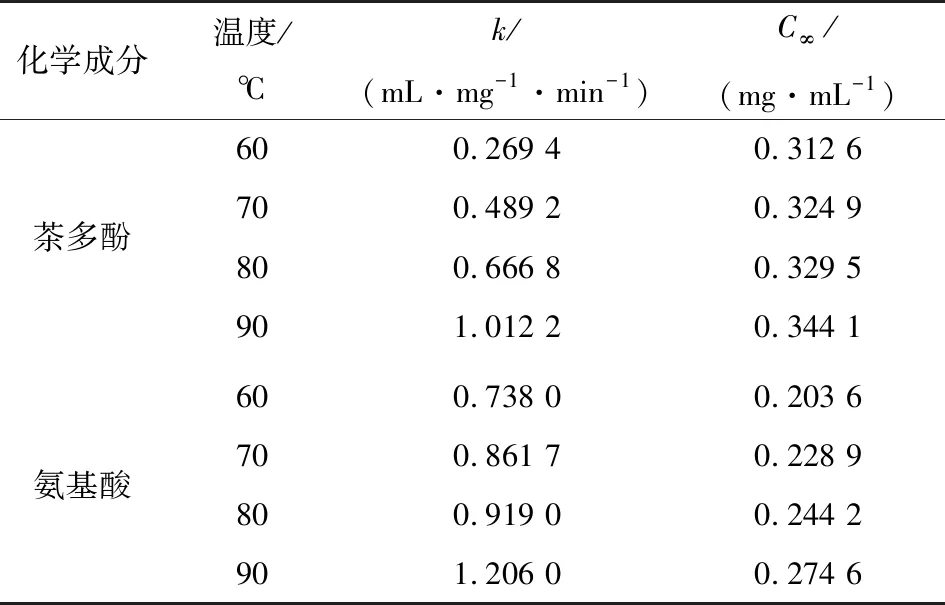
表3 茶汤中生物活性成分浸出动力学参数Table 3 Kinetic parameters for the extraction of chemical constituents from tea infusion
由表3可知,茶汤中茶多酚、游离氨基酸的饱和浓度(C∞)、二阶释放速率常数(k值)随冲泡温度的升高而增大。升高温度,生物活性成分溶解度增加,从而导致物质浸出率增大[17]。
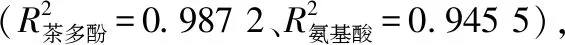
2.4 冲泡条件对茶汤抗氧化性能的影响
由图5可知,茶汤中DPPH、ABTS清除率在0~10 min 内随冲泡时间的延长与水温的增加而不断增加,冲泡10 min时,茶汤中DPPH、ABTS清除率随冲泡时间的延长缓慢增加并逐渐趋于稳定,此时不同冲泡温度(60,70,80,90 ℃)茶汤的DPPH清除率分别为0.037 9,0.054 8,0.061 2,0.067 1 mg GAE/mL,ABTS清除率分别为0.103 3,0.123 2,0.142 2,0.151 4 mg GAE/mL。
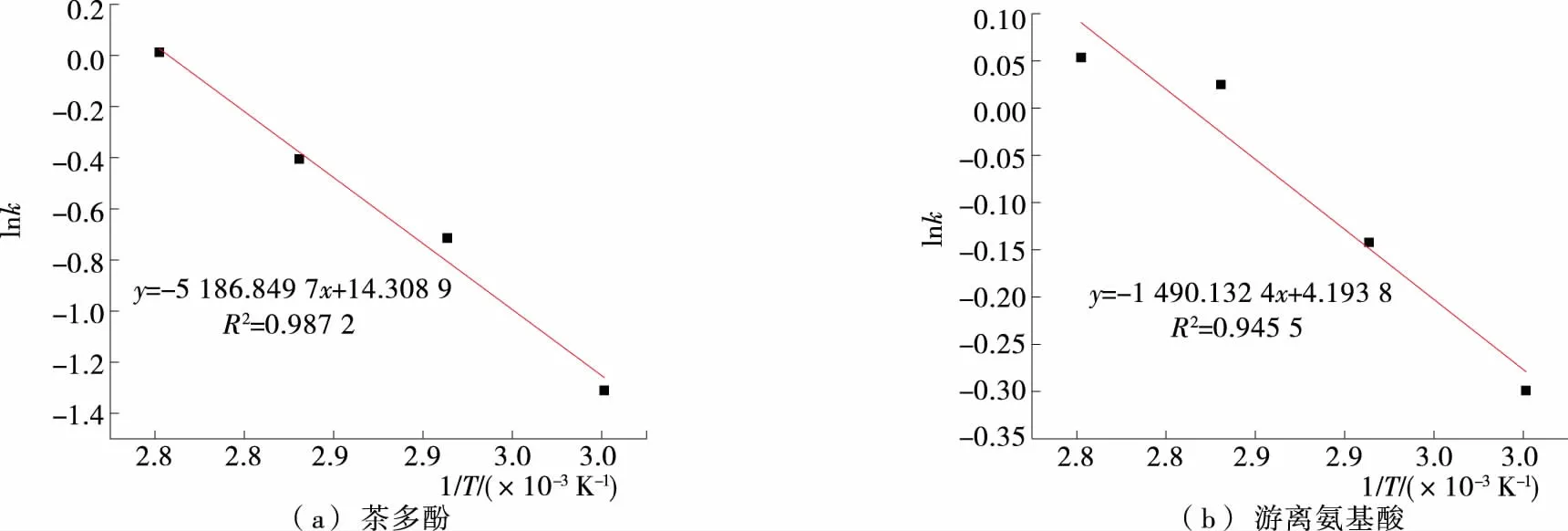
图4 温度与浸出速率常数的关系Figure 4 Relationship between temperature and the dissolution rate constant

图5 冲泡温度与时间对黄金茶茶汤抗氧化性能的影响Figure 5 Effects of brewing temperature and time on antioxidant properties of tea infusion
冲泡温度的升高、时间的延长,使茶多酚浓度逐渐增加,浸出速率也逐渐增大,从而导致茶汤的抗氧化活性逐渐增大[19]。但水温过高、冲泡时间过长,会出现多酚氧化现象,致使茶多酚浸出速率下降,对DPPH、ABTS清除速率下降。此外,茶汤的抗氧化能力还受VC、黄酮类化合物、游离氨基酸、茶多糖等生物活性成分的影响[20]。
3 结论
试验探究了冲泡条件对湘西黄金茶茶多酚、游离氨基酸浸出规律及对其抗氧化性能的影响。结果表明,黄金茶茶汤中茶多酚、游离氨基酸浓度与冲泡时间及水温均显著相关(P<0.01),茶汤DPPH、ABTS清除率随冲泡温度的增加而增加,30 min后趋于稳定。冲泡黄金茶茶汤中茶多酚、游离氨基酸的浸出满足二阶动力学方程,且温度与浸出速率常数k有良好的线性关系,游离氨基酸在茶汤中的浸出速率大于茶多酚。后续需进一步探讨不同冲泡条件对生物活性成分的浸出规律与黄金茶感官品质、抗氧化能力之间的关系,阐明茶叶中生物活性成分的浸出规律,为黄金茶深加工产品开发、消费者科学饮茶提供理论参考。

