酱油渣中乳酸乳球菌分离鉴定及对模拟胃肠环境的耐受性
黄桂东 唐素婷 程云辉 孙张乐 陈梓琦 焦 叶 张 灿 钟先锋
(1. 佛山科学技术学院食品科学与工程学院,广东 佛山 528231;2. 广东省传统发酵食品工程技术研究中心,广东 佛山 528231;3. 广东省食品流通安全控制工程技术研究中心,广东 佛山 528231;4. 佛山市酿造工程技术研究中心,广东 佛山 528231;5. 佛山农业生物制造工程技术研究中心,广东 佛山 528231;6. 长沙理工大学化学与食品工程学院,湖南 长沙 410114;7. 开平市佰益饲料科技发展有限公司,广东 江门 529300)
酱油酿造是多种微生物协同作用的结果,每种微生物对酱油酿造过程的成分变化乃至酱油品质优劣均有一定影响[1-3]。酱油酿造过程涉及的微生物有曲霉、乳酸菌、酵母菌等[4],其中,乳酸菌是参与酱油酿造最重要的细菌,主要包括乳杆菌属[5]、乳酸乳球菌属[6]、魏斯氏菌属[6]、片球菌属[4,6]等。酱油渣是酱油酿造后产生的残渣,携带一定种类和数量的微生物,如乳酸乳球菌等[5-6]。目前大多数报道集中于对酱油酿造过程中乳酸菌的研究,查阅中国知网数据库和Pubmed数据库,尚未见有关酱油渣中乳酸乳球菌的报道,对酱油渣中乳酸菌的认识不足。
近年来,乳酸乳球菌因其良好的益生特性被广泛应用于食品行业。部分乳酸乳球菌及其亚种能产生乳链菌肽[7-8],是无毒的食品防腐剂,可用于食品防腐及保鲜[9];乳酸乳球菌还可产胞外多糖,用于干酪[10]和豆腐[11]制作,其代谢产物能够改善产品的流变学特性等。
为了深入挖掘乳酸菌资源并延伸酱油渣的可利用价值,试验拟采用传统菌株筛选方法,从酱油渣中分离、筛选、鉴定乳酸乳球菌,并对其部分益生特性进行研究,以期为食源性乳酸菌资源库扩充提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
酱油渣:原料主要是大豆与小麦粉,采用高盐稀态工艺酿造,广东某调味食品有限公司;
过氧化氢生化鉴定管、革兰氏染色试剂盒、硫化氢生化鉴定管、吲哚生化鉴定管、硝酸盐(还原)生化鉴定管、明胶生化鉴定管、MRS肉汤等:广东环凯微生物科技有限公司。
1.1.2 仪器与设备
防冻霜冰箱:BCD-189WDPV型,海尔股份有限公司;
显微镜:PH100型,凤凰光学集团有限公司;
恒温培养箱:LRH-150型,上海一恒科学仪器有限公司;
全自动灭菌锅:GR60DA型,致微(厦门)仪器有限公司;
电子分析天平:ME104型,梅特勒—托利多精密仪器公司;
超净工作台:SW-CJ-1FD型,苏州安泰空气技术有限公司。
1.2 方法
1.2.1 酱油渣中乳酸菌的分离与纯化 根据文献[12-14]修改如下:称取酱油渣样品10 g溶解于90 g无菌生理盐水中,制成10-1,10-2,……,10-6共6个浓度稀释液。吸取稀释液0.1 mL,涂布于含3 g/100 mL碳酸钙的MRS固体培养基中,37 ℃倒置培养24~36 h。挑取菌落划线2~3次至菌落一致。挑取单菌落37 ℃培养12 h,与甘油混合,-20 ℃保藏。
1.2.2 酱油渣中乳酸菌的鉴定
(1) 形态学观察:根据文献[15]修改如下,菌株划线培养于MRS固体培养基,37 ℃培养48 h,观察菌株的菌落形态。进行革兰氏染色试验,使用油镜,观察菌株的菌体形态。革兰氏阳性菌株进行过氧化氢酶接触试验,有气泡产生为阳性反应,无气泡产生为阴性。
(2) 生理生化试验:参照《乳酸细菌分类鉴定及实验方法》[16],具体试验操作参考生化鉴定管说明书。
(3) 分子生物学鉴定:将革兰氏呈阳性、过氧化氢酶接触试验呈阴性菌株送往华大基因进行菌株的16S rRNA 序列测序。
(4) 系统发育树的构建:根据文献[17-18]修改如下,登陆GenBank中BLAST程序(http://blast.ncbi.nlm.nih.gov)比对测序菌株,并查询模式菌株信息,利用Mega 5.0软件,使用邻近算法,BacillussubtilisNCDO1769为外群菌株,bootstrap为1 000构建系统发育树。
1.2.3 乳酸乳球菌生长曲线测定 根据文献[19]修改如下:菌株活化3代,调节OD600 nm为(1.00±0.05),按照2%(体积分数)的接种量接种于MRS肉汤培养基,37 ℃恒温培养,以未接种的MRS液体培养基为阴性对照,分别培养0,2,4,6,8,10,12,16,20,24,28,32,36,40 h,使用酶标仪测定菌株的OD600 nm,记录数据并绘制生长曲线。
1.2.4 乳酸乳球菌模拟胃液耐受性测定 根据文献[12,20]修改如下,菌株活化3代,吸取4 mL菌液,5 000 r/min 离心8 min,去上清液,将菌体悬浮于4 mL灭菌生理盐水制成菌悬浮液。无菌离心管中加入4.5 mL人工胃液、0.5 mL菌悬浮液,混合均匀。37 ℃培养,分别在0(稀释度为10-4,10-5,10-6),3 h(稀释度为10-3,10-4,10-5)取样0.1 mL,使用平板计数法计算菌株存活率。设置3个平行,按式(1)计算菌株存活率。
(1)
式中:
S1——菌株存活率,%;
A0——耐受人工胃液0 h的活菌数,CFU/mL;
A1——耐受人工胃液3 h的活菌数,CFU/mL。
1.2.5 乳酸乳球菌模拟肠液耐受性测定 根据文献[12,20]修改如下,取人工胃液消化3 h的菌株培养液0.5 mL,接种于4.5 mL人工肠液中,37 ℃培养0(稀释度10-3,10-4,10-5),4 (稀释度10-2,10-3,10-4),8 h(稀释度10-2,10-3,10-4),使用平板计数法计算菌株存活率。设置3个平行,按式(2)计算菌株存活率。
(2)
式中:
S2——菌株存活率,%;
A0——人工肠液耐受0 h的活菌数,CFU/mL;
As——人工肠液耐受4 h或8 h的活菌数,CFU/mL。
1.3 数据处理
数据统计与处理采用Excel 2013以及SPSS 17.0,绘图采用Origin 9。
2 结果与分析
2.1 乳酸乳球菌形态学观察
从酱油渣中分离得到4株乳酸乳球菌,分别为菌株HT122、HT127、HT223、HT227,菌落颜色为灰白色,菌落表面光滑,边缘齐整,直径为0.3~1.0 mm。经染色试验发现4株乳酸菌均为革兰氏阳性菌,菌体均为球状,呈单个、成对或短链分布。酱油渣中部分乳酸乳球菌的菌体形态如图1所示。

图1 部分乳酸乳球菌菌株的菌体形态
Figure 1 Microscopic morphology of partialLactococcuslactisfrom soy sauce residue (×1 000)
2.2 乳酸乳球菌生理生化试验特征
由表1可知,菌株HT122、HT127、HT223和HT227的革兰氏染色试验菌体均呈紫色,过氧化氢酶接触试验、硝酸盐还原反应、葡萄糖产气试验、6.5% NaCl生长试验及45 ℃生长试验均呈阴性。参考雷霞[21]、华鹤良[22]的方法,结合形态学研究结果,初步判断以上4株菌为乳酸乳球菌属(Lactococcus)。

表1 乳酸乳球菌生理生化鉴定结果†Table 1 Results of the biochemical identification of Lactococcus lactis from soy sauce residue
† “+”表示反应呈阳性;“-”表示反应呈阴性、不生长或生长不明显。
2.3 乳酸乳球菌分子生物学鉴定
对4株乳酸乳球菌进行基因组提取、16S rRNA基因PCR扩增、测序,所得凝胶电泳图如图2所示。由图2可知,4株乳酸乳球菌PCR产物大小均在1 500 bp左右,且条带清晰无弥散。
得到菌株的16S rRNA基因序列,进行Blast比对,结果如表2所示。利用Mega 5.0软件构建系统发育树,如图3所示。由图3可知,菌株HT122、HT127、HT223、HT227均与模式菌株Lactococcuslactissubsp.lactisJCM 5805T、Lactococcuslactissubsp.hordniaeNBRC 100931T处于同一分支。结合表2,将菌株HT127、HT223、HT227鉴定为Lactococcuslactissubsp.hordniae(乳酸乳球菌霍氏亚种);将菌株HT122鉴定为Lactococcuslactissubsp.lactis(乳酸乳球菌乳亚种)。Ansah[6]研究也发现酱油发酵过程中存在乳酸乳球菌。

电泳条件:3 μL样品+1%琼脂糖凝胶,使用Trans 2K@Plus RNA Marker
图2 乳酸乳球菌16S rRNA PCR扩增产物电泳图
Figure 2 Electrophoresis of 16S rRNA amplified products ofLactococcuslactisfrom soy sauce residue

表2 酱油渣中分离菌株的16S rRNA 序列同源性比对结果Table 2 Results of 16S rRNA sequence homology analysis of Lactococcus lactis from soy sauce residue

0.02表示2%替换率
2.4 乳酸乳球菌生长曲线
由图4可知,从酱油渣中分离得到的4株乳酸乳球菌的生长趋势总体相似。0~2 h为延迟期,2~12 h 为对数生长期,接种12 h后,菌株生长速率减缓,进入生长稳定期。
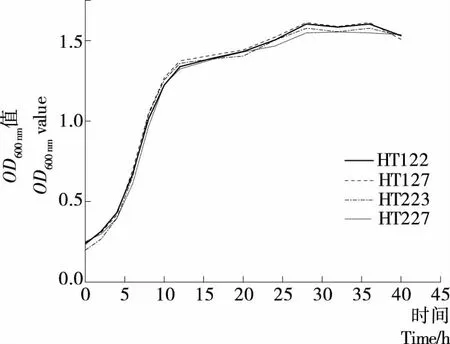
图4 乳酸乳球菌菌株生长曲线Figure 4 Growth curves of Lactococcus lactis from soy sauce residue
2.5 乳酸乳球菌模拟胃液耐受能力
胃液主要由黏液、盐酸、胃蛋白酶组成,在胃液作用下,微生物的活菌数会逐渐减少。由于微生物需要超过一定数量才能对机体发挥益生特性,因此需要考察乳酸乳球菌的胃液耐受能力[23]。由图5可知,菌株HT223的模拟胃液耐受能力较好,耐受胃液3 h后,菌株存活率为(94.85±0.05)%;菌株HT127、HT227、HT122耐受胃液3 h后,菌株存活率分别为(81.67±0.25)%,(77.99±0.58)%,(58.57±0.57)%。迪娜热尔·迪力达西等[24]对从新疆传统发酵乳品中分离出的乳酸乳球菌进行胃液耐受能力试验,发现其3 h存活率达94.27%。说明不同菌株对人工胃液耐受能力有差异。

图5 乳酸乳球菌在模拟人工胃液中的存活率
Figure 5 Test results of live bacteria counts ofLactococcuslactisin simulated artificial gastric juice
2.6 乳酸乳球菌模拟肠液耐受能力
肠液主要成分为胰液和胆汁。胰液中的胰蛋白酶可水解微生物的菌体蛋白质,抑制乃至杀死微生物。胆汁中含有一定量胆盐,胆盐在人体肠道的浓度为0.03%~0.30%,能改变微生物细胞膜的通透性,抑制、杀死进入肠道的微生物[25]。微生物到达小肠后,因胰蛋白酶、胆盐的抑制作用及营养的缺乏等因素逐渐死亡[12]。因此,需评估乳酸菌对肠液的耐受能力。由图6可知,菌株HT127耐受肠液能力较好,耐受肠液4,8 h后的菌株存活率分别为(93.61±0.67)%,(67.42±0.72)%;菌株HT227耐受肠液能力较差,耐受模拟肠液4,8 h的菌株存活率分别为(26.83±0.13)%,(22.28±0.18)%。结合4株乳酸乳球菌模拟胃液耐受能力的结果,发现菌株HT127耐受模拟胃液、肠液能力较好。

图6 乳酸乳球菌在模拟人工肠液中的存活率
3 结论
从酱油渣中分离得到了4株乳酸乳球菌,经鉴定,分别属于Lactococcuslactissubsp.hordniae(乳酸乳球菌霍氏亚种)和Lactococcuslactissubsp.lactis(乳酸乳球菌乳亚种)。对其体外模拟胃肠环境耐受能力研究发现,菌株HT127耐受模拟胃肠环境能力较好。后续可对其生长特性、益生特性等进行深入研究与探讨,为乳酸乳球菌资源库的丰富提供科学依据。

