辣椒酵素益生菌复合发酵制剂的筛选
孙树平 刘志伟 李 京 何丽丽
(1. 武汉轻工大学食品科学与工程学院,湖北 武汉 430023;2. 湖北省农产品加工与转化重点实验室,湖北 武汉 430023;3. 武汉轻工大学大宗粮油精深加工教育部重点实验室,湖北 武汉 430023;4. 武汉华康臣生物科技有限公司,湖北 武汉 430023)
辣椒又名海椒、番椒、秦椒等,属一年生草本植物[1],是β-胡萝卜素、辣椒素、玉米黄质、叶黄素和VC等营养物质的重要来源[2]。此外,它还富含酚类和黄酮类化合物[3]。新鲜红辣椒含有高水平的抗坏血酸,其含量居各类蔬菜含量之首[4],100 g红辣椒VC的供应量相当于目前推荐日摄入量(RDA)的100%(60 mg/100 g)[5]。红辣椒中总类胡萝卜素含量(30.37 mg/100 g鲜重)是胡萝卜和西红柿的4倍左右[6]。红辣椒除了作为蔬菜和香料被世界上大部分的人口食用外,还是用于治疗各种人类疾病的传统草药的重要组成部分。因此,为了能够进一步开发红辣椒的功能性成分,需要对其加工手段进行研究[7]。
酵素(Fermented plant extract,FPE)是以一种或多种植物为原料[8],经多种益生菌发酵而产生的一种功能性食品。FPE含有脂肪酶、超氧化物歧化酶、香气成分、乳酸、醋酸及少量乙醇等多种活性物质[9-11],具有清理肠道[12]、抗炎症、解毒[13]、抗菌[14]、止血[15]等保健功效。Mi等[16]研究发现在红辣椒中接种类布式乳杆菌能够显著提高发酵产物中醇、酯、烃类、内酯、吡嗪和萜类等物质的含量,使所得的产品具有很好的感官评价;邵伟等[17]的研究表明酵母菌和醋酸菌的加入能够显著提高辣椒酱的醇香和绵酸味;王微[18]60-65研究发现乳酸菌的加入使辣椒产品产生新的生物活性物质。
从以上研究来看,目前用于辣椒发酵的多为乳酸菌,酵母菌和醋酸菌。但是未见用植物乳杆菌和酿酒酵母;植物乳杆菌和醋酸菌;植物乳杆菌、酿酒酵母和醋酸菌等混菌发酵剂来发酵辣椒的。在发酵过程中,适量酵母菌的存在可产生醇类物质,该类物质与乳酸菌、醋酸菌的发酵产物有机酸结合可促进多种风味物质的形成。因此研究拟以恩施富硒辣椒为原料,以前期试验筛选出的植物乳杆菌、酿酒酵母和醋酸菌为研究对象,从中选择2组发酵剂L1(植物乳杆菌、酿酒酵母)和L2(植物乳杆菌、酿酒酵母和醋酸菌)与自然发酵L0来制作辣椒酵素,通过比较30 d内3组辣椒酵素SOD酶活力、脂肪酶活力、总酸、酒精度等主要质量指标的变化规律,筛选出一组最适合辣椒酵素发酵的益生菌复合发酵剂。为后期辣椒酵素最佳发酵工艺参数的确立,辣椒酵素的工业化生产提供一定的技术支持。
1 材料与方法
1.1 材料与试剂
辣椒:湖北省恩施市建始县;
植物乳杆菌、酿酒酵母、醋酸杆菌:广东省微生物菌种保藏中心;
MRS琼脂、MRS肉汤、麦芽汁琼脂、YPDA培养基:青岛高科园海博生物技术有限公司;
超氧化物歧化酶测试盒、脂肪酶测试盒:南京建成研究所。
1.2 主要仪器设备
恒温磁力搅拌器:524G型,上海梅颖浦仪器仪表制造有限公司;
生物传感器分析仪:S-10型,深圳市西尔曼科技有限公司;
超纯水机:PCR-B-SF-10型,成都品成科技有限公司;
集热式恒温加热磁力搅拌器:DF-101S型,上海科尔仪器设备有限公司;
隔水式恒温培养箱:GHP-9050型,上海齐欣科学仪器有限公司;
立式压力蒸汽灭菌器:YXQ-LS-70A型,上海博讯实业有限公司;
单人净化工作台:SW-CJ-1G型,苏州净化设备有限公司;
多功能酶标仪:EnSpire®2300型,珀金埃尔默股份有限公司。
1.3 试验方法
1.3.1 活化菌株 在无菌条件下,用无菌枪头吸取200~300 μL的无菌水,滴入安瓿瓶中,并用无菌枪头反复吹打,使菌粉呈悬浮状。用无菌接种环挑取一定量的菌悬液,以划线法接种于指定固体培养基中,重复几个平板[19]。最后将平板分别置于指定恒温培养箱中培养。待菌种活化24 h后挑长势良好的菌落分别接种于指定液体培养基中,进行第2代活化。24 h后将活化好的菌悬液按照10%的接种量接种于新的液体培养基中,实时监测3种菌种的生长曲线,确定各菌种最佳接种时间。
1.3.2 辣椒酵素样品的制备 选用色泽鲜亮、表皮完整且无病虫害的新鲜辣椒作为材料。将洗净表皮污渍以及残留农药的辣椒沥干后切成0.5 cm长的辣椒块,放置于超净工作台上紫外杀菌30 min后备用。取杀菌后的辣椒块300 g均分于L0、L1、L2 3个发酵罐中。L0按照料液比1∶1(g/mL)的比例加入浓度为5%的盐水;L1在L0的基础上以107CFU/mL水平接种1.5 mL/100 g的植物乳杆菌和0.5 mL/100 g的酿酒酵母;L2在L1的基础上也同样以107CFU/mL水平再接种0.6 mL/100 g的醋酸菌。接种处理后,将L0、L1、L2 3个发酵罐均置于28 ℃恒温条件下发酵,每隔5 d取一次样,取至第30天。所有样品都保存在-80 ℃左右冰箱中,在分析之前,样品在冰箱中融化,所有试验均一式3份进行。
1.3.3 总酸和pH值的测定 参考GB/T 12456—2008《食品中总酸的测定》对样品进行总酸含量的测定;pH值采用pH计法进行测定。
1.3.4 酒精度的测定 选择乙醇酶膜为活性材料[20-21],采用生物传感分析仪对辣椒酵素进行酒精含量的测定。试验过程中用微量移液枪吸取0.5 g/L的乙醇标准液25 μL 进行定标,根据仪器提示决定定标次数,待仪器提示进样时方可进样。酵素液中的乙醇在乙醇酶膜的作用下会迅速产生过氧化氢[22]。H2O2通过氧化还原反应产生电流,进而产生电压,乙醇的浓度可以通过电压值的大小来衡量。进而得出样品中酒精度含量。
1.3.5 感官评定 请10位有感官评价经验的人按照感官评分标准对辣椒酵素进行感官评分,并取10人平均分作为最终得分。感官评分标准见表1。

表1 感官评分标准Table 1 Sensory Scoring Criteria
1.3.6 超氧化物歧化酶(SOD)活力的测定 采用WST-1法。吸取WST-1[2-(4-Iodophenyl)-3-(4-nitrophenyl)-5-(2,4-disulfophenyl)-2H-tetrazolium,monosodium salt]母液20 μL和缓冲液4 mL混匀制成WST-1工作液,另取15 μL酶贮备液与150 μL酶稀释液混匀制成酶工作液(现用现配)。然后取WST-1工作液200 μL加入96孔板中,对照孔中加入20 μL双蒸水和20 μL酶工作液;对照空白孔中加入20 μL双蒸水和20 μL酶稀释液;测定孔中加入20 μL不同浓度的酵素液和20 μL酶工作液;测定空白孔中加入20 μL不同浓度的酵素液和20 μL酶稀释液。轻轻混匀,37 ℃孵育20 min 后立即用酶标仪测定各孔在450 nm下的吸光值。对照、对照空白、测定空白孔只需做1~2孔,样品测定孔设置3~6孔。最后选取抑制率在50%左右的浓度进行批量试验。按式(1)、(2)计算样品SOD抑制率和SOD酶活力。
(1)
式中:
IC——SOD抑制率,%;
A0——200 μL工作液,20 μL双蒸水与20 μL酶工作液的吸光值;
A1——200 μL工作液,20 μL双蒸水与20 μL酶稀释液的吸光值;
A2——200 μL工作液,20 μL酵素液与20 μL酶工作液的吸光值;
A3——200 μL工作液,20 μL酵素液与20 μL酶稀释液的吸光值;
(2)
式中:
EA——SOD酶活力,U/mL;
0.24——反应液总体积,mL;
0.02——加样体积,mL;
n——样品测试前稀释倍数。
1.3.7 脂肪酶(LPS)酶活力的测定 采用酶比色法。LPS在共脂肪酶和牛磺脱氧胆酸的存在下能够水解1,2-邻-二月桂宗甘油-3-戊二酸-(6′-甲基试卤灵)-酯生成1,2-邻-二月桂宗甘油、戊二酸和6′-甲基试卤灵。当6′-甲基试卤灵酯降解为6′-甲基试卤灵时,此红色染料引起的吸光度的上升速率与样品中LPS活力呈正比。因此在570 nm 波长下,通过连续监测1~2 min吸光值的变化,按式(3)计算酵素液中LPS的活力。
(3)
式中:
EA——LPS活力,U/L;
Δ样本/min——单位时间内酵素液测定孔吸光值的变化率;
Δ空白/min——单位时间内空白测定孔吸光值的变化率;
Δ校准品/min——单位时间内校准品测定孔吸光值的变化率;
45.8——校准品活力,U/L。
1.4 数据处理
所有试验数据经Excel和SPSS Statistics 17.0显著性方差分析后(P<0.05),用Origin 2018 64Bit 软件进行图表的绘制。
2 结果与分析
2.1 菌种活化
由图1可知,随着培养时间的延长,3种菌种的生长曲线均呈先增加后平稳的趋势。而且在3~7 h,3种菌种均处于指数生长中后期,此时菌体活力好且数量多,适合作为接种物;图1显示3种菌种最佳培养时间分别为植物乳杆菌7 h,酿酒酵母6 h,醋酸菌5 h。因此,将第2代活化后的3种菌种分别活化7,6,5 h后接种于辣椒酵素中。
2.2 辣椒酵素发酵过程中总酸含量的变化趋势
食品中的总酸主要包括乙酸、乳酸、苹果酸、柠檬酸等[23],是评价产品品质及风味的一项重要指标。图2是3组辣椒酵素发酵过程中总酸含量的变化情况。由图2可知,在发酵过程中,3组辣椒酵素的总酸含量的变化趋势一致,但在不同的时间段,总酸含量有所差异。发酵前10 d,L1、L2产酸速度快且产酸量多;发酵10~15 d时,微生物利用有机酸使总酸含量部分减少;发酵15 d后,L1、L2的总酸含量分别为34.88,33.57 g/L,较L0分别提高了36.53%,31.42%;发酵15~30 d时,由于发酵底物与发酵环境的影响,大部分微生物的生长受到抑制,3组辣椒酵素的总酸含量不再变化。因此,从产酸量来看,L1更适合辣椒酵素的发酵。
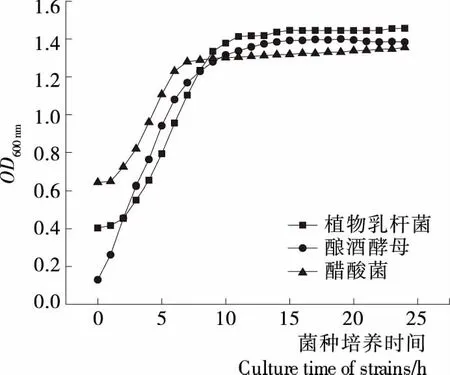
图1 3种菌种的生长曲线Figure 1 Growth curves of three strains
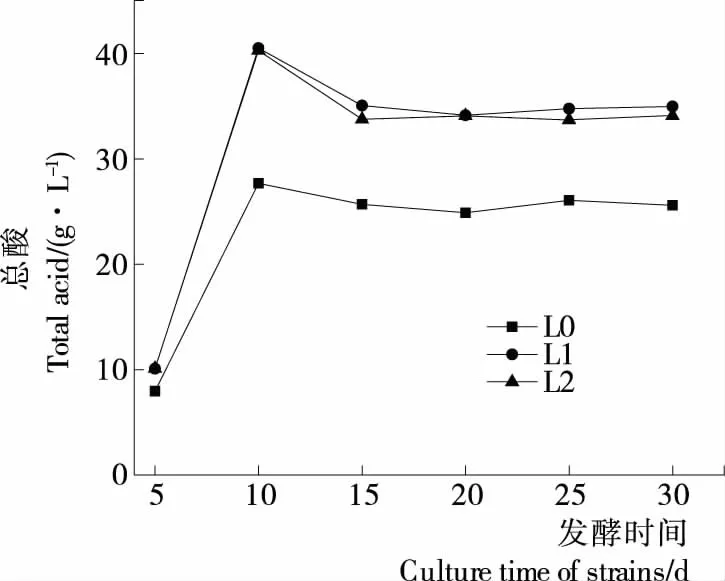
图2 辣椒酵素发酵过程中总酸含量的变化Figure 2 Changes of total acid content in capsicum fermentation
2.3 辣椒酵素发酵过程中pH的变化趋势
如图3所示,随着发酵时间的延长,3组辣椒酵素的pH值呈现先下降后上升而后稳定的趋势。且L1、L2的pH值明显低于L0。发酵初期,酿酒酵母和植物乳杆菌占优势,菌种生长较快且产酸量较多,pH值迅速下降;而后菌种浓度增加且利用部分有机酸,使得pH值缓缓上升[24]。发酵15 d后,L1、L2的pH值分别为3.81,3.78,大部分杂菌的生长受到抑制[25]。因此,从产酸及食品安全角度来看,L1、L2均适宜辣椒酵素的发酵。
2.4 辣椒酵素发酵过程中酒精含量的变化
如图4所示,3组辣椒酵素酒精含量的变化趋势大致相同,均在发酵第10天时酒精含量达到最大值。在整个发酵过程中,L0的酒精含量始终高于L1、L2。辣椒发酵第10天,L0的酒精含量达到最大值0.110 g/L,而L1、L2酒精含量分别为0.042,0.028 g/L。这可能是L0在发酵初期酵母菌处于优势,产生酒精的速度相对较快;而L1、L2由于乳酸菌占主体,对酵母菌的生长有所抑制,使得L1、L2的酒精含量低于L0。发酵第15天时,L0、L1、L2 3组辣椒酵素的酒精含量分别为0.079,0.023,0.022 g/L。其中L1、L2的酒精含量适中,使发酵体系有微微的酒香味,也不失辣椒酵素的风味。
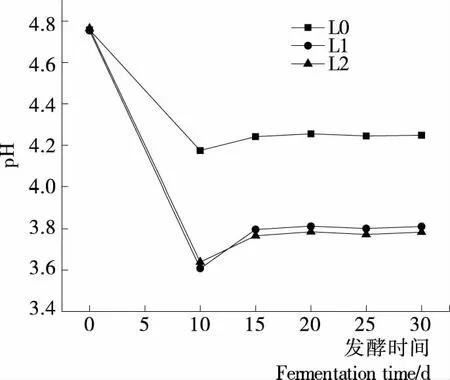
图3 辣椒酵素发酵过程中pH值的变化趋势Figure 3 Change trend of pH value in capsicum fermentation
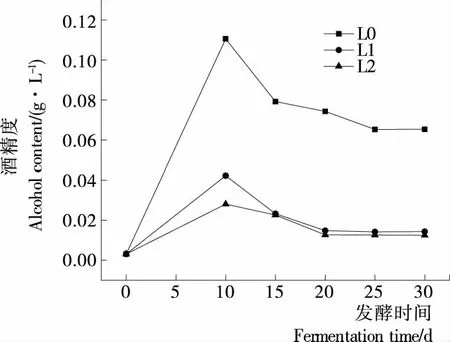
图4 辣椒酵素发酵过程中酒精含量的变化Figure 4 Changes of alcohol content in capsicum fermentation
2.5 辣椒酵素样品的感官评价
由表2可知,在整个发酵过程中,3组辣椒酵素的感官评分均呈现先增加后降低的趋势。L0、L1、L2分别在发酵20,15,15 d时达到最高分(81.76±1.93,88.75±0.88,88.71±1.45)。由此可知,菌种的添加不仅可以缩短辣椒酵素的发酵时间,而且可以改善产品的品质。其中,发酵相同时间后的辣椒酵素在外观色泽方面并无显著差异(P<0.05),这可能是所用原料以及前期处理方式均相同[18]37-38。结合图2、4可知,发酵第10天,3组辣椒酵素的产酸量和酒精含量均达到最高,但仍具有较淡的辣椒生腥味;辣椒酵素特有的风味还未形成。在风味和口感上都还属于未发酵好的产品,其感官评分也相对较低。发酵第15天,L1、L2的总酸含量分别为34.82,33.59 g/L,酒精度分别为0.23,0.22 g/L。其总酸含量及酒精度相较于第10 天虽然有所降低,但在风味上已无辣椒的生腥味;且具有辣椒酵素特有的酱香气和酸辣昧,同时还带有淡淡的醇香。此时L1、L2感官评分均达到发酵周期的最高分[(88.75±0.88),(88.71±1.45)]。因此,结合产酸量、酒精度和感官评分来看,L1、L2均适合辣椒酵素的发酵。
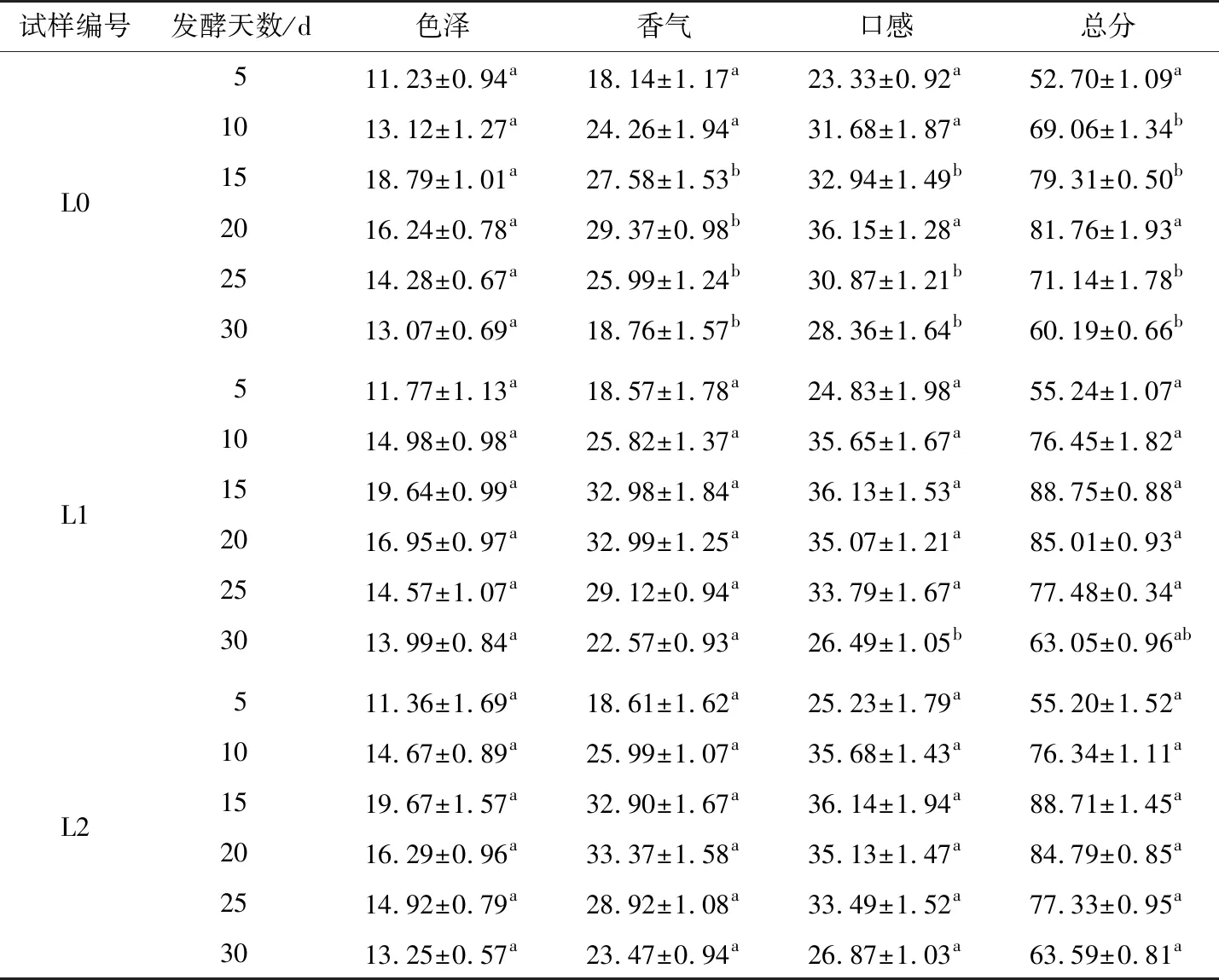
表2 辣椒酵素样品的感官评价†Table 2 Sensory evaluation of pepper enzyme samples
† 字母不同表示同一时间点同一项目之间差异显著。
2.6 辣椒酵素发酵过程中SOD活力的变化
3种发酵方式所得的辣椒酵素在发酵过程中SOD活力的变化见图5。由图5可知,在发酵过程中,3组辣椒酵素SOD活力随着发酵时间的延长呈先升高后下降的趋势。发酵第5天,3组辣椒酵素SOD活力均达到最高,但是从感官角度来看,辣椒酵素还未发酵完成。发酵15 d 后,L1的SOD活力为88.71 U/mL,显著高于L0(81.31 U/mL)和L2(5.25 U/mL)。这可能是L0与L2发酵过程中菌种之间或菌种与发酵底物之间存在着竞争关系;也有可能是L0、L2的发酵环境使得产生的SOD有部分失活。
2.7 辣椒酵素发酵过程中LPS活力的变化
图6是3种发酵方式的辣椒酵素在发酵过程中LPS活力的变化趋势。由图6可知,随着发酵时间的延长,3组辣椒酵素LPS活力呈先上升后下降的趋势。在发酵10 d后,L1、L2的LPS活力显著高于L0(P<0.05),且L1、L2在发酵前15 d,LPS活力呈上升趋势。发酵第15天时,L1的LPS活力最高为45.75 U/L,L1、L2的LPS活力相较于L0分别提高了99.22%,96.27%,而且此时L1的感官评分也达到最高值(88.75±0.88)。因此,从脂肪酶活力角度来看,L1更适合辣椒酵素的发酵。
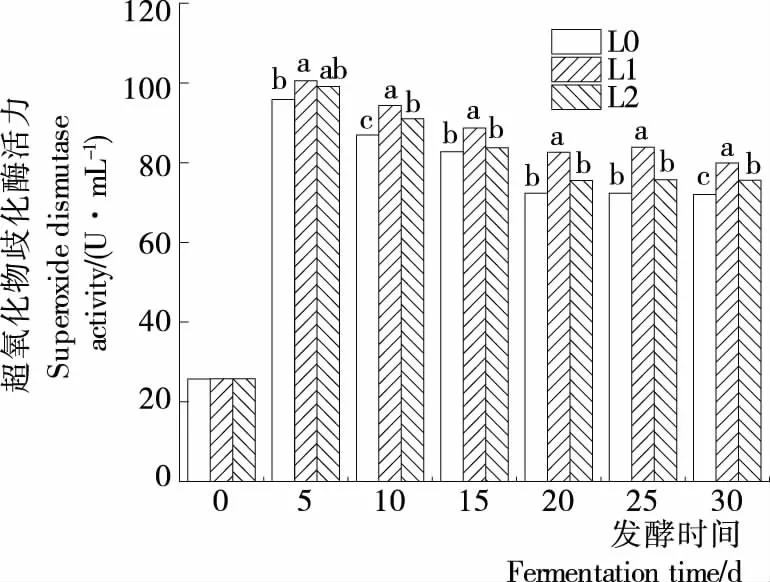
字母不同表示同一时间点3组辣椒酵素之间的SOD活力差异显著,P<0.05
图5 辣椒酵素发酵过程中SOD活力的变化
Figure 5 Changes of superoxide dismutase activity in capsicum fermentation

字母不同表示同一时间点3组辣椒酵素之间的脂肪酶活力差异显著,P<0.05
图6 辣椒酵素发酵过程中脂肪酶活力的变化
Figure 6 Changes of lipase activity in capsicum fermentation
3 结论
试验通过观察辣椒酵素发酵过程中总酸、酒精度、pH、感官、酶活力指标的变化规律,筛选出适宜辣椒酵素发酵的益生菌复合发酵剂。综合以上结果可知:在以辣椒为原料,采用微生物发酵技术生产辣椒酵素时,选用植物乳杆菌和酿酒酵母发酵得到的辣椒酵素品质较好。将植物乳杆菌和酿酒酵母以3∶1(体积比)的比例、2 mL/100 g 的接种量接入发酵罐中,28 ℃条件下发酵15 d,得到的辣椒酵素的感官评分最高为(88.75±0.88)。此时LPS活力最高为45.75 U/L,SOD活力为88.71 U/mL,显著高于L0、L2。因此,选用植物乳杆菌和酿酒酵母来发酵生产辣椒酵素,可有效改善辣椒酵素的色泽、香气、功效以及口感。
试验仅完成了FPE生产中的一个重要环节—微生物的筛选,但是针对其发酵条件以及风味物质方面还未进行研究。发酵条件的优化主要以感官评分和生物活性物质为评价指标,并用顶空固相微萃取,GC-MS对发酵成熟的辣椒酵素进行风味物质的进行测定分析,以期能得到一个发酵成熟的辣椒酵素产品,为后期辣椒酵素产品企业标准的建立提供一些数据和理论支持。

