反相超高效液相色谱法同时测定植物油中8种VE异构体
董 昕
(品测〔上海〕检测科技有限公司,上海 201108)
VE为脂溶性维生素,包含多种生育酚和生育三烯酚。根据苯环上甲基取代基数目和位置的不同,VE分为α-、β-、γ-、δ-生育酚和α-、β-、γ-、δ-生育三烯酚8种异构体,具有抗肿瘤、防止动脉硬化、改善心脑血管疾病、延缓衰老、增强免疫力等多种作用[1-2]。VE是人体必需的植物源维生素,人体自身无法合成,只能通过食物获取。植物油中含有丰富的生育酚和生育三烯酚,是人类摄取VE的主要来源。不同VE异构体的生物活性不同,其中α-型的生物活性最强,δ-型的抗氧化性最强。不同品种植物油中VE组成及含量不同,其营养价值有很大差异。对植物油中VE各异构体的含量测定,能为消费者科学选购植物油提供参考,也能在植物油品种鉴定、掺假鉴别上提供技术参考[3]。
食品中生育酚和生育三烯酚常用的检测方法有分光光度法[4-5]、高效液相色谱法[6-7]、气相色谱法[8-9]及傅里叶变换红外光谱法[10]等。有关8种VE同分异构体的同时快速反相液相色谱检测技术较少,是一检测难点。GB 5009.82—2016采用反相色谱法仅测定α-、β-、γ-、δ-生育酚4种VE;GB/T 26635—2011采用正相色谱法测定8种 VE同分异构体,但是正相高效液相色谱法有许多缺点,如流动相挥发性强、溶剂强致癌性、对仪器损耗大、重复性差、分析时间长及稳定性差等[11-12]。反相高效液相色谱一般采用甲醇、乙腈等毒性较小、挥发性弱的溶剂作流动相,可以很好地克服正相色谱的不足。
试验拟采用常规的甲醇和水为流动相,建立应用PFP色谱柱对植物油中8种VE异构体的超高效液相色谱分析方法。旨在更短的时间内同时检测植物油中8种维生素异构体的含量,为植物油中VE异构体便捷稳定的检测提供技术支持。
1 材料与方法
1.1 仪器与试剂及耗材
1.1.1 主要仪器和设备
超高效液相色谱仪:Waters Acquity H Class 型,配荧光检测器,美国Waters公司;
纯水仪:MILLI-Q型,美国Millipore公司;
分析天平:ME204型,瑞士梅特勒—托利多公司;
旋窝振荡器:Talboys型,美国Talboys公司。
1.1.2 试剂及耗材
α-生育酚(99.6%)、β-生育酚(96.8%)、γ-生育酚(98.2%)、δ-生育酚(97.6%)、α-生育三烯酚(98.6%)、β-生育三烯酚(97.4%)、γ-生育三烯酚(97.9%)、δ-生育三烯酚(98.3%)标准物质:德国Merk公司;
无水乙醇、异丙醇、丙酮、甲醇:色谱纯,国药集团化学试剂有限公司;
一次性注射器:5 mL,上海安谱实验科技股份有限公司;
尼龙滤膜:0.22 μm,上海安谱实验科技股份有限公司。
1.2 方法
1.2.1 标准溶液的配置及标准曲线
(1) 标准储备液:分别准确称取VE各异构体标准品50 mg(精确到0.1 mg),用无水乙醇溶解,转移至50 mL棕色容量瓶中定容至刻度,得到VE各异构体标准储备液(1 000 μg/mL)。于-20 ℃以下避光储存,使用期限不超过3个月。标准溶液使用前需进行标定。
(2) 标准中间液:从各VE异构体储备液中取出10 mL 至100 mL棕色容量瓶中,用无水乙醇定容至刻度,得到8种VE异构体混合中间液(100 μg/mL)。
(3) 标准工作液:从8种VE异构体混合中间液(100 μg/mL)中分别准确吸取0.04,0.08,0.16,0.40,0.80,1.60,4.00 mL溶液至7个10 mL棕色容量瓶。用丙酮定容至刻度,得到浓度为0.4,0.8,1.6,4.0,8.0,16.0,40.0 μg/mL的系列标准工作液。
1.2.2 色谱条件 色谱柱:PFP柱(4.6 mm×100 mm,2.7 μm);流动相:A为甲醇,B为水;流速:0.4 mL/min;进样量:1 μL;色谱柱温度:30 ℃;洗脱程序:等度洗脱,甲醇∶水=93∶7(体积比);激发波长:295 nm;发射波长:330 nm。
1.2.3 样品处理 称取1.000 g油样,用10 mL丙酮溶解,涡旋混合器上充分混匀后,过0.22 μm尼龙滤膜后,上机待测(涡旋过程避免丙酮蒸发;整个过程中注意避光)。
1.3 含量计算
(1)
式中:
Xr——样品中VE各异构体含量,mg/kg;
m——样品质量,g;
V——样品定容体积,mL;
Cr——测定用样液中VE各异构体的浓度,μg/mL。
2 结果与讨论
2.1 提取和净化
GB 5009.82—2016是通过将油脂类样品皂化处理,释放出VE,通过有机溶剂萃取,浓缩,上液相色谱仪分析,处理过程较为麻烦,而且皂化过程中VE容易被氧化而损失掉,使测试结果不够稳定。研究将油脂样品直接溶解于有机溶剂中,释放出VE后直接上液相检测。对于溶剂的选择需满足以下2个条件:① 脂溶性溶剂,使油脂能够完全溶解;② 应与后续的分析方法具有匹配性[1]。可溶解油样的溶剂有正己烷、石油醚、丙酮、异丙醇等溶剂,针对反相色谱中的后续流动相,正已烷、石油醚等与流动相不兼容,从而选择直接用丙酮或异丙醇稀释后上样检测。通过试验发现丙酮溶解油脂效果优于异丙醇且丙酮毒性相较于异丙醇更小,故选择丙酮为提取溶剂。
2.2 色谱条件优化
生育酚和生育三烯酚的β-和γ-异构体结构相似,疏水性质差异不大,在以C18柱为固定相,乙腈—水、甲醇—乙腈、甲醇—水为流动相时,β-和γ-生育酚及生育三烯酚异构体相互重叠,不能有效分离。PFP色谱柱表面键合五氟苯基,有较强的几何尺寸和立体形状选择性,能分离一些结构相似、用烷基固定相很难分离的位置异构体。故选择PFP色谱柱作为分析柱。
VE在紫外检测器和荧光检测器上均有响应,而荧光检测器的响应灵敏度要优于紫外检测的,故选择荧光检测器检测。
对于流动相的选择,研究前期尝试了采用甲醇—水,甲醇—乙腈、乙腈—水、乙腈—二氯甲烷作做为流动相;在以甲醇—乙腈、乙腈—水、乙腈—二氯甲烷等为流动相时,α-生育三烯酚和δ-生育酚色谱峰重叠不能分开,故选甲醇—水为流动相。由于VE是脂溶性,因而流动相中的甲醇比例应尽量高,而甲醇比例太高时α-生育三烯酚和δ-生育酚两个色谱峰也会有部分重叠;当流动相比例在甲醇∶水=93∶7(体积比),流速为0.4 mL/min(超高效色谱柱比较适用的流速)时,8个VE同分异构体能够很好地分离(图1),且色谱峰型,分离效果均最佳,整个分析时间在12 min左右,大大缩短了VE的分析检测时间,提高了检测灵敏度,由于无杂质干扰,节省了溶剂的耗费和检测的时间及耗材成本。
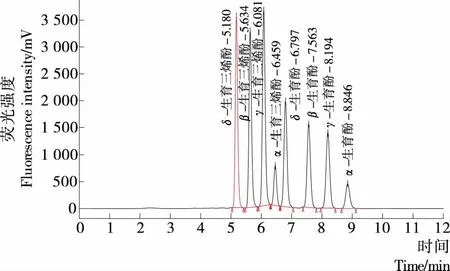
图1 8种VE异构体液相色谱图Figure 1 8 vitamin E isomerism body fluid chromatography
2.3 标准曲线和方法检出限
8种VE异构体标准物质配置成(0.4,0.8,1.6,4.0,8.0,16.0,40.0 μg/mL)进样,以峰面积为纵坐标,浓度为横坐标,绘制标准曲线。以称样量1 g,定容体积10 mL,计算检出限,线性方程及相关系数详见表1。由表1可知:该方法各VE异构体在0.4~40.0 μg/mL范围内线性关系良好,相关系数在0.999 174~0.999 870。
2.4 回收率和精密度
对大豆油样品各VE异构体分别添加3个浓度水平(4,8,20 mg/kg),每个水平进行6次试验,得到样品中8种VE异构体的回收率及相对标准偏差,详见表2。由表2可知:各个浓度水平的添加回收率均在90%以上,精密度为0.28%~1.22%。

表1 8种VE异构体的线性方程和相关系数Table 1 Linear equation and correlation coefficient for the 8 isomerans of vitamin E
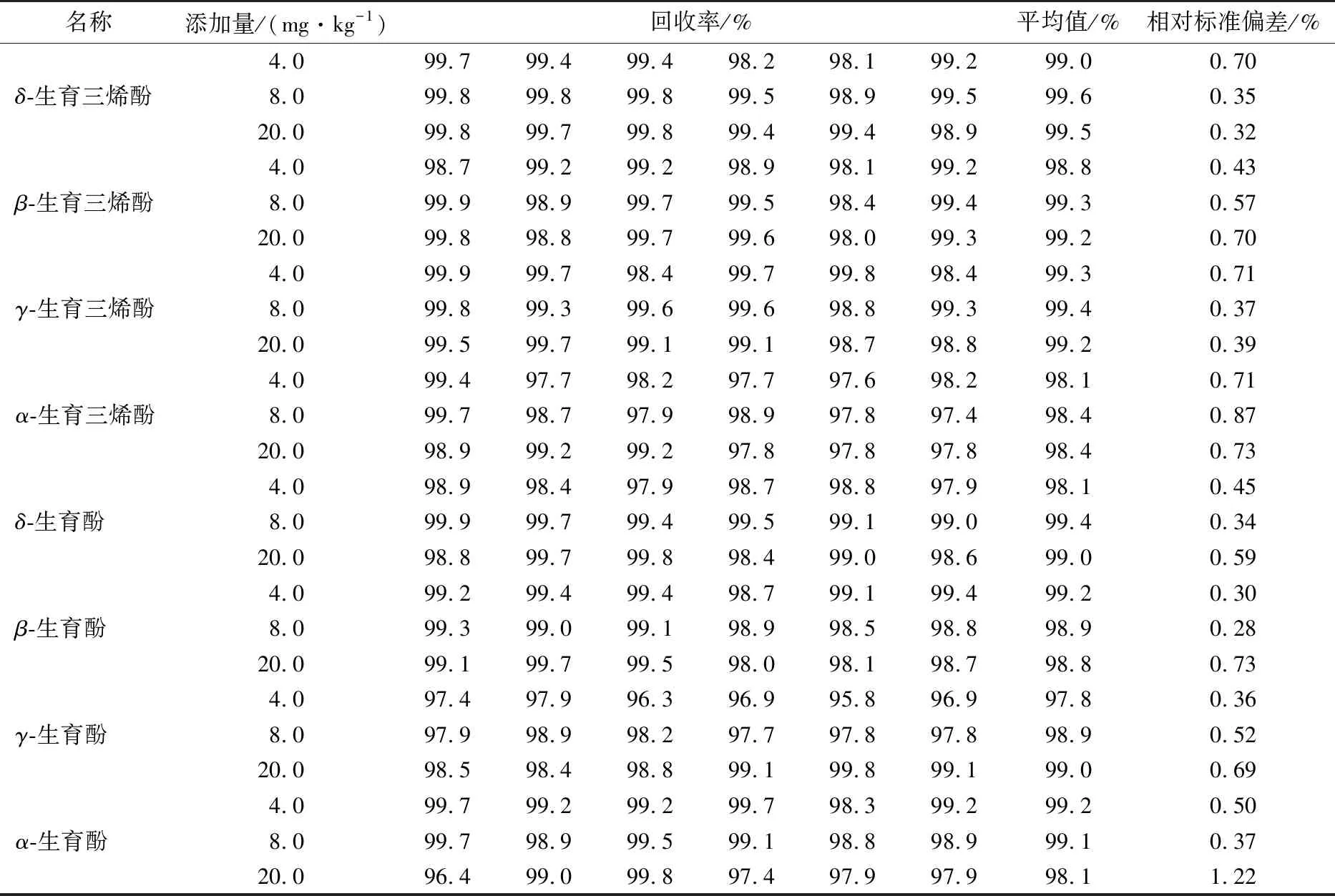
表2 大豆油中8种VE异构体样品添加回收率和精密度Table 2 Recovery rate and precision of 8 vitamin E isomers in soybean oil samples
2.5 VE异构体保留时间及分离度
各VE异构体保留时间和相互之间分离度见表3、4。

表3 8种VE异构体出峰顺序、保留时间、基线宽度Table 3 Peak order, retention time, baseline width of 8 vitamin E isomers

表4 各异构体之间分离度Table 4 Separability between isomers
由表3、4可知:8种VE异构体能够完全分离。
2.6 实测结果
从市面上随机选取15种不同品种的植物油,采用本研究的检测方法检测其VE中的异构体构成,检测结果见表5。

表5 植物油中VE含量Table 5 Vitamin E content in vegetable oils mg/kg
3 结论
通过对植物油样品检测前处理的优化,采用丙酮溶解样品后上样,在优化的色谱条件下,PFP色谱柱超高效液相色谱法能很好地将8种VE异构体分离开,测定结果准确,测试流程简单。相较于皂化法处理油样,丙酮直接溶解提取法检测VE损失更少,结果更准确;相较于正相色谱分离,分析时间更短,重现性更好。采用该方法检测了15种常用植物油中VE各异构体的含量,满足实际样品分析的需求。

