阿利吉仑对氧糖剥夺损伤的SH-SY5Y细胞的保护作用及可能机制*
陆婉杏, 蒙兰青, 黄晓华
(1右江民族医学院附属医院神经内科, 广西 百色 533000; 2广西壮族自治区民族医院神经内科, 广西 南宁 530001)
脑缺血性疾病严重影响着病人的生存质量[1],而脑缺氧缺糖导致的损伤是脑血管疾病的直接原因[2]。氧糖剥夺(oxygen-glucose deprivation,OGD)损伤模型是一种通过剥夺细胞的营养来模拟脑缺血的经典离体细胞模型。近年神经细胞的OGD模型多被用于在细胞水平模拟临床脑缺血过程,以进行细胞自主修复及药效机制方面的研究[3]。
阿利吉仑(aliskiren)不仅具有抗氧化应激、减轻炎症反应、抗凋亡和减小梗死体积等多种功能,还可以改善神经功能的缺失[4]。但目前有关阿利吉仑在神经细胞OGD损伤中的保护作用研究极少,仅见苗江永[5]通过改良Longa线栓法建立脑缺血再灌注模型,因而有必要探讨阿利吉仑对局灶性脑缺血再灌注损伤小鼠的脑保护作用及其相关机制。神经母细胞瘤细胞SH-SY5Y的某些生化、药理和功能方面的特性与正常神经元具有一定的相似性,故而被广泛用于神经系统疾病及药物作用机制方面的研究[6]。本实验以SH-SY5Y细胞为研究对象,建立OGD模型模拟脑缺血性损伤,分析阿利吉仑对氧糖剥夺SH-SY5Y细胞兴奋性氨基酸转运蛋白2(excitatory amion acid transporter 2, EAAT2/GLT-1)、EAAT3/EAAC1、EAAT4、S100钙结合蛋白β亚基(S100 calcium-bin-ding protein β subunit, S-100β)及内皮素1(endothelin-1,ET-1)表达、乳酸(lactic acid,LD)水平、Na+-K+-ATPase活性及细胞形态的影响,探讨阿利吉仑对OGD损伤的SH-SY5Y细胞的保护作用,为脑缺血性疾病的治疗提供实验依据,也为阿利吉仑作为有效脑保护剂的临床应用提供参考资料。
材 料 和 方 法
1 主要药品与试剂
阿利吉仑购自BioChemPartner;DMEM/F12培养基购自HyClone;胎牛血清购自Gibco;PBS、0.25%胰蛋白酶、CCK-8、 GLT-1 ELISA试剂盒、EAAC1 ELISA试剂盒、 EAAT4 ELISA试剂盒、ET-1 ELISA 试剂盒、S-100β ELISA试剂盒和Hoechst 33258购自Bioswamp;LD测试盒和超微量Na+-K+-ATP酶测试盒购自南京建成生物工程研究所。
2 主要仪器
酶标仪购自Labsystems Multiskan MS;CO2恒温培养箱购自Thermo。
3 方法
3.1细胞培养 神经母细胞瘤SH-SY5Y细胞购自中科院细胞库,复苏后接种于含10%的胎牛血清、1%青霉素和链霉素的高糖DMEM中,置于37℃、5% CO2的培养箱中培养。0.25%胰蛋白酶消化、400×g离心3 min、细胞重悬后,传代,选取对数生长期细胞进行实验。
3.2不同OGD处理时间对SH-SY5Y细胞活力的影响 用含10%胎牛血清的培养液调整SH-SY5Y细胞浓度后,种植于96孔板中,使每孔含3×103个细胞;OGD(37 ℃,1%O2,5%CO2)分别处理0 h、0.5 h、1 h、2 h及4 h;处理完毕后向每孔加入10 μL CCK-8溶液,继续培养4 h;于酶联免疫检测仪450 nm处测量各孔的吸光度(A)值,细胞相对存活率(%)=实验组A值/对照组A值×100%。实验重复3次。本实验对照组细胞的存活率定为100%;以细胞相对存活率<60%的处理时间作为OGD造模时间[7];结果筛选出OGD损伤时间为4 h,继续后续实验。
3.3不同剂量阿利吉仑对OGD处理的SH-SY5Y细胞的影响 取培养的SH-SY5Y细胞,随机分为5组,即对照(control)组,OGD组及阿利吉仑低、中、高剂量(5.0、10.0和20.0 μmol/L)组。除对照组外,OGD组和阿利吉仑组均进行OGD造模。将对数生长期SH-SY5Y细胞以1×108/L接种到96孔板,正常培养24 h。OGD组换成无糖培养液,阿利吉仑低、中、高组换成含5.0、10.0和20.0 μmol/L阿利吉仑的无糖培养液,OGD(37℃,1%O2,5%CO2)处理4 h后,换正常培养液,37℃、5% CO2培养24 h。
3.4ELISA检测SH-SY5Y细胞的GLT-1、EAAC1、EAAT4、ET-1和S-100β表达 OGD处理4 h后,分别按照GLT-1、EAAC1、EAAT4、ET-1和S-100β ELISA试剂盒说明书检测各实验组SH-SY5Y细胞的GLT-1、EAAC1、EAAT4、ET-1和S-100β表达。实验重复3次。
3.5Hoechst 33258染色观察SH-SY5Y细胞的形态变化 OGD处理4 h后,复氧24 h,弃培养液,用4%多聚甲醛固定10 min,弃固定液,PBS洗两遍,每次3 min,弃掉液体。加入少量Hoechst 33258染液,室温染色3-5 min。弃掉染色液,用PBS洗5遍,每次3 min,弃掉液体。荧光显微镜检测和拍照。
3.6LD测试盒和超微量Na+-K+-ATP酶测试盒检测SH-SY5Y细胞的LD含量和Na+-K+-ATPase活性 OGD处理4 h后,取各孔上清,分别按LD测试盒和超微量Na+-K+-ATP酶测试盒说明书操作,在酶标仪530 nm和636 nm下读取各孔的A值,计算各组的平均值。实验重复3次。LD含量用mmol/(g protein)表示;Na+-K+-ATPase活性用U/(g protein)表示。
4 统计学处理
采用统计学软件SPSS 17.0对各组实验数据进行分析,所有数据均以平均值±标准差(mean ± SD)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 不同OGD损伤时间对SH-SY5Y细胞活力的影响
CCK-8检测结果显示,与正常细胞相比,OGD损伤0.5 h、1 h、2 h和4 h的细胞A值逐渐降低(P<0.05),即OGD损伤时间越长,SH-SY5Y细胞的活力越低,见图1。OGD损伤4 h时,SH-SY5Y细胞的相对活力不足60%,因此4 h可作为后续实验OGD造模时间。
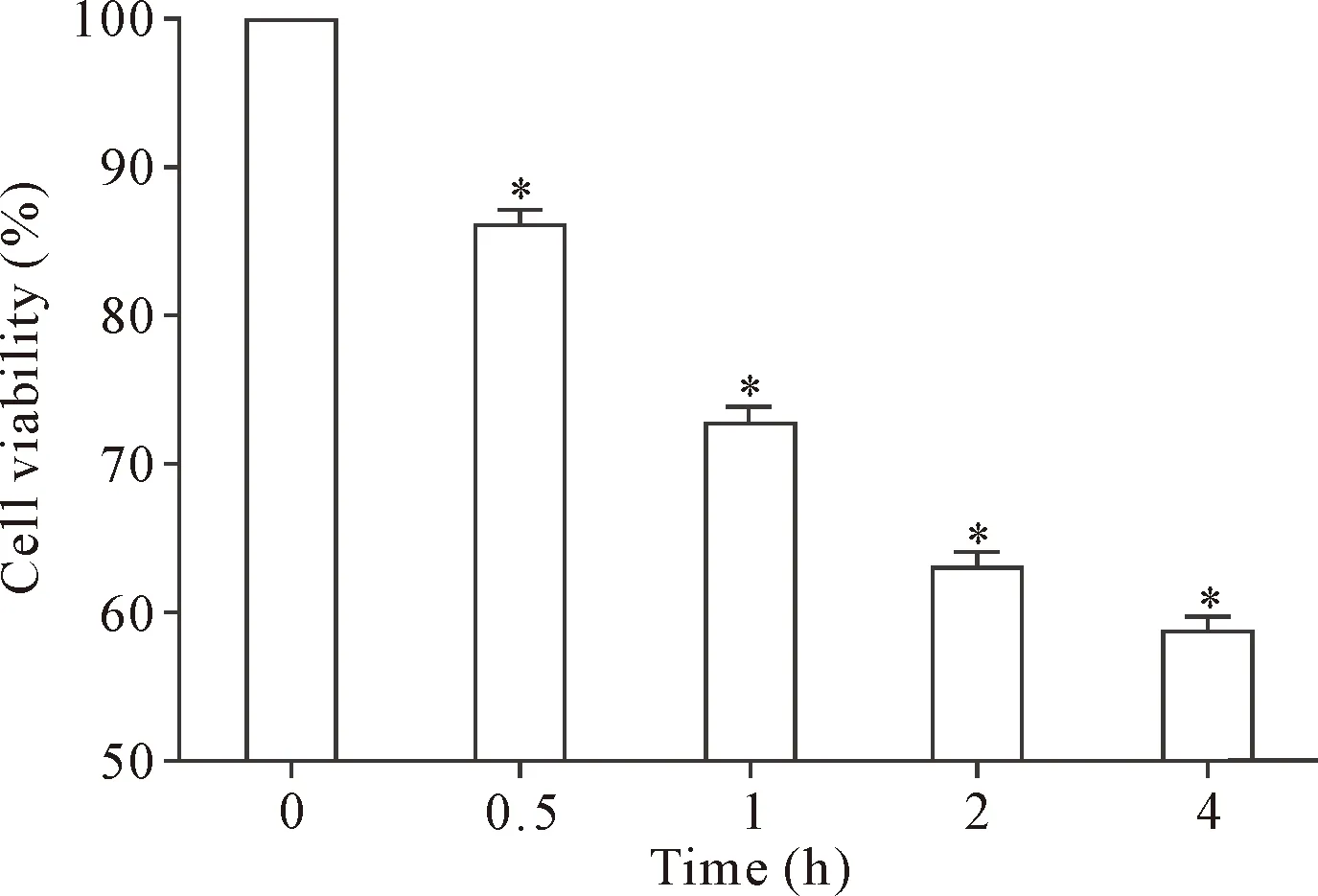
Figure 1.Effect of time after OGD injury on viability of SH-SY5Y cells. Mean±SD.n=3.*P<0.05vs0 h group.
图1 不同OGD损伤时间对SH-SY5Y细胞活力的影响
2 阿利吉仑对OGD损伤的SH-SY5Y细胞GLT-1、EAAC1、EAAT4、ET-1和S-100β表达的影响
ELISA检测结果表明,与对照组相比,OGD组的GLT-1、EAAC1和EAAT4表达显著减少(P<0.05),ET-1和S-100β的表达显著增加(P<0.05);与OGD组比较,阿利吉仑(5.0、10.0和20.0 μmol/L)组的GLT-1、EAAC1和EAAT4表达呈剂量依赖性增加(P<0.05), ET-1和S-100β表达呈剂量依赖性减少(P<0.05),图2。

Figure 2.Effect of aliskiren on levels of GLT-1, EAAC1, EAAT4, ET-1 and S-100β in SH-SY5Y cells induced by OGD. Mean±SD.n=3.*P<0.05vscontrol group;△P<0.05vsOGD group.
图2 阿利吉仑对OGD损伤的SH-SY5Y细胞GLT-1、EAAC1、EAAT4、ET-1和S-100β表达的影响
3 阿利吉仑对OGD损伤的SH-SY5Y细胞形态的影响
Hoechst 33258染色结果显示,对照组的细胞核总体染色均匀,呈淡蓝色;OGD损伤后,SH-SY5Y细胞核呈亮蓝色,致密浓染,少数呈碎片状;阿利吉仑(5.0、10.0和20.0 μmol/L)干预后,致密浓染的细胞核有所减少,形态趋于正常,见图3。
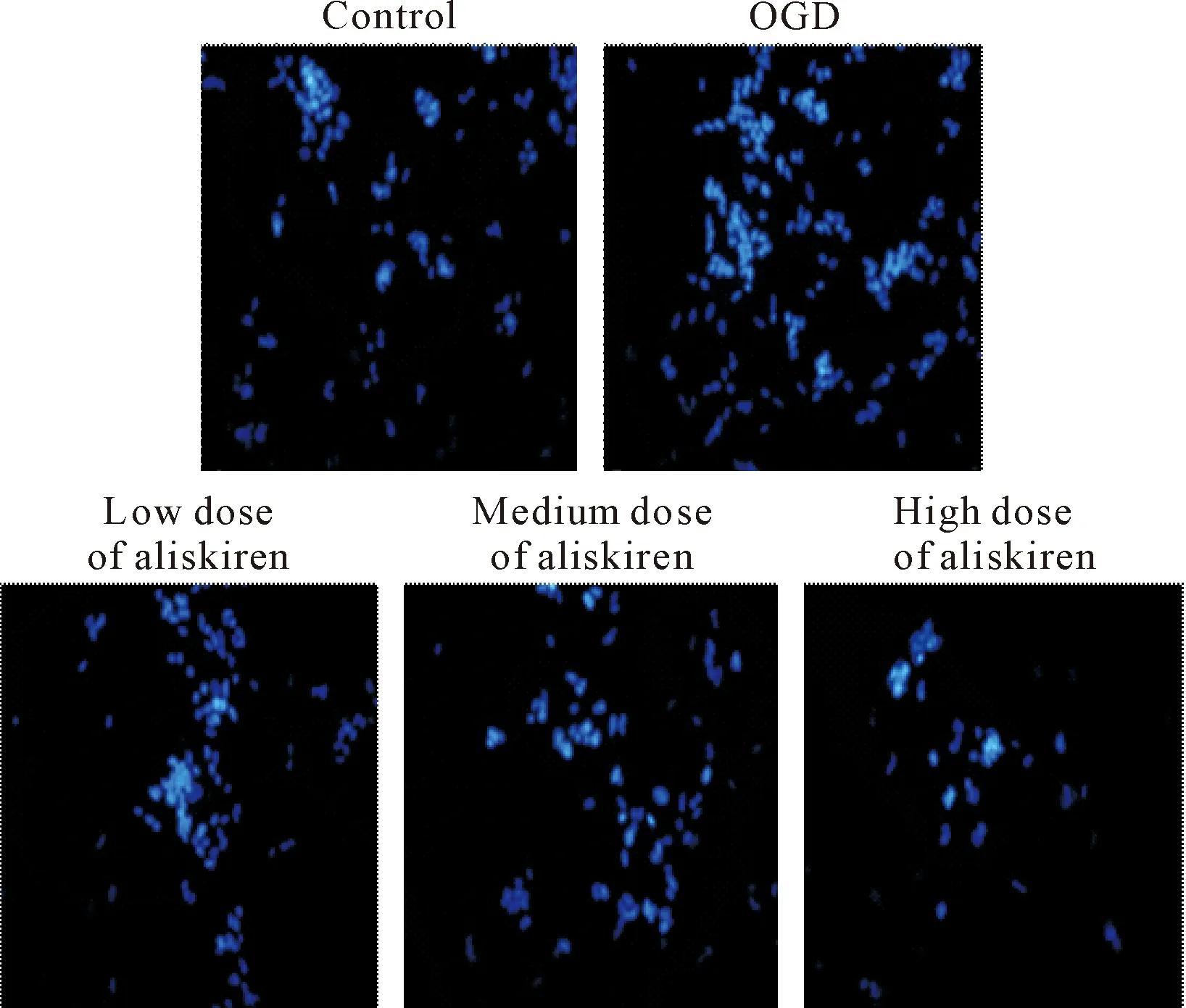
Figure 3.Hoechst 33258 staining of SH-SY5Y cells in each group (×200).
图3 各组SH-SY5Y细胞Hoechst 33258染色
4 阿利吉仑对OGD损伤的SH-SY5Y细胞乳酸含量和Na+-K+-ATPase活性的影响
与对照组相比,OGD组的乳酸含量显著升高(P<0.05),Na+-K+-ATPase活性显著降低(P<0.05);与OGD组相比,阿利吉仑(5.0、10.0和20.0 μmol/L)组的LD含量呈剂量依赖性降低(P<0.05),Na+-K+-ATPase活性呈剂量依赖性升高(P<0.05),见图4。
讨 论
许多中枢神经系统疾病与神经细胞的缺糖缺氧密切相关。脑细胞对葡萄糖和氧的依赖性都非常高,长期缺氧缺糖会导致脑细胞的不可逆性损伤,故而选择合适的神经细胞OGD损伤时间进行神经保护类药物的筛选尤为重要[8]。本研究采用CCK-8检测OGD损伤不同时间后SH-SY5Y细胞的活力,结果显示OGD损伤时间越长,细胞活力越低;4 h时,细胞相对活力不足60%,因此,选择4 h作为后续实验OGD造模时间比较合适。因为细胞活力太高时,后期阿利吉仑干预难以体现其对SH-SY5Y细胞的保护作用;细胞活力太低时,阿利吉仑干预难以对OGD损伤的SH-SY5Y细胞进行保护。有研究也认为,右美托咪啶对氧糖剥夺/再灌注诱导神经细胞凋亡起保护作用时,细胞活力接近50%的氧糖剥夺再灌注(OGD/R)造模时间比较合适[7]。
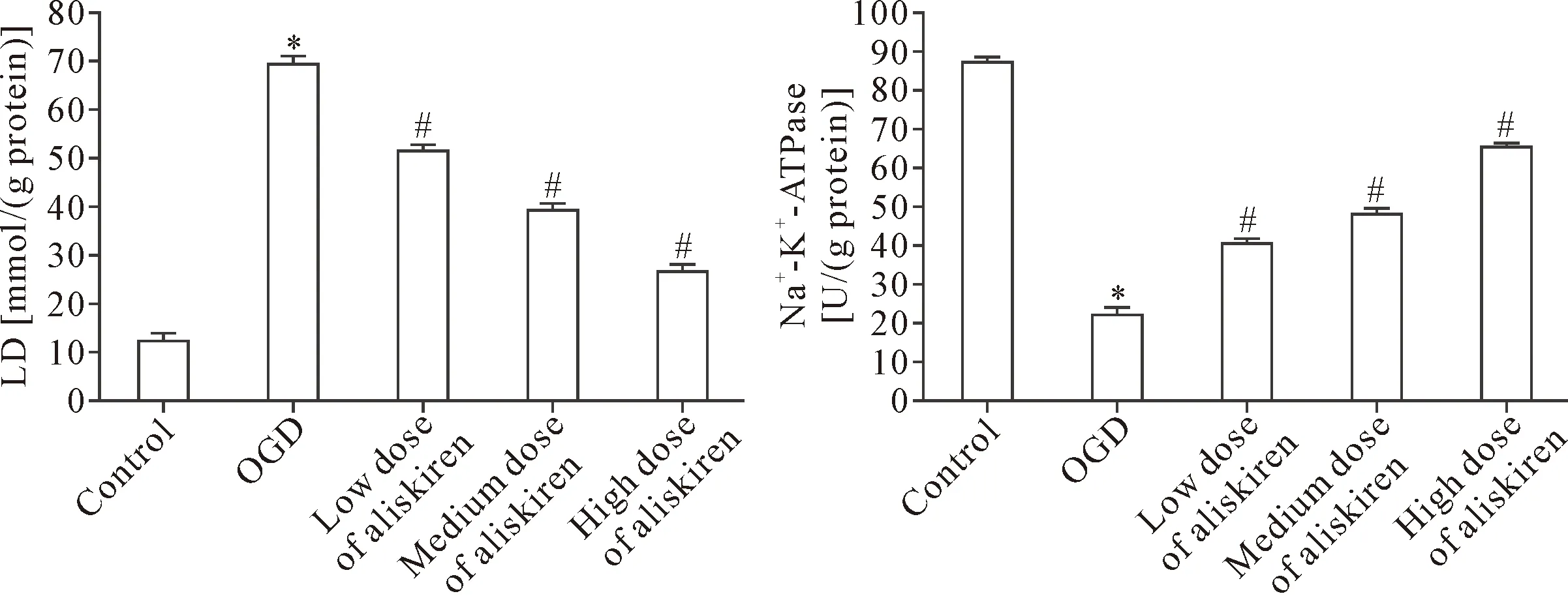
Figure 4.Effect of aliskiren on content of LD and activity of Na+-K+-ATPase in SH-SY5Y cells induced by OGD. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsOGD group.
图4 阿利吉仑对OGD损伤的SH-SY5Y细胞LD含量和Na+-K+-ATPase活性的影响
兴奋性氨基酸毒性是脑缺血损伤的主要机制之一。谷氨酸的清除主要受兴奋性谷氨酸转运体的调节[9]。虽然GLT-1为胶质细胞转运体,但近年发现了仅在肽链 C端进行改变的 GLT-1 剪切变异体,且GLT-1a、GLT-1b和GLT-1c主要分布于神经元[10];EAAC1和EAAT4均为神经元转运体。EAATs和Na+-K+-ATPase是直接偶联的,即两者作为一个功能复合体调控谷氨酸的转运[11]。本实验ELISA结果表明,阿利吉仑能通过上调OGD损伤的SH-SY5Y细胞GLT-1、EAAC1和EAAT4表达水平,增强Na+-K+-ATPase活性,通过GLT-1、EAAC1和EAAT4及时将兴奋性的谷氨酸从突触间隙转运到细胞内,终止兴奋性突触传递并维持细胞外谷氨酸的正常浓度,从而减轻细胞损伤。
ET-1是一种在中枢神经系统中能产生广泛病理、生理效应的内皮缩血管因子[12]。当发生脑缺血缺氧时,ET-1的合成和释放量会大幅提高,造成血管的剧烈收缩,导致严重的脑损伤。本实验中,阿利吉仑干预后各剂量组的ET-1水平均较OGD组显著下降,这提示阿利吉仑可能是通过下调ET-1来减少OGD对SH-SY5Y细胞的损伤。
S-100β是一种酸性钙结合蛋白,参与调节神经细胞的生长、分化和代谢,被认为是反映脑胶质细胞损伤的生化标志性蛋白[13]。另外,星形胶质细胞和神经元相互影响。EAATs 能够促进谷氨酸能突触周围的星形胶质细胞快速释放谷氨酰胺,被神经元摄取用来合成谷氨酸和γ-氨基丁酸[14]。正常情况下的S-100β蛋白浓度很低,当S-100β蛋白表达过量时,神经元内Ca2+水平上升,当Ca2+超过神经元的耐受阈时,会产生神经毒性,造成神经功能的严重损伤[15]。本实验ELIA检测结果显示,阿利吉仑组SH-SY5Y细胞的S-100β含量显著低于OGD组,提示阿利吉仑可能是通过抑制S-100β的表达水平,阻止其介导的Ca2+浓度超载,从而保护OGD损伤的SH-SY5Y细胞。
本实验中,OGD组SH-SY5Y细胞的LD含量显著高于对照组,提示OGD损伤可以降低细胞利用氧的能力,细胞的能量代谢主要通过糖酵解获得;细胞内Na+-K+-ATPase活性降低,表明细胞的能量代谢发生障碍。阿利吉仑干预后,细胞的LD含量显著减少,Na+-K+-ATPase活性显著增加,说明阿利吉仑可以减轻OGD损伤引起的细胞能量代谢障碍,增加细胞的能量供应,发挥神经保护作用。这与秦文等[16]在研究N-乙酰半胱氨酸对氧糖剥夺大鼠皮层星形胶质细胞的保护作用时得出的结论一致。本研究结果为阿利吉仑在临床应用及产品开发提供了实验依据,也为防治脑缺血疾病的药物开发提供了参考资料。

