琼胶寡糖对黄瓜抗性及啶虫脒残留的影响
孙敏秀 王丽丽 杨 锐 陈海敏,*
(1 宁波大学浙江省海洋生物工程重点实验室,浙江 宁波 315211;2 宁波市农业科学研究院,浙江 宁波 315040)
施用农药已成为防治植物病虫害、去除杂草、调节农作物生长和提高农产品产量和质量的重要措施之一。然而,大量及不合理使用农药会对人类健康和环境造成严重危害[1]。因此,探索降低农药残留的方法,是实现果蔬高效、安全生产的关键。
琼胶寡糖是琼胶进一步降解得到的一种低聚合度的寡糖分子。生物活性研究显示,琼胶寡糖具有抑菌、抗氧化、抗炎及抗肿瘤作用[2-4],对植物具有激发子活性。如琼胶寡糖可作为信号分子被坛紫菜所识别,通过调节藻体的防御反应,诱导活性氧爆发,减少藻体附生细菌的数量,从而增强坛紫菜的抗烂性[5-7]。琼胶寡糖能诱导真江蓠中寡糖氧化酶的表达,催化寡糖氧化脱氢生成醛类和过氧化氢(H2O2)[8]。此外,琼胶寡糖也可作为叶面肥料,促进秋葵的生长及营养品质的提高[9]。然而,有关琼胶寡糖在促进黄瓜(CucumissativusL.)生长、提高黄瓜抗性反应以及对黄瓜农药残量影响的研究尚鲜见。本研究以琼胶寡糖处理黄瓜,观察其对黄瓜生长、抗性相关酶活与基因表达的影响,初步探究琼胶寡糖作为植物激发子的作用,并通过测定黄瓜的农药残留变化,探索其降低农药残留的可行性,旨在为琼胶寡糖的开发及其在农业上的应用提供依据。
1 材料与方法
1.1 试验材料
本试验所用水果黄瓜为碧翠18号,由浙江勿忘农种业股份有限公司育成。聚合度2~10的琼胶寡糖由浙江省海洋生物工程重点实验室自制。挺克啶虫脒购自宁波三江益农化学有限公司。田间试验于2018年3-6月在宁波横溪镇宁波市农业科学研究院基地进行。
1.2 试验设计
待黄瓜幼苗长至二叶一心时,选取长势一致的幼苗移栽至大棚。试验共设置3个琼胶寡糖处理浓度:0(CK)、100、200 μg·mL-1,均匀地喷施在叶片上,每周固定喷施1次。每处理30株,3个重复。田间管理同常规。
1.3 各项指标的测定
植株生长指标及产量测定:处理后第1~第5周,分别从各处理组中随机挑选15株黄瓜植株测定株高,并于第5周测定黄瓜植株的茎粗、单叶叶面积[10]和叶绿素相对含量,分别用游标卡尺、直尺和SPAD-502叶绿素仪(美能达公司,日本)测定。摘果后,记录各处理组摘果重量,以小区面积产量折算每667 m2的总产量。
抗性相关酶活检测:坐果后,选取同一位置、外形完好的黄瓜功能叶片进行酶活性及几丁质酶(chitinase)和病程相关蛋白 1(PR1-1a)基因的差异表达检测。采用试剂盒法分别测定黄瓜叶片超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、多酚氧化酶(polyphenol oxidase,PPO)、过氧化氢酶(catalase,CAT)活性以及丙二醛(malondialdehyde,MDA)含量(南京建成生物工程研究所,产品序号分别为A001、A084、A136、A007、A003)。
基因差异表达的检测:提取叶片总RNA,反转录成cDNA进行定量PCR测定。以黄瓜18S作为内参,引物为18S-QF:5′-TGGACTCTGGTGATGGTGTTA-3′和18S-QR:5′-CAATGAGGGATGGCTGGAAAA-3′。几丁质酶引物为CH-QF:5′-GCCGCAGTGTCCAATACCAG-3′和CH-QR:5′-TCAGGAGATTGTCCGCGTTA-3′;PR1-1a引物为PR1-QF:5′-AACTCTGGCGGACCTTAC-3′和PR1-QR:5′-TCAATATGGCCTTTGGTATA-3′。所有基因均采用同一扩增程序:95℃预变性3 min;95℃变性10 s、55℃退火10 s、72℃延伸40 s,共45个循环。采用2-ΔΔCt法[11]计算基因相对表达量。
1.4 啶虫脒残留检测
待黄瓜坐果后,选取大小约为成熟个体一半的黄瓜为试验对象并进行标记,考虑农药质量、农药半衰期以及实际应用等因素,于5月7日选取0.2 g·kg-1的啶虫脒对试验黄瓜进行均匀喷施。于施药后0(4 h)、1、3、5、7 d采用多点混合采样法采集果实。按照GB/T 20769-2008[12]中啶虫脒残留量测定方法进行测定。
此外,采集施药后4 d 的0(CK)μg·mL-1处理组黄瓜进行琼胶寡糖溶液浸泡处理。采集的黄瓜分为4个处理,空白组不作任何处理,其他三组分别放入0、100和200 μg·mL-1琼胶寡糖溶液中浸泡30 min,取出吹干,进行啶虫脒残留量检测。
1.5 数据分析
采用Origin 8.0和DPS 17.10高级版软件对数据进行处理,试验数据为3次重复的平均值±标准差。采用Duncan’s多重极差检验进行显著性分析(P<0.05)。
2 结果与分析
2.1 琼胶寡糖对黄瓜生长和产量的影响
由表1可知,琼胶寡糖处理后的黄瓜植株的茎粗、叶面积、单叶叶绿素相对含量较CK都有显著增加(P<0.05)。如200 μg·mL-1琼胶寡糖组的叶绿素相对含量增长率达到20.26%。此外,黄瓜产量也受琼胶寡糖溶液的影响显著增加,200 μg·mL-1琼胶寡糖处理下,其产量较CK增加15.38%(P<0.05)。由此可知,喷施琼胶寡糖对黄瓜的生长及产量均产生了明显的促进作用。
注:同列不同小写字母表示处理间差异显著(P<0.05)。
Note: Different lowercase letters in the same column indicate significant difference among treatments at 0.05 level.
在黄瓜的整个生长期间,株高始终处于不断变化中。由图1可知,10、200 μg·mL-1琼胶寡糖溶液都促进了黄瓜植株的生长,在第5周各处理组之间差异达到最大,与CK相比,100 μg·mL-1琼胶寡糖处理组黄瓜株高显著增加22.14%,200 μg·mL-1琼胶寡糖处理组效果更好,其黄瓜株高显著增加了25.82%(P<0.05)。
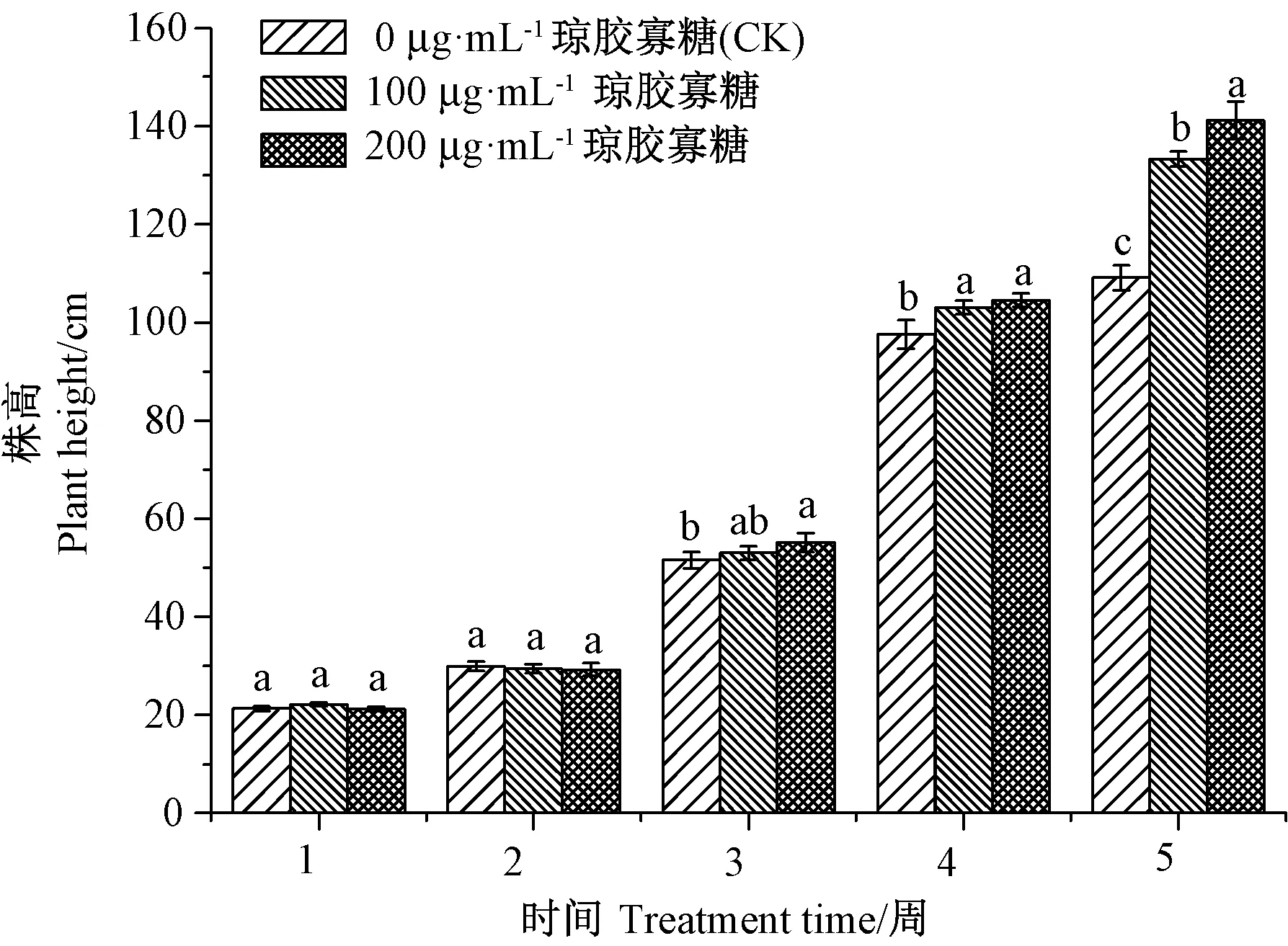
注:不同小写字母表示同一时间下不同处理组间差异显著(P<0.05)。Note: Different lowercase letters indicate significant difference at 0.05 level between treatments at the same time. 图1 黄瓜株高的动态变化Fig.1 Dynamic change diagram of cucumber plant heights
2.2 琼胶寡糖对黄瓜叶片抗氧化酶活性以及MDA含量的影响
由图2可知,不同浓度的琼胶寡糖使叶片中的SOD、POD、CAT、PPO活性明显升高。与CK相比,SOD活性在处理4 h时即出现显著增高(P<0.05),其中,200 μg·mL-1琼胶寡糖处理组SOD活性显著高于100 μg·mL-1琼胶寡糖处理组(图2-A)。与CK相比,CAT活性同样在处理早期即出现显著升高,200 μg·mL-1琼胶寡糖处理组CAT活性在处理4 h时是CK的31.33%,且两者差异显著(P<0.05);100 μg·mL-1琼胶寡糖处理组CAT活性在处理1 d时较CK升高16.57%(P<0.05)(图2-B)。PPO活性在100 μg·mL-1琼胶寡糖处理下均高于CK,其中处理4 h时是CK的2.19倍(P<0.05)(图2-C)。POD活性变化趋势不明显,仅在处理3 d时100 μg·mL-1琼胶寡糖处理组POD活性较CK升高28.77%(P<0.05)(图2-D)。不同浓度琼胶寡糖处理组的MDA含量随着处理时间的延长不断下降,在处理5 d时,200 μg·mL-1琼胶寡糖处理组MDA含量较CK显著下降了32.13%(P<0.05)(图2-E)。
2.3 琼胶寡糖对黄瓜叶片抗性基因几丁质酶与PR1-1a基因相对表达量的影响
由图3-A可知,几丁质酶基因在100 μg·mL-1琼胶寡糖处理时做出迅速响应,处理4 h时是CK的4.2倍(P<0.01),但随后下降。而200 μg·mL-1处理组在处理1 d时做出强烈响应,其表达量达到CK的10.4倍(P<0.01),随后也降低。由图3-B可知,PR1-1a基因在处理1 d时表达最显著,其中100 μg·mL-1琼胶寡糖处理组的响应更明显,是CK的14.5倍(P<0.01),随后都出现降低趋势。
2.4 琼胶寡糖对黄瓜啶虫脒残留量的影响
由图4可知,在黄瓜喷施琼胶寡糖溶液后,农药残留量随着时间的延长逐渐减少,残留消解动态过程符合一级动力学方程。啶虫脒在CK的消解方程为:Ct=0.475 9e-0.165 7t,半衰期为4.2 d;100 μg·mL-1处理组的消解式为:Ct=0.405 4e-0.183 3t,半衰期为3.9 d;200 μg·mL-1处理组的消解式为:Ct=0.331 8e-0.226 1t,半衰期为3.0 d。由此可知,琼胶寡糖使啶虫脒的消解半衰期减短,其中200 μg·mL-1琼胶寡糖处理下第1天与第5天的啶虫脒含量较CK分别显著下降34.35%和48.46%(P<0.05),且200 μg·mL-1琼胶寡糖处理组较100 μg·mL-1琼胶寡处理组的降低农药残留的效果好。
2.5 琼胶寡糖浸果对黄瓜啶虫脒残留的影响
琼胶寡糖对黄瓜浸果后的农残结果显示,黄瓜上啶虫脒的初始残留值为0.18 ± 0.06 mg·kg-1,经过清水浸泡30 min后,减少了36%(P<0.05);经100 μg·mL-1琼胶寡糖浸泡30 min后减少68.29%(P<0.01);经200 μg·mL-1琼胶寡糖浸泡后减少61.43%(P<0.01)。由此可见,100 μg·mL-1琼胶寡糖浸泡黄瓜降低农药残留的效果更佳。

注:不同小写字母表示不同处理下差异显著(P<0.05)。Note: Different lowercase letters indicate significant difference at 0.05 level among different treatments.图2 不同浓度琼胶寡糖对黄瓜叶片抗氧化酶活性及MDA含量的影响Fig.2 Effects of different concentrations of agar oligosaccharides on antioxidant enzyme activities and MDA contents in cucumber leaves
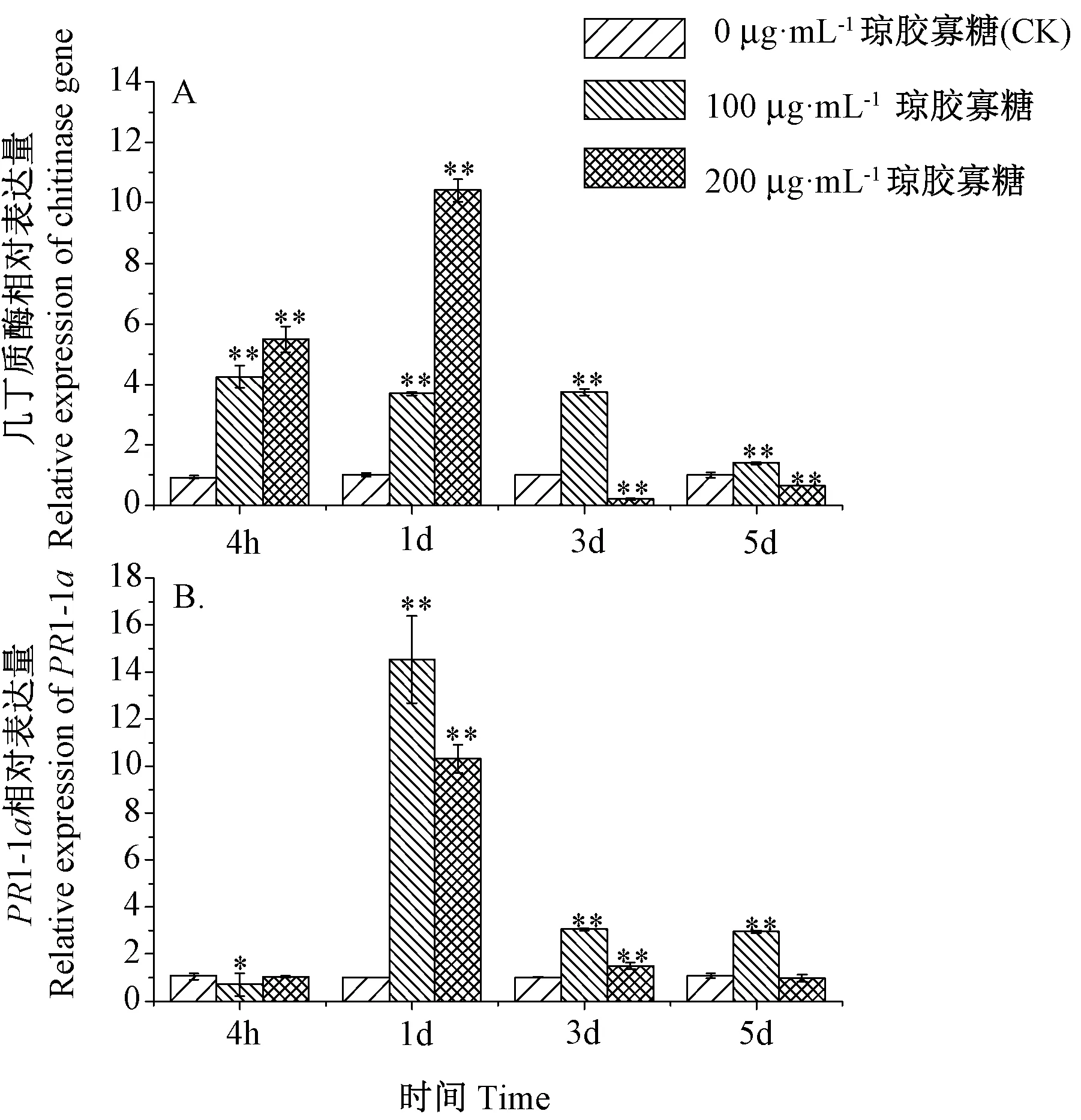
注:*表示处理间差异显著(P<0.05),**表示处理间差异极显著(P<0.01)。下同。Note: * indicates significant difference between treatments at 0.05 level, and ** indicates extremely significant difference between treatments at 0.01 level. The same as following.图3 不同浓度琼胶寡糖处理后几丁质酶(A)和PR1-1a基因(B)的表达变化Fig.3 The expressions of chitinase (A) and PR1-1a genes (B) after cucumbers treated with different concentrations of agar oligosaccharides
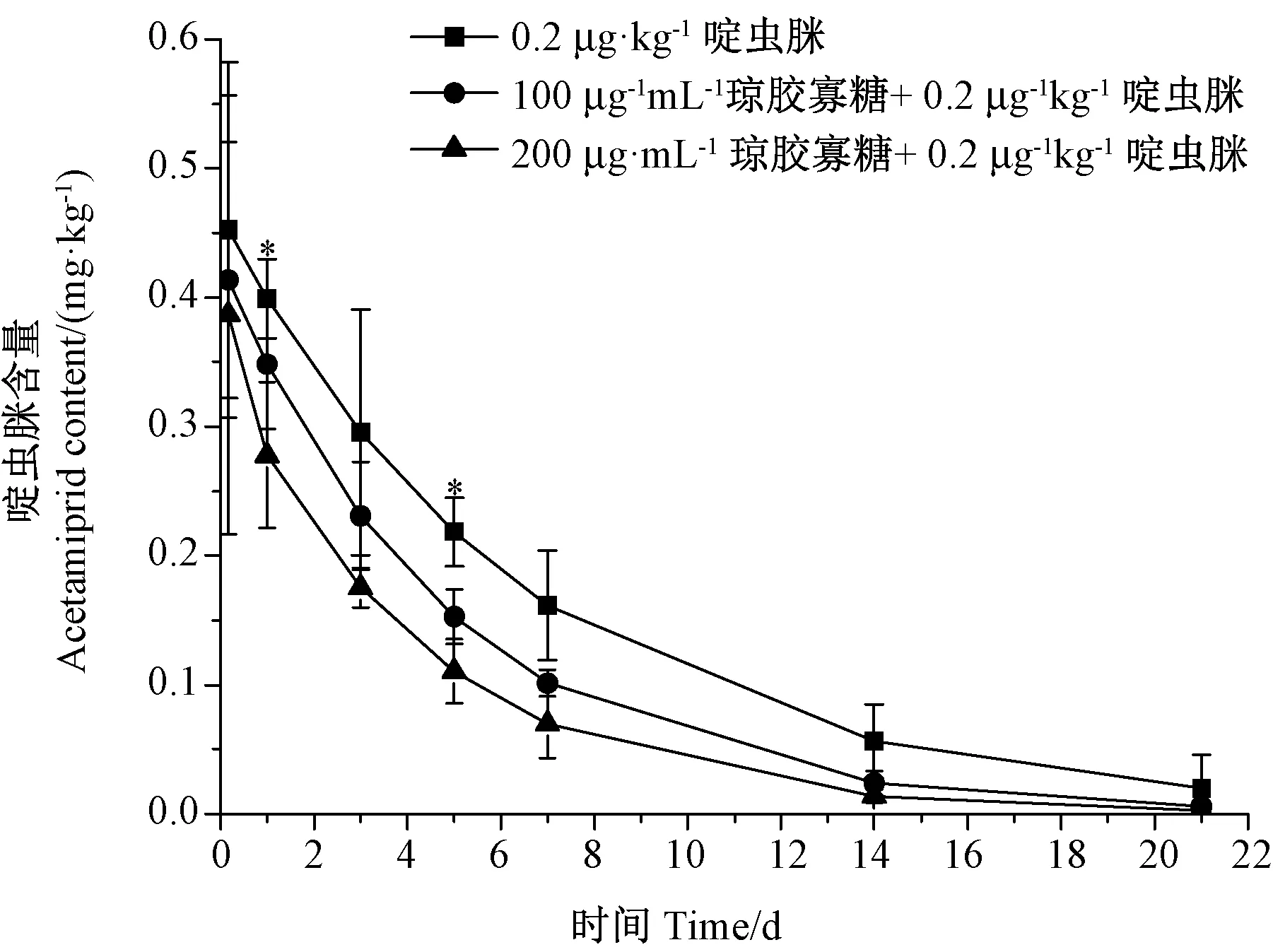
图4 不同浓度琼胶寡糖溶液对啶虫脒在黄瓜中的消解曲线影响Fig.4 Effects of different concentrations of agar oligosaccharide solution on the digestion curve of acetamiprid in cucumbers
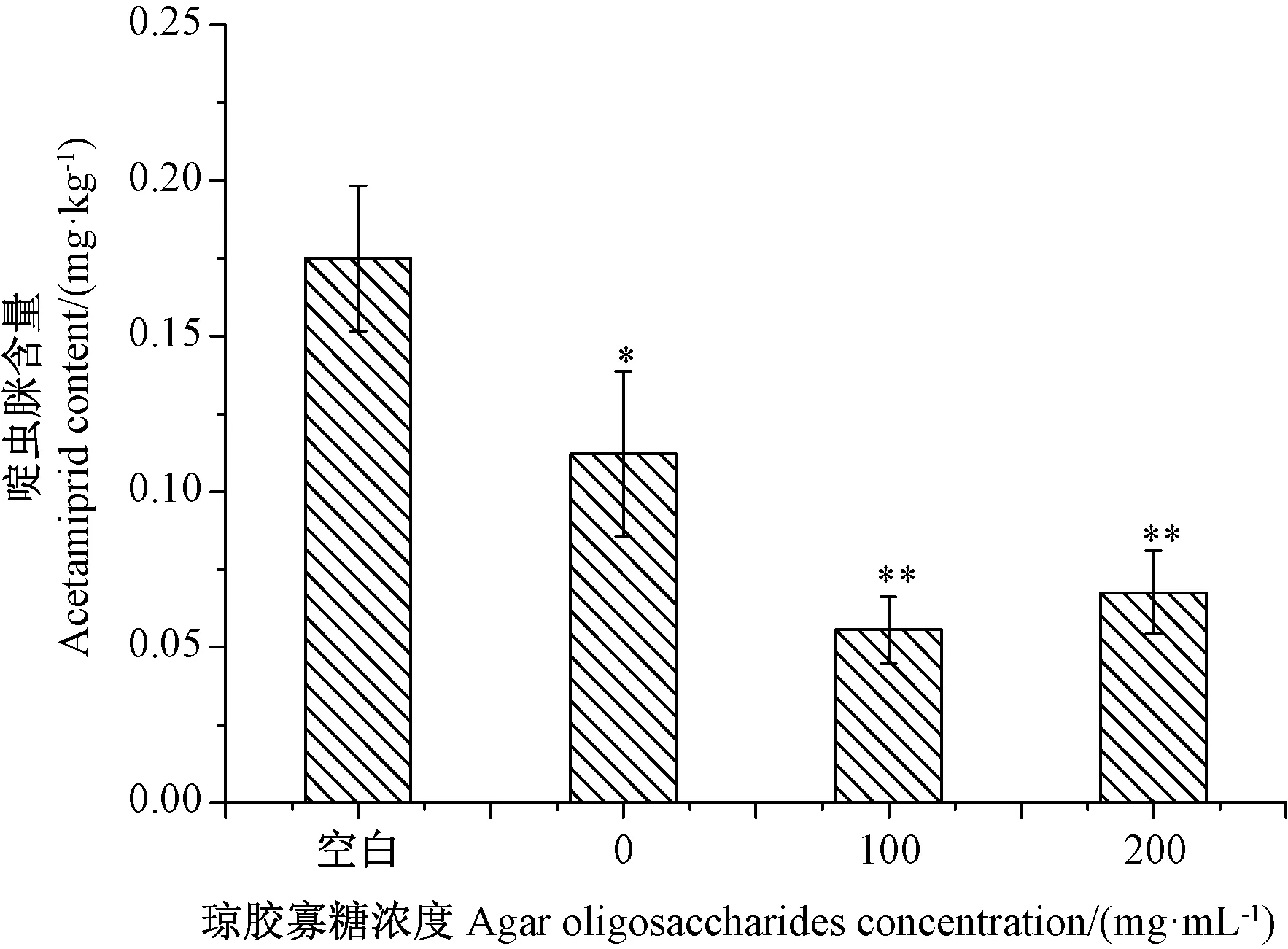
图5 不同浓度琼胶寡糖溶液处理下黄瓜浸果后的农药残留Fig.5 The pesticide residues of cucumbers after immersed with different concentrations of agar oligosaccharides solution
3 讨论
研究表明,寡糖作为一种信号分子[13]具有调控植物生长发育、植物激素和酚类化合物含量,刺激植物植保素积累,改变多种酶活性等作用[14-17]。不同结构的寡糖具有不同的作用与功能[18-20]。褐藻寡糖与壳寡糖在这方面的研究应用较多。据报道,褐藻寡糖与壳寡糖具有促进植物发育、抑制病原菌、缓解胁迫、提高植物抗病的能力[21-25]。但关于琼胶寡糖应用于农业的研究报道较少。
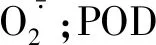
本研究还发现,琼胶寡糖能有效加速黄瓜中啶虫脒的降解速率,有效减少啶虫脒的残留量,能减少60%以上黄瓜农药的残留,缩短了安全间隔期。陈鹏等[32]研究发现,某些外源物质,如脯氨酸、氯化钙能够提高抗氧化酶(POD、CAT)活性,降低番茄叶片中农药残留量,这与本研究抗氧化酶活性提升,啶虫脒残留量减少结果相一致。而氧化型谷胱甘肽未能提高植株抗氧化酶活性及降低农药残留,认为农药的降解代谢与植物体内抗氧化酶反应之间存在一定联系。此外,本研究首次发现,采摘后的黄瓜经琼胶寡糖溶液浸泡后,农药残留也能够得到显著降低,这可能是因为寡糖作为激发子,激活了一系列酶促或非酶促反应,促进了啶虫脒降解为易溶于水的低毒产物[33],但具体的相关解毒途径仍有待进一步深入研究。
4 结论
本研究结果表明,琼胶寡糖能够促进黄瓜植株的生长、提高产量;并通过增加抗氧化酶活、降低MDA积累和诱导病程相关蛋白基因的表达来提高黄瓜的抗性。此外,喷施和浸泡琼胶寡糖都能够减少果实的农药残留。由此可见,琼胶寡糖可用于农业生产,具有一定的应用价值。

