玉米TRV-VIGS的优化与顶腐病抗病基因的鉴定
李聪聪 安晓晖 张中起 刘 康 孙 敬
(南京农业大学作物遗传与种质创新国家重点实验室,江苏 南京 210095)
玉米(Zeamays)是重要的粮食作物和饲料作物,也是重要的模式植物[1-3]。玉米基因组序列测序的完成以及玉米嵌套关联作图群体的开发[4],为玉米功能基因的研究和发掘利用奠定了基础。
病毒介导的基因沉默(virus-induced gene silencing, VIGS)是一种转录后基因沉默(post-transcriptional gene silencing, PTGS)。VIGS技术通过沉默目标基因,使植物产生沉默表型,从而判断目标基因的功能,无需遗传转化或创建突变体,具有快速、高效、高度特异性等优点,适用于植物的高通量功能基因组学研究[5-6]。目前已经发现30多种适用于双子叶植物的VIGS载体,而适用于单子叶植物的VIGS载体较少[7-8]。其中成功应用于玉米的VIGS载体仅有雀麦花叶病毒(Bromemosaicvirus,BMV)[9]、黄瓜花叶病毒(Cucumbermosaicvirus,CMV)[10]、狐尾草花叶病毒(Foxtailmosaicvirus,FoMV)[11-12]和烟草脆裂病毒(Tobaccorattlevirus,TRV)[13]等。采用BMV、CMV和FoMV病毒沉默载体时,通常需要采用体外转录合成RNA直接接种玉米,或者先接种烟草或其他中介宿主植物,从中提取组装好的病毒再接种玉米。一般需要采用摩擦接种法。但体外转录RNA产量低、成本高、易降解,摩擦接种程度不容易掌握,摩擦过度易损伤叶片,摩擦不够不易接种成功。有研究者采用摩擦接种法沉默八氢番茄红素脱氢酶(phytoene desaturase,PDS)基因,发现其只能引起玉米叶片局部条纹化、白化[9-12]。Zhang等[13]利用TRV载体,通过真空辅助农杆菌渗入及共培养的方法,无需RNA操作和接种,沉默PDS基因可使植株玉米整株白化,沉默效果更好、持续时间更长。然而,目前关于TRV-VIGS的沉默效率能否满足大规模功能基因筛选的需求,影响玉米TRV-VIGS沉默效率的因素,以及如何优化等方面的研究尚鲜见道。MAC(MOS4-associated complex)是以MAC3/PRP19为核心形成的一种蛋白质复合体,对植物免疫和抗病反应起重要调控作用[14-16],但在单子叶植物中的作用尚未见报道。
本研究利用TRV病毒载体,以玉米PDS基因为标记基因,分别从农杆菌菌株、玉米受体基因型、种子处理方法、真空渗入方法等因素进行优化。在此基础上,研究VIGS沉默MAC3的效率,接种亚粘团镰孢菌(Fusariumsubglutinans),分析沉默MAC3对玉米顶腐病抗性的影响[17],以期为TRV-VIGS体系应用于玉米基因功能鉴定、玉米顶腐病抗病基因筛选奠定基础。
1 材料与方法
1.1 试验材料
玉米品种郑单958种子由江苏省农业科学院提供,从中扩增PDS目的基因片段;先玉335种子由甘肃省张掖市现代农业示范基地提供,从中扩增MAC3目的基因片段;pTRV1、pTRV2载体、大肠杆菌DH5α及农杆菌GV3101、LB4404菌系均为南京农业大学作物遗传与种质创新国家重点实验室保存;限制性内切酶、rTaq、反转录酶均购自上海皓嘉科技有限公司;InvitrogenTMTRIzolTM购自美国ThermoFisher公司;半胱氨酸(Cys)购自南京伟沃生物科技公司;卡那霉素、利福平、乙酰丁香酮(actosyringone, AS)等均为国产分析纯。
1.2 试验方法
1.2.1 玉米PDS和MAC3基因片段的克隆及VIGS载体构建 按照Invitrogen Trizol 试剂盒说明书提取玉米叶片RNA,反转合成cDNA第一链。根据NCBI中公布的玉米PDS基因序列(GRMZM2G410515)和MAC3基因序列(GRMZM2G037698),参照文献[18]选择PDS的VIGS干扰靶标片段,利用在线网站(http://vigs.solgenomics.net/,参数设置为n-mer size:21;Fragment length:500;mismatches:0;Database:ZeamaysB73 v5a)设计MAC3的VIGS干扰靶标片段,分别在上下游引入XbaⅠ和BamHI酶切位点及保护碱基设计引物(ZmPDS-XbaI-F:5′-GCTCTAGACTAGCCAAGTTATTTCCTGA-3′,ZmPDS-BamHI-R:5′-CGGGATCCGGGACGGGAACTTCTCCTGA-3′;ZmMAC3-XbaI-F:5′-GCTCTAGAGCCGGTCAATACCAACAAGGTCGTGAA-3′,ZmMAC3-BamHI-R:5′-CGGGATCCCGCTTATGAAGGGGATGGCTGGAGATT-3′)。以玉米cDNA第一链为模板,PCR扩增ZmPDS和ZmMAC3基因片段。DNA凝胶回收试剂盒(南京诺百欣公司)回收纯化PCR产物,将目的基因片段克隆到pMD19-T载体并转化大肠杆菌。测序验证后再分别插入载体pTRV2中,获得重组VIGS载体pTRV2-ZmPDS和pTRV2-ZmMAC3,测序验证正确后保存备用。
1.2.2 农杆菌菌液的制备 将质粒pTRV1、pTRV2-ZmPDS、pTRV2-ZmMAC3分别转化农杆菌感受态细胞。分别挑取阳性农杆菌单菌落,接种至2 mL含有50 mg·mL-1卡那霉素(Kan)和50 mg·mL-1利福平(Rif)的YEB液体培养基中,28℃、220 r·min-1振荡培养12 h,菌液PCR检测正确后,再将菌液以1∶100的体积比转接至50 mL含50 mg·mL-1Kan和50 mg·mL-1Rif的YEB液体培养基中,28℃振荡培养至OD600=0.4左右,将各菌液的OD600值调整至一致。
将上述含pTRV1的农杆菌分别与含有pTRV2-ZmPDS、pTRV2-ZmMAC3的农杆菌菌液以1∶1体积比混合,在所得混合菌液中加入AS(19.62 mg·L-1)、Cys(400 mg·L-1)和Tween 20(5 mL·L-1),摇晃混匀后得到VIGS转化菌液备用[13]。
1.2.3 农杆菌真空渗入及共培养VIGS Zhang等[13]报道真空辅助农杆菌渗入TRV-VIGS方法包括真空渗入、种子-农杆菌共培养两个主要步骤。本研究在此基础上增加浸种环节,并对真空渗入时间、种子-农杆菌共培养时间等进行优化。具体方法如下:玉米种子用70%酒精浸泡1 min、2.5%次氯酸钠浸泡10 min、无菌水冲洗5次进行消毒。以不浸种为对照,分别设置加无菌水和VIGS转化菌液28℃浸种24 h 2个浸种处理;用手术刀片将上述处理的种子种皮划破放入组培瓶中,再加入40 mL VIGS转化菌液,使种子完全浸泡其中,真空辅助渗入20、40、60 min 3种处理;种子-农杆菌共培养时间设为10 h和15 h 2个处理(28℃,150 r·min-1)。以上处理所用农杆菌为GV3101、LB4 404 2种菌株。最后用无菌水将玉米种子冲洗干净,播于营养土中,温室(温度25℃,光周期为16 h光照/8 h黑暗)生长14 d后观察植株表型并对靶标基因的转录水平进行检测。以无菌水代替上述VIGS转化菌液为空白对照。
1.2.4 半定量RT-PCR检测 提取玉米叶片RNA,利用SYBR®Premix Ex TaqTMⅡ kit 反转录合成cDNA作为RT-PCR分析的模板。以玉米Actin(J01238,引物Actin-F:5′-CAATGGCACTGGAATGGT-3′;Actin-R:5′-ATCTTCAGGCGAAACACG-3′)作为内参基因,对不同样品模板进行均一化处理。然后利用ZmPDS基因特异引物(ZmPDS-RT-F:5′-AGGTCGTGGTTGCTGGTGC-3′;ZmPDS-RT-R:5′-ATTCTCCTGGCTTGTTTGG-3′)和ZmMAC3基因特异引物(ZmMAC3-RT-F:5′-AGAAGGAAAGAGATGAGG-3′;ZmMAC3-RT-R:5′-TGAGTGACCAGTAAGCGT-3′),对不同处理样品中的ZmPDS和ZmMAC3基因转录水平进行半定量RT-PCR分析。PCR反应程序:95℃预变性5 min;95℃变性30 s,54℃退火30 s,72℃延伸30 s,共28个循环;72℃终延伸10 min,4℃保存备用。
1.2.5 亚粘团镰孢菌接种及玉米顶腐病菌抗性鉴定 将亚粘团镰孢菌接种至固体马铃薯培养基,28℃培养至长满培养基后转移至液体马铃薯培养基中,振荡培养5~7 d,纱布过滤,滤液即为孢子悬浮液,用无菌水将孢子悬浮液浓度调节至1×107cfu·mL-1[19]。
将采用真空辅助VIGS农杆菌液处理的玉米种子播种,待其生长至第一片真叶即将展开时,将亚粘团镰孢菌孢子悬浮液浸泡玉米根部10 min,温室中继续生长7 d后,参照孟有儒等[19]的方法进行玉米顶腐病表型鉴定。以pTRV1/pTRV2-ZmPDS为VIGS阳性对照,pTRV1/pTRV2:00为ZmMAC3基因的VIGS阴性对照,分析pTRV1/pTRV2-ZmMAC3对玉米顶腐病抗性的影响。
2 结果与分析
2.1 玉米PDS、MAC3基因VIGS沉默载体的构建
提取玉米幼苗的叶片RNA,以反转录合成的cDNA为模板,分别获得大小为315 bp的ZmPDS目的片段和500 bp的ZmMAC3目的片段。克隆测序后,BLAST核酸序列比对结果与玉米B73 GRMZM2G410515和GRMZM2G037698的相似度分别为99%和100%,VIGS靶标基因序列同源性大于85%即可引起有效的基因沉默[20-21],因此,ZmPDS和ZmMAC3可应用于VIGS试验。将测序验证正确的VIGS靶标片段插入pTRV2载体中,经XbaⅠ与BamHI 双酶切验证后,分别转化农杆菌GV3101和LB4404感受态细胞,经菌液PCR验证后,保存备用(图1、图2)。
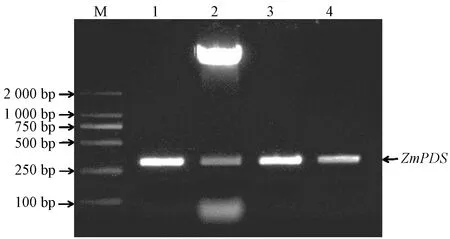
注:M:2 000 bp marker;1:ZmPDS靶标基因片段扩增;2:pTRV2-ZmPDS重组质粒酶切验证;3~4:农杆菌菌液PCR验证。Note:M:2 000 bp marker. 1:Amplification of ZmPDS gene fragments. 2:Double enzyme cutting validation of pTRV2-ZmPDS recombinant plasmid. 3-4:PCR validation of Agrobacterium bacteria.图1 玉米ZmPDS基因片段的扩增和VIGS沉默载体的酶切鉴定Fig.1 Amplification of ZmPDS gene of maize and identification of the VIGS silencing vector

注:M:5 000 bp marker;1:ZmMAC3靶标基因片段扩增;2:pTRV2-ZmMAC3重组质粒酶切验证;3~4:农杆菌菌液PCR验证。Note:M:5 000 bp marker. 1:Amplification of ZmMAC3 gene fragments. 2:Double enzyme cutting validation of pTRV2-ZmMAC3 recombinant plasmid. 3-4:PCR validation of Agrobacterium bacteria.图2 玉米ZmMAC3基因片段的扩增和VIGS沉默载体的酶切鉴定Fig.2 Amplification of ZmMAC3 gene of maize and identification of the VIGS silencing vector
2.2 玉米TRV-VIGS体系的优化
稳定、高效、高通量的VIGS体系,是将其应用于玉米抗病基因功能快速鉴定的基本条件。本研究首先完全遵照Zhang等[13]的方法,验证了应用该方法沉默玉米ZmPDS基因引起的白化表型的效率及其重复性,结果发现ZmPDS基因可以被沉默,并引起整株完全白化,但沉默白化植株的比例仅3%,效率较低,难以实际应用。因此,分别从浸种方法、农杆菌菌株筛选、真空渗入时间、共培养时间等因素对该体系进行优化。
2.2.1 浸种方式的筛选 Zhang等[13]将消毒处理后的玉米种子不经浸种直接进行农杆菌辅助真空渗入处理,观察发现干燥种子可能不利于农杆菌侵入,因此,本试验分别使用无菌水、VIGS农杆菌液浸泡玉米种子24 h。结果表明,不浸种处理,VIGS沉默玉米存活率为80.0%,基因沉默效率为3.0%;VIGS农杆菌和无菌水浸种处理,存活率分别降低为51.0%和54.0%,而ZmPDS基因沉默比率(白化率)分别上升至15.9%和28%,浸种处理明显提高了VIGS沉默效率,无菌水处理组的沉默效率最高,是不浸种的9倍以上(图3-A)。因此,无菌水浸种24 h,再接种农杆菌是最佳种子预处理条件。
2.2.2 农杆菌菌株的筛选 选用2种不同的农杆菌菌株GV3101和LB4404,分别进行真空渗入辅助农杆菌侵染无菌水浸种24 h后的玉米种子,结果表明,GV3101和LB4404处理的玉米幼苗存活率分别为53.8%、50.4%,不同农杆菌菌株对玉米幼苗存活率影响无明显差异(P>0.05),GB3101和LB4404处理的基因沉默效率分别为14.2%和29.3%,LB4404的基因沉默效率是GV3101的2倍以上(图3-B)。表明,选用农杆菌LB4404菌株可以获得更高的VIGS沉默效率。
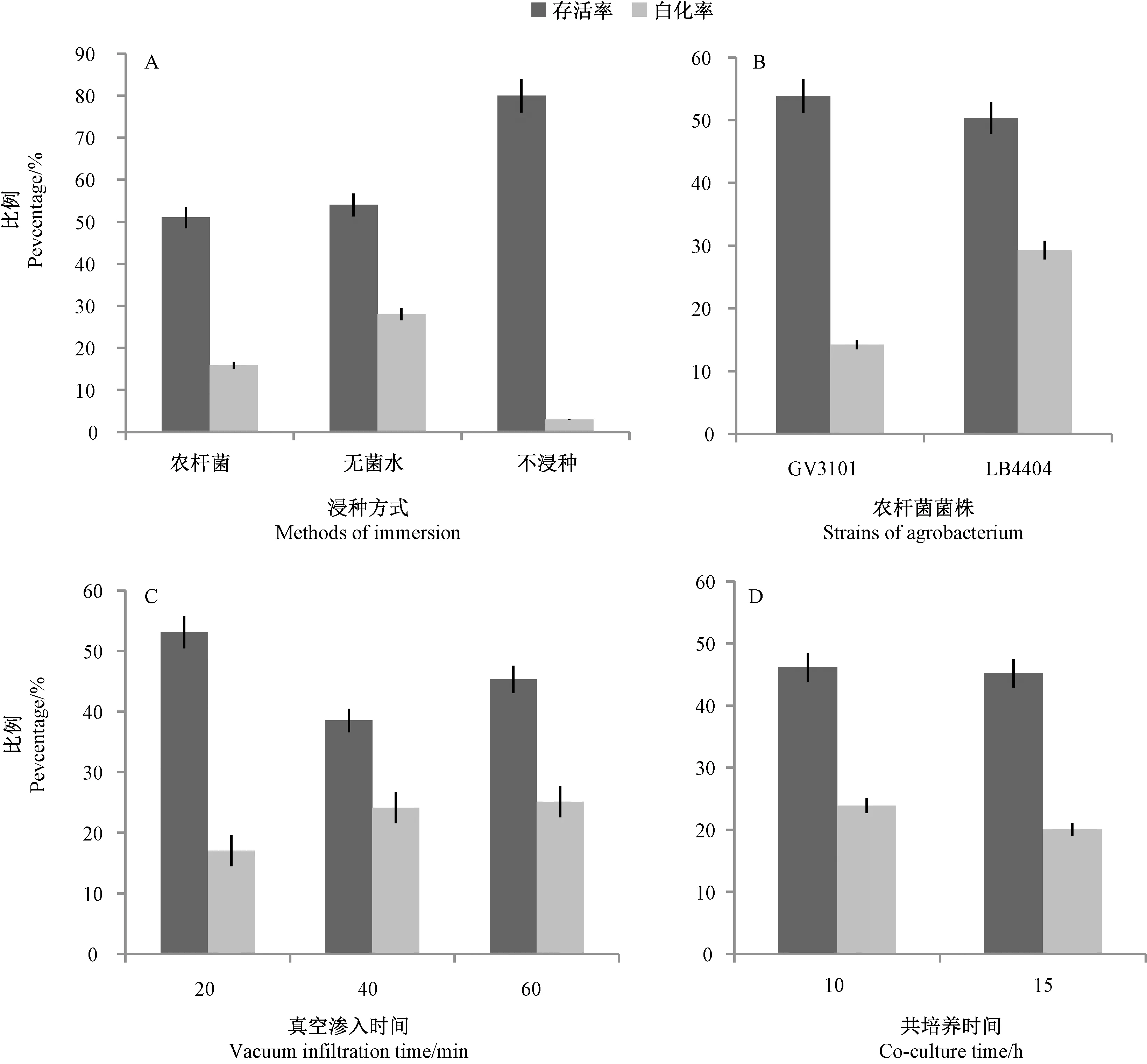
图3 玉米TRV-VIGS体系的优化Fig.3 Optimization of maize TRV-VIGS system
2.2.3 真空渗入时间的优化 Zhang等[13]使用20 mL注射器和10 mL医用玻璃瓶进行抽真空渗入60 s,结果发现真空处理时间短,农杆菌侵染可能不够充分,而且试验所用器具容量小,不利于大规模处理种子,因此,本试验改用真空干燥器,并对真空辅助农杆菌渗入时间进行优化,分别设置抽真空20、40、60 min 3个处理。结果表明,基因沉默效率随真空渗入时间的延长而增加,分别为17.0%、24.1%和25.1%;但幼苗存活率随着真空渗入时间延迟呈先降低后增加的趋势,当抽真空20 min处理时存活率最高,为54.0%;真空渗入60 min处理时,存活率达45.3%;农杆菌抽真空渗入60 min处理可以获得最高的基因沉默效率,同时维持较高的幼苗存活率(图3-C)。
2.2.4 农杆菌-玉米种子共培养时间的优化 研究表明,将农杆菌与玉米种子进行共培养,玉米的存活率和基因沉默效率均受共培养时间的显著影响,15 h时基因沉默效率较好[13]。本试验设置共培养时间为10 h和15 h 2个处理,结果表明,共培养时间对植株的存活率无明显影响,分别为46.2%和45.2%,植株的基因沉默效率随共培养时间延长而略有降低,分别为23.9%和20.1%(图3-D)。因此,10 h处理为最佳共培养时间。
综上,优化后的基于农杆菌介导的玉米TRV-VIGS体系,包括无菌水浸种24 h后,手术刀将种皮划破,真空辅助农杆菌LB4404菌液渗入处理玉米种子60 min后共培养10 h,洗净种子后播种,温室生长。
2.3 利用TRV-VIGS体系鉴定ZmMAC3基因在玉米顶腐病抗性中的作用

注:A:PTRV1/pTRV2:00对照植株;B:用含pTRV1/pTRV2-ZmPDS农杆菌侵染的植株;C:半定量RT-PCR分析ZmPDS基因的表达;D:接种顶腐病菌7 d后,pTRV2:00对照植株;E:接种顶腐病菌7 d后,含pTRV1/pTRV2-ZmMAC3农杆菌侵染的植株(左一、二:感病植株,右一、二:未感病植株);F:半定量RT-PCR分析ZmMAC3基因的表达。CK:无菌水处理植株;1和4:pTRV2:00侵染植株中ZmPDS和ZmMAC3基因的相对表达;2和3:pTRV2-ZmPDS沉默植株中ZmPDS基因的相对表达;5和6:感病植株中ZmMAC3基因的相对表达;7和8:未感病植株 中ZmMAC3基因的相对表达。Note: A: pTRV1/pTRV2:00 control plants. B: Plants treated with pTRV1/pTRV2-ZmPDS Agrobacterium tumefaciens. C: Semi-quantitative RT-PCR analysis of ZmPDS gene expression. D: pTRV2:00 control plants infected with the top rot pathogen for 7 d. E: Plants inoculated with pTRV1/pTRV2-ZmMAC3 after infected with the top rot pathogen for 7 d (left one and two: the diseased plants, right one and two: undiseased plants). F: Semi-quantitative RT-PCR analysis of ZmMAC3 gene expression. CK: Sterile water treated plants. 1 and 4: Plants infected with pTRV2:00 and the relative expression of ZmPDS and ZmMAC3. 2 and 3: Relative expression of ZmPDS gene in plants silenced by pTRV2-ZmPDS. 5 and 6: Relative expression of ZmMAC3 gene in susceptible plants. 7 and 8: Relative expression of ZmMAC3 gene in unaffected plants.图4 TRV介导的玉米VIGS体系及半定量RT-PCR检测Fig.4 TRV mediated VIGS system in maize and detection by semi-quantitative RT-PCR
MAC3是植物先天免疫和抗病信号通路中的关键因子,为了验证TRV-VIGS方法实际应用的可行性,同时初步分析ZmMAC3在玉米顶腐病抗性中的作用,利用优化的玉米TRV-VIGS体系,以抗顶腐病品种先玉335为研究材料,以接种pTRV1/pTRV2-ZmPDS农杆菌为VIGS对照、以接种pTRV1/pTRV2:00农杆菌进行VIGS沉默处理后接种亚粘团镰孢菌为对照,观察接种pTRV1/pTRV2-ZmMAC3农杆菌VIGS沉默处理再接种亚粘团镰孢菌后玉米顶腐病抗性表现。结果表明,接种VIGS处理14 d后,pTRV1/pTRV2:00农杆菌侵染种子的玉米幼苗未出现白化表型,叶片仍为绿色(图4-A);pTRV1/pTRV2-ZmPDS农杆菌侵染种子的玉米幼苗出现整株完全白化表型(图4-B);RT-PCR半定量分析结果表明,白化玉米植株中ZmPDS转录水平明显低于对照(图4-C),说明ZmPDS得到了有效沉默。pTRV1/pTRV2:00农杆菌侵染的植株,接种亚粘团镰孢菌后,玉米幼苗正常生长,没有明显病症表现(图4-D),表明先玉335对顶腐病具有较强的抗性;而VIGS沉默ZmMAC3的先玉335接种亚粘团镰孢菌后部分幼苗表现出生长缓慢,植株矮小,叶尖变黄干枯,顶端叶片或心叶卷曲缠绕等典型的玉米顶腐病症状(图4-E);半定量RT-PCR检测结果表明,VIGS沉默处理的植株中表现典型顶腐病病症的个体的ZmMAC3转录水平均较低,而未表现病症的单株ZmMAC3转录水平接近正常对照水平(图4-F)。表明ZmMAC3是玉米顶腐病抗性所必需的重要基因。将单株表型鉴定与沉默基因RNA水平的定量或半定量分析相结合,可以应用于玉米功能基因的VIGS分析鉴定。
3 讨论
目前已有40多种病毒被改造为VIGS载体,其中约37种可以应用于双子叶植物基因沉默[7-8],而适用于单子叶植物的VIGS载体却仅有几个。BSMV、BMV是目前广泛应用于禾谷类植物基因功能的VIGS工具,但它们的接种方式高度依赖于基因枪[22]、体外转录摩擦接种[21, 23-24]或在本氏烟草这样的中介宿主植物预接种[25]。据报道BMV[24]、CMV、ZMBJ-CMV[10]、FoMV[11-12]已成功应用于玉米VIGS,但是沉默ZmPDS基因只能导致部分白化症状,说明玉米这些VIGS体系可能不能作用于整株水平,持续时间短。虽然有利用BMV载体通过农杆菌真空渗入法成功沉默水稻基因的报道,但是未见应用报道。TRV应用于VIGS试验具有接种简便、无需RNA操作、试验周期短等优点,已在番茄[26]、烟草[27]、拟南芥[28]、麻风树、矮牵牛[29]、棉花[30]等双子叶植物上成功应用,但极少应用于单子叶植物。最近,Zhang等[13]通过农杆菌真空渗入与共培养相结合将TRV-VIGS体系成功应用于小麦和玉米基因的沉默,克服了BMV、CMV、FoMV、BSMV等介导的VIGS的缺点,可在整株植物水平上起作用。此外,该方法通过种子处理,由农杆菌介导,还可以克服传统的TRV-VIGS采用的叶片接种农杆菌难以完全抑制整个植物水平的基因转录消减,以及难以通过VIGS沉默研究注射叶片以下(根、下胚轴等)组织以及植物早期发育的基因功能等不足。但是Zhang等[13]报道的方法,只适用于处理少数几粒种子,而在本试验条件下,沉默ZmPDS的比例仅3.0%,很难实际应用。因此,本试验从浸种处理、农杆菌菌株、真空渗入时间、共培养时间等试验条件因素进行了优化,优化后的玉米TRV-VIGS体系无论沉默ZmPDS导致植株出现光漂白症状的比率,还是沉默ZmMAC3后接种亚粘团镰孢菌而引起抗顶腐病玉米品种先玉335感染发病的比例均稳定在25%以上,而且表现光漂白或感病症状的植株其对应植株中的ZmPDS或ZmMAC3的转录水平均明显降低,而不表现沉默症状的单株对应的ZmPDS或ZmMAC3的转录水平都无明显变化,基因的转录水平与症状之间出现高度相关性。因此,将单株表型鉴定与VIGS沉默基因的转录水平分析相结合,可以应用于玉米基因功能的鉴定。
TRV-VIGS体系的沉默效率取决于病毒的繁殖传播与植物生长之间的动态互作[31]。TRV通过农杆菌介导进入玉米细胞,表达TRV病毒,因此影响农杆菌侵入玉米组织的试验条件因素可能起决定性作用。本研究也证实了这一观点,即农杆菌菌株、浸种方法、真空渗入时间和共培养时间均对VIGS效率产生了不同程度的影响。真空辅助农杆菌渗入法能够增加植物遗传转化效率,尤其适用于对真空渗入具有高抗性的植物[32]。玉米种子能够承受长时间真空渗透,本研究中真空渗入时间长达60 min,虽然育种种子存活率下降,但基因沉默效率最佳。干燥的种子不利于农杆菌侵染,所以本试验采用了无菌水和农杆菌浸种的方法,先浸种,再进行真空渗透,VIGS沉默效率大幅度提高,是改良的玉米TRV-VIGS体系最关键的步骤。将玉米种子与农杆菌共培养适当时间,可以增加受侵染植物细胞的比例,提高VIGS基因沉默效率,但共培养时间过长时VIGS的效率反而降低,这是否是由于农杆菌过度老化,活性下降,导致沉默效率降低还有待进一步研究。此外,本试验发现LB4404对玉米基因沉默的效率较高,可能与植物对不同农杆菌菌株具有不同的敏感性有关[33-34],而容易侵染的玉米受体则有利于病毒RNA的转录,从而提高VIGS沉默效率。但本研究所使用的受体玉米品种和农杆菌菌株种类有限,下一步可扩大受体玉米品种的筛选范围和农杆菌菌株种类以提高VIGS有效沉默效率。本研究中,优化后的TRV-VIGS体系的沉默效率最高也只有29.3%,虽然结合单株目标基因转录水平检测可以鉴定基因的功能,但是70%以上没有沉默的植株可能会给沉默基因的表型鉴定带来困扰,同时,转录水平分析的工作量较大。因此,需要进一步改良。pTRV1和pTRV2都是使用两个串联35S启动子启动TRV和插入靶标基因部分序列的RNA转录;35S启动子在单子叶植物中是一种较弱的启动子,因而也可能影响VIGS效率;pUbi启动子在玉米中的启动效率是35S的10倍以上,以pUbi取代35S启动子也有可能大幅度提高TRV-VIGS在单子叶植物中的效率[35]。
MAC是植物剪接体中的起活化和调控作用的重要组分,对于RNA剪接和miRNA合成等具有重要调控作用。拟南芥突变体mac3a和mac3b以及VIGS沉默棉花GhMAC3都能导致植物免疫或抗病能力显著下降,但是它们在单子叶植物中免疫和抗病作用尚未见报道。先玉335高抗玉米顶腐病。本研究利用优化的TRV-VIGS技术沉默玉米中同源基因mMAC3,发现ZmMAC3沉默后的植株对亚粘团镰孢菌高度敏感,表现出叶尖变黄干枯,顶端叶片或心叶卷曲缠绕等典型的玉米顶腐病症状,优化后的玉米TRV-VIGS体系可以实际应用于玉米苗期抗病基因的功能分析。表明,MAC和MAC3在单子叶植物免疫和抗病反应中可能同样起关键作用,这为进一步研究玉米MAC参与的免疫分子机制提供了一定的理论参考。
4 结论
本研究从浸种处理、农杆菌菌株、真空渗入时间、共培养时间4个试验因素对玉米TRV-VIGS体系进行优化,得到高效、稳定的VIGS体系,包括无菌水浸泡种子24 h后,剥去胚部种皮,LB4404农杆菌菌株真空渗入处理60 min,再共培养10 h。应用该体系,成功抑制了玉米ZmMAC3基因表达,与对照相比,ZmMAC3抑制表达的玉米植株接顶腐病菌后,更易感病。优化的玉米TRV-VIGS体系具体快速、高效、可使植株整株沉默等特点。本研究结果为玉米重要基因鉴定和功能分析的研究奠定了一定的理论基础。

