程序化细胞死亡因子5对肿瘤坏死因子-α诱导大鼠关节软骨细胞损伤的影响
华植 韦嵩 陈志煌 李晓昊 张娴娴 侯春福 刘颖琬 李慧
(1解放军南部战区总医院中医科,广东 广州 510010;2广州中医药大学)
骨性关节炎又称为肥大性关节炎、退行性关节炎等,是生物学因素或者力学因素刺激引起软骨细胞、软骨下骨、软骨细胞外基质的失衡,膝骨性关节炎患者以关节肿胀、功能障碍、关节僵硬等为临床表现,严重者甚至表现为关节畸形等〔1,2〕。关节软骨细胞损伤、凋亡增多是骨性关节炎发生的重要原因。程序化细胞死亡因子(PDCD)5是一种凋亡相关基因,在进化过程中高度保守,其可以促进肿瘤细胞等多种细胞的凋亡〔3,4〕。研究表明,PDCD5在关节炎软骨组织中表达水平异常升高,可能参与软骨细胞凋亡过程〔5,6〕。本实验分离培养关节软骨细胞,用肿瘤坏死因子(TNF)-α处理体外构建关节炎软骨细胞模型,探讨PDCD5对骨关节炎软骨细胞损伤的影响。
1 材料与方法
1.1主要材料 SD大鼠购自广州中医药大学实验动物中心;SYBR Prime Script实时聚合酶链反应(PCR)试剂盒购自大连Takara;Ⅱ型胶原酶购自美国Sigma;TNF-α购自武汉亚法生物技术公司;PDCD5 siRNA慢病毒、siRNA control慢病毒由吉满生物科技(上海)有限公司构建;实验所用引物均由上海生工合成;超氧化物歧化酶(SOD)活性测定试剂盒、一氧化氮(NO)合酶(NOS)活性测定试剂盒购自上海碧云天;PDCD5抗体购自天津saierbio;剪切型Caspase(Cleaved Caspase)-3、-9抗体购自美国CST。
1.2关节软骨细胞分离培养 步骤同文献〔7〕,取10只SD大鼠(清洁级,雌性各半),脱颈处死以后,置于75%的乙醇中浸泡消毒5 min。在无菌条件下取出膝关节,转移到平皿中,用生理盐水将膝关节洗涤后,把周围附着的肌肉、骨膜、肌肉等组织去除,将关节表面的软骨用刀片削取下来,以磷酸盐缓冲液(PBS)漂洗3次,将软骨剪碎成≤1 mm3的组织块,转移到锥形瓶内。添加5 ml的0.2%的Ⅱ型胶原酶,放在37℃的水浴锅中消化120 min。用200目尼龙网过滤以后,3 300 r/min离心5 min,收集细胞沉淀,加入10%胎牛血清的杜尔伯科改良伊格尔培养基(DMEM)。再用0.2%的Ⅱ型胶原酶消化2次上述组织块,将收集的细胞混合,调整细胞浓度为1×105个/ml,种植到25 cm2的细胞培养瓶内,每个培养瓶内加入5 ml的细胞悬浮液,培养条件为37℃,5% CO2培养箱。细胞融合度为80%时,用0.25%的胰蛋白酶消化,制成细胞悬浮液,种植到培养皿中贴壁10 min,成纤维细胞贴壁速度高于关节软骨细胞,收集没有贴壁的细胞及培养液,种植到细胞培养瓶内。用阿里新蓝染色法和Ⅱ型胶原免疫组化法鉴定分离的细胞为关节软骨细胞。
1.3细胞分组处理 取第3代关节软骨细胞,分为Control组、TNF-α组、siRNA control+TNF-α组、PDCD5 siRNA+TNF-α组,处理方法为:Control组,关节软骨细胞不做任何处理;TNF-α组,在实验0 h时,在细胞培养液中加入20 ng/ml的TNF-α;siRNA control+TNF-α组,实验开始前关节软骨细胞稳定感染siRNA control慢病毒,在实验0 h时,细胞培养液中加入20 ng/ml的TNF-α;PDCD5 siRNA+TNF-α组,实验开始前关节软骨细胞稳定感染PDCD5 siRNA慢病毒,在实验0 h时,在细胞培养液中加入20 ng/ml的TNF-α。各组细胞在培养24 h以后,做后续实验检测。慢病毒感染步骤如下:关节软骨细胞在感染前1 d,以每个孔中加入2 000个细胞种植到96孔板内,培养24 h以后,对细胞进行换液,以感染复数(MO)=30加入病毒液,培养3 d以后,荧光显微镜下观察细胞感染效率高于90%。首先用实时PCR和Western印迹方法测定Control组、TNF-α组细胞中PDCD5表达水平,再用同样的方法测定TNF-α组、siRNA control+TNF-α组、PDCD5 siRNA+TNF-α组细胞中PDCD5表达水平。
1.4实时PCR测定细胞中PDCD5表达 收集细胞,用PBS将细胞洗涤以后,用TRIZOL法常规提取细胞中的总RNA,RNA溶解于焦碳酸二乙酯(DEPC)水中。吸取1 μg的RNA,用M-MLV反转录酶反转录合成cDNA,引物为OligodT。以SYBR Prime Script实时PCR试剂盒对PDCD5基因进行定量,内参为β-actin。β-actin引物序列,正义5'-AGAGGGAAATCGTGCGTG-3',反义5'-CCATACCCAGGAAGGAAGGCT-3'。PDCD5引物序列,正义5'-GTGATGCGGCCCAACAG-3',反义5'-ATCCAGAACTTGGGCTAAGATACTG-3'。
1.5Western印迹测定细胞中PDCD5表达 收集细胞,把培养液上清弃掉,添加放射免疫沉淀(RIPA)裂解液,放在冰上裂解20 min后,用细胞刮刀将细胞收集以后,12 000 r/min离心10 min,吸取上清溶液,保存至-80℃,同时留取10 μl的蛋白溶液用于聚氰基丙烯酸正丁酯(BCA)蛋白定量,具体步骤同试剂盒说明书。用12%的分离胶和5%的浓缩胶进行电泳,每个孔中加入40 μg的蛋白,浓缩胶中以80 V的电压电泳,分离胶中用100 V电压电泳。把聚偏氟乙烯(PVDF)膜放在无水乙醇中浸泡10 min以后,再转移到转膜缓冲液中浸泡15 min。转膜电压用100 V,转膜置于冰上进行。取出PVDF膜后,浸泡于含有5%牛血清白蛋白的Tween-20 Tris-盐酸溶液(TBST)中,于室温条件下孵育2 h。再把PVDF膜依次与1∶600稀释的PDCD5抗体、辣根过氧化物标记的二抗在室温中孵育2 h以后,电化学发光(ECL)试剂盒发光,凝胶成像仪成像以后,分析目的蛋白灰度值同内参β-actin灰度值的比值。
1.6噻唑蓝(MTT)测定细胞增殖 将稳定感染后的关节软骨细胞种植到96孔细胞培养板内,按照上述分组方法处理细胞,孵育24 h以后,在每个孔中加入20 μl的MTT,继续孵育4 h以后,把上清液吸除掉,加入150 μl的二甲基亚砜(DMSO)将结晶溶解,测定每个孔490 nm的A值。
1.7流式细胞术测定细胞凋亡 Control组、TNF-α组、siRNA control+TNF-α组、PDCD5 siRNA+TNF-α组细胞按照上述方法处理培养24 h以后,用0.25%的胰蛋白酶消化并收集细胞,用4℃的PBS将细胞悬浮以后,3 300 r/min离心10 min,将上清吸除。加入结合缓冲液,使每毫升的悬浮液中含有106个细胞,吸取100 μl的细胞悬液,转移到流式管中,加入5 μl的碘化丙啶(PI)和Annexin V-异硫氰酸荧光素(FITC)混匀以后,在室温中孵育15 min,再添加400 μl的PBS,检测凋亡情况。
1.8Western印迹测定细胞中Cleaved Caspase-3、-9蛋白水平 Control组、TNF-α组、siRNA control+TNF-α组、PDCD5 siRNA+TNF-α组细胞按照上述方法处理培养24 h以后,检测各组细胞中Cleaved Caspase-3、-9蛋白水平,步骤同上。
1.9细胞中 SOD、NOS活性检测 Control组、TNF-α组、siRNA control+TNF-α组、PDCD5 siRNA+TNF-α组细胞按照上述方法处理培养24 h以后,收集细胞,检测细胞中SOD、NOS活性,步骤同试剂盒。
1.10统计学分析 采用SPSS21.0软件进行t检验和单因素方差分析。
2 结 果
2.1TNF-α作用后关节软骨细胞中PDCD5的表达 TNF-α组关节软骨细胞中PDCD5 mRNA (2.14±0.21)和蛋白表达水平(0.65±0.06)显著高于Control组(1.00±0.00、0.20±0.03)(P<0.05)。见图1。TNF-α诱导关节软骨细胞中PDCD5的表达。
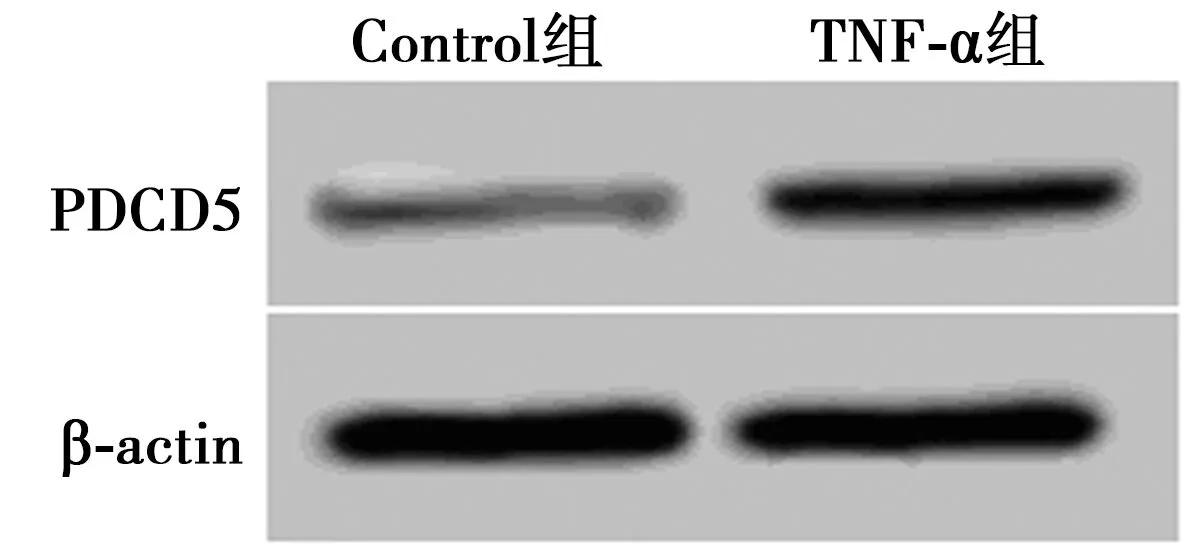
图1 Western印迹测定TNF-α对关节软骨细胞中PDCD5表达的影响
2.2慢病毒感染下调TNF-α条件下关节软骨细胞中PDCD5的表达 PDCD5 siRNA+TNF-α组关节软骨细胞中PDCD5 mRNA(0.35±0.06)和蛋白表达水平(0.18±0.06)显著低于TNF-α组(1.00±0.00、0.76±0.09)(P<0.05)。siRNA control+TNF-α组关节软骨细胞中PDCD5 mRNA(0.98±0.14)和蛋白表达水平(0.78±0.10)与TNF-α组比较无明显差异(P>0.05)。见图2。
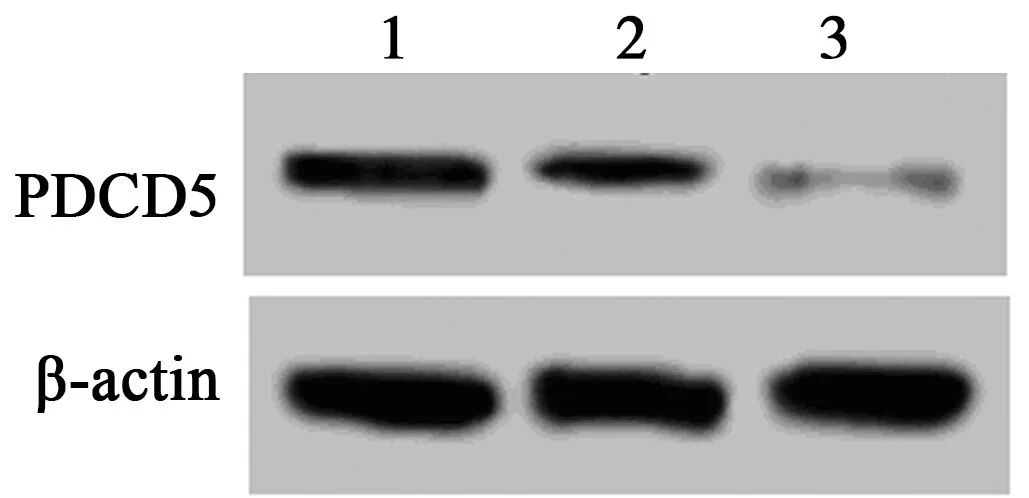
1~3:TNF-α组;siRNA control+TNF-α组;PDCD5 siRNA+TNF-α组图2 Western印迹测定慢病毒感染后经TNF-α诱导后关节软骨细胞中PDCD4表达
2.3下调PDCD5提高TNF-α条件下关节软骨细胞增殖能力 TNF-α组关节软骨细胞A值(0.50±0.04)显著低于Control组(0.75±0.06)(P<0.05)。PDCD5 siRNA+TNF-α组关节软骨细胞A值(0.64±0.03)显著高于TNF-α组(P<0.05)。siRNA control+TNF-α组关节软骨细胞A值(0.49±0.06)与TNF-α组比较无明显差异(P>0.05)。下调PDCD5可以逆转TNF-α对骨关节软骨细胞增殖抑制作用。
2.4下调PDCD5减少TNF-α条件下关节软骨细胞凋亡 TNF-α组关节软骨细胞凋亡率及Cleaved Caspase-3、-9蛋白水平显著高于Control组(P<0.05)。PDCD5 siRNA+TNF-α组关节软骨细胞凋亡率及Cleaved Caspase-3、-9蛋白水平显著低于TNF-α组(P<0.05)。siRNA control+TNF-α组关节软骨细胞凋亡率及Cleaved Caspase-3、-9蛋白水平与TNF-α组比较无明显差异(P>0.05)。下调PDCD5可以逆转TNF-α对骨关节软骨细胞凋亡诱导作用。见图3、表1和图4。
2.5下调PDCD5对TNF-α处理后关节软骨细胞中SOD、NOS水平影响 TNF-α组关节软骨细胞SOD活性低于Control组,NOS活性高于Control组,差异有统计学意义(P<0.05)。PDCD5 siRNA+TNF-α组关节软骨细胞SOD活性高于TNF-α组,NOS活性低于TNF-α组,差异有统计学意义(P<0.05)。siRNA control+TNF-α组关节软骨细胞SOD、NOS活性与TNF-α组比较无明显差异(P>0.05)。见表1。下调PDCD5可以逆转TNF-α对骨关节软骨细胞中SOD、NOS活性影响。
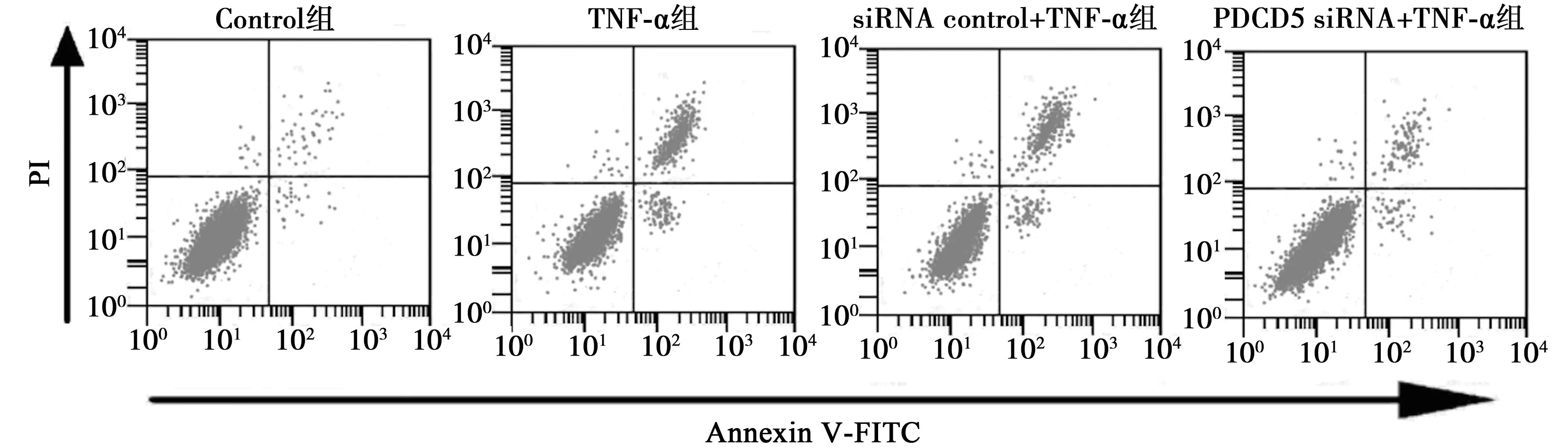
图3 流式细胞术测定各组关节软骨细胞凋亡

表1 沉默PDCD5经TNF-α处理的关节软骨细胞凋亡及细胞中Cleaved Caspase-3、-9蛋白水平、SOD、NOS活性
与Control组比较:1)P<0.05;与TNF-α组比较:2)P<0.05
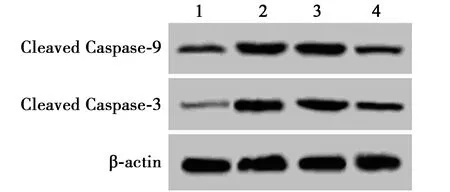
1~4:Control组;TNF-α组;siRNA control+TNF-α组;PDCD5 siRNA+TNF-α组图4 Western印迹检测关节软骨细胞中Cleaved Caspase-3、-9蛋白水平
3 讨 论
骨关节炎发病原因和机制尚未完全阐明,其中软骨退变是发病的重要原因,也是启动病理性骨性关节炎进程的因素之一,软骨细胞和软骨基质共同构成了关节软骨,在关节炎的早期,关节软骨具有自我修复能力,而在关节炎后期,炎症诱导的损伤逐渐表现出来〔8~10〕。研究表明,软骨细胞的增殖可以抑制软骨降解,而软骨细胞凋亡在软骨破坏中具有重要作用,其可以诱导关节软骨退行性病理变化的发生〔11,12〕。正常状态下的软骨细胞凋亡是软骨组织内环境稳定的基础,其不仅可以维持软骨形态,还参与软骨组织功能发挥,当软骨细胞凋亡水平超过一定的范畴之后,会引发软骨细胞急剧减少,导致软骨基质减少,引起关节软骨退变〔13〕。Caspase-9是Caspase凋亡反应的上游启动因子,其活化后可以激活凋亡执行因子Caspase-3的活化,诱导细胞凋亡发生〔14,15〕。本研究表明,TNF-α可以诱导关节软骨细胞凋亡,抑制细胞增殖活性,同时可以上调细胞中Caspase-3、-9活化水平,提示TNF-α可以促进Caspase-3、-9介导的关节软骨细胞凋亡,诱导关节软骨细胞损伤。
正常软骨细胞凋亡主要发生于表层,而关节炎患者移行层和辐射层软骨细胞凋亡也明显增多,在关节炎患者的关节滑液中发现NO含量升高,NO可以在体外诱导软骨细胞凋亡〔16〕。有研究表明,关节炎发生时,炎性细胞因子可以诱导细胞内NOS活性升高,合成大量NO,而过量NO能够对细胞产生毒性作用〔17〕。除了NO合成水平与软骨细胞凋亡有关之外,氧自由基过多也可以诱导软骨细胞凋亡,SOD是氧自由基清除剂,其活性升高可以降低细胞内氧自由基水平,减少细胞凋亡〔18,19〕。本实验结果提示,TNF-α通过影响细胞内抗氧化酶活性和NOS活性诱导细胞凋亡。
PDCD5基因编码的蛋白含有一个带电残基,其含有6个外显子和5个内含子,其中外显子6是促进细胞凋亡的活性功能结构域,其在多种组织和细胞中均有表达,参与肿瘤、关节炎、多囊卵巢综合征、肾炎等疾病的发生,PDCD5表达水平升高可以通过Caspase级联反应诱导细胞凋亡〔5,20~23〕。PDCD5参与类风湿关节炎成纤维样滑膜细胞凋亡过程,在关节炎软骨组织中高表达〔24,25〕。本实验结果表明,TNF-α诱导关节软骨细胞中PDCD5的表达,沉默PDCD5可以逆转TNF-α诱导的关节软骨细胞凋亡,提高细胞中SOD活性,降低NOS活性。
综上,沉默PDCD5可能通过调控细胞内氧自由基和NO合成水平影响骨关节炎软骨细胞损伤,这为明确PDCD5在关节炎软骨退行性病变发生中的作用奠定了基础。

