外源油菜素内酯缓解水稻穗分化期高温伤害的机理研究
陈燕华 王亚梁朱德峰 石庆华 陈惠哲 向镜 张义凯 张玉屏,*
外源油菜素内酯缓解水稻穗分化期高温伤害的机理研究
陈燕华1,3王亚梁1, 2, *朱德峰1石庆华2陈惠哲1向镜1张义凯1张玉屏1,*
(1中国水稻研究所 水稻生物学国家重点实验室, 杭州 310006;2江西农业大学 农学院, 南昌 330045;3湖南农业大学 农学院, 长沙410218;*通讯联系人, E-mail: wangyl0103@126.com; cnrrizyp@163.com)
明确水稻穗分化期高温下喷施2,4-表油菜素内酯(2,4-epibrassinolide, EBR)对穗生长及颖花形成的影响,并探究其生理机制。以热敏感型水稻IR36为材料,在幼穗分化期设置40℃高温和32℃适温两个处理,并喷施EBR,研究幼穗碳水化合物供应、蔗糖代谢、细胞分裂素代谢及抗氧化能力的变化。1)高温和适温喷施EBR,水稻每穗粒数分别比不喷施的对照增加13.7% 和45.7%,其中以喷施0.15 mg/L效果最好,缓解了高温对水稻幼穗生长的抑制,增加颖花分化数和降低颖花退化率。2)喷施EBR对叶片净光合速率无显著影响,但促进幼穗中干物质和非结构性碳水化合物积累。EBR喷施增加高温下幼穗中蔗糖转运基因、和的表达,并显著提高蔗糖代谢相关酶活性,EBR对高温下碳水化合物利用的促进作用大于适温处理。3)喷施EBR降低高温下细胞分裂素氧化酶基因和的表达量,同时促进细胞分裂素合成和信号调节相关基因的表达,并在适温下也表现出类似的效应。4)喷施EBR降低高温下超氧阴离子含量,增强了超氧化物歧化酶、过氧化氢酶和过氧化物酶活性。高温下,喷施适宜浓度的EBR促进碳水化合物向幼穗的转运,抑制细胞分裂素分解,同时降低高温引起的过氧化伤害,进而缓解了高温对颖花形成的伤害。适温条件喷施EBR也对颖花形成具有一定的促进作用。
水稻;高温;颖花形成;2,4-表油菜素内酯;生理机制
穗发育期是水稻最重要的生长时期,此期的气象条件对水稻产量形成有重要影响。籼稻穗发育最适温度为33.1℃左右,而粳稻是26℃~27℃[1]。近年来,我国长江中下游单季稻时常出现花期热害,导致颖花败育而造成水稻产量损失,为此,一些地区通过推迟水稻播期避开抽穗期高温天气。然而,播期推迟却使高温与水稻穗分化期相遇,导致水稻穗发育和颖花形成受阻而影响每穗粒数[2,3]。
碳水化合物是水稻幼穗发育和颖花形成的基本物质,干物质积累与颖花分化呈显著正相关[4]。碳水化合物来源于叶片光合作用,其转运是幼穗碳水化合物积累的基础。前人研究发现,灌浆结实期高温导致同化物积累不足和碳水化合物运输受阻,从而抑制籽粒充实[5-6]。水稻碳水化合物转运以蔗糖为主,灌浆结实期高温抑制蔗糖转运蛋白基因、、等的表达,同化物向籽粒供应减弱[7,8]。另一方面,幼穗发育也受激素的调控,特别是与细胞分裂素的代谢密切相关[9]。Wu等[2,10]研究表明高温下幼穗中激素代谢紊乱,特别是细胞分裂素含量显著降低,从而抑制颖花形成。
油菜素内酯是重要的植物内源激素之一,与穗发育及籽粒充实都有密切的关系,且在抵抗逆境胁迫上有较好效果[11]。研究表明,喷施2,4-表油菜素内酯可以提高植物叶片净光合速率,并增加可溶性糖的积累[12-13],同时影响其他内源激素代谢[14]。目前,随着气候变化的加剧,单季稻幼穗发育受高温胁迫影响的几率增加,施用2,4-油菜素内酯是否可以缓解高温对穗发育的影响并不清楚。为此,本研究利用人工气候箱模拟高温处理,通过外源喷施 2,4-表油菜素内酯(2,4-epibrassinolide, EBR),明确喷施EBR对穗发育的影响,并从碳水化合物转运利用、细胞分裂素代谢及抗氧化能力三个方面研究其机理,为缓解水稻幼穗生长发育的高温伤害提供理论与技术支撑。
1 材料与方法
1.1 供试品种及其种植方法
在2017年的预备试验基础上,试验于2018年在中国水稻研究所人工气候箱群试验场进行。选择热敏感型常规籼稻品种IR36为试验材料。于5月20日播种,大棚基质育秧,6月10日选生长一致的秧苗移栽到塑料盆(24 cm×22.5 cm×21.5 cm,每盆装过筛土10 kg),每盆4穴,每穴两苗。每盆施复合肥(氮磷钾比例为1∶1∶1)4.0 g作基肥,移栽活棵后施尿素0.5 g作为分蘖肥,穗分化始期施复合肥2.25 g作为穗肥。其余管理措施同高产栽培法。
1.2 高温处理
试验分高温(HT, 40℃)和适温(32℃, NT)两个温度处理。高温处理和适温处理均利用人工气候箱进行,所用人工气候箱四周采用超白钢化玻璃,光照不足时利用人工光源补光,维持人工气候箱光照辐射强度在50 000 lx左右。人工气候箱温度根据夏季高温天气温度变化规律设置,高温处理6:30−9:30为35℃,9:31−17:30为40℃,17:31−22:30为35.0℃,22:31−次日6:30为33.0℃,日平均温度为36.0℃。适温处理6:30−9:30为27℃,9:31−17:30为32℃,17:31−22:30为27.0℃,22:31−次日6:29为25.0℃,日平均温度为25.9℃。处理期间,人工气候湿度维持在70%~80%。
剥穗观察水稻植株穗分化情况,在幼穗0.2~0.5 cm时进行处理,处理期间保持盆栽有2~3 cm的水层,处理时间为15 d。在高温和适温处理前1天和处理第7天每盆均匀喷施不同浓度的2,4-表油菜素内酯(2,4-epibrassinolide, EBR)进行处理(浓度分别为0 mg/L、0.05 mg/L、0.10 mg/L、0.15 mg/L、0.30 mg/L、0.50 mg/L)。除0.15 mg/L处理外, 5盆为一个处理,3次重复。处理结束后,将盆钵移出人工气候箱,放回自然条件下生长。2017年的预备试验结果显示,0.15 mg/L EBR处理对颖花形成的促进效应最好,为此根据浓度进行机理研究,试验每处理设置30盆,3次重复。
1.3 测定项目与方法
1.3.1 单株产量及产量结构
在水稻成熟期,每重复取5盆植株进行考种,考查单株穗数、每穗粒数、结实率、千粒重和单株产量。
1.3.2 主茎颖花分化与退化
预备试验明确EBR喷施浓度为0.15 mg/L时效果最好。为保持温度影响的一致性,选取NT、NT+0.15 mg/LEBR、HT、HT+0.15 mg/LEBR 4个处理的水稻新鲜主茎,采用松岛省三痕迹法[15],考查颖花分化与退化情况,穗抽出1/2时取样,每重复考查10个主茎。
1.3.3 叶片净光合速率
选取NT,NT+0.15 mg/LEBR,HT,HT+0.15 mg/LEBR 4个处理的水稻新鲜主茎,在处理的第7天和第15天利用Li-6400便携式光合作用仪(LI-COR,Lincoln,NE,美国)测量叶片净光合速率,光合仪参数设置如下:光量子通量为1000 μmol/(m2·s), CO2浓度为450 μmol/mol,叶面积为6 cm2,流速500 μmol/s, 温度设置适温处理32℃,高温处理40℃。每重复测定10个主茎。
1.3.4 幼穗干质量
选取NT,NT+0.15 mg/LEBR,HT,HT+0.15 mg/LEBR 4个处理的水稻新鲜主茎,在高温处理第7天和第15天剥穗观察幼穗大小,150℃下杀青后80℃下烘72 h,称量。
1.3.5 非结构性碳水化合物含量测定
在高温处理第7天和第15天,选取NT,NT+0.15 mg/LEBR,HT,HT+0.15 mg/LEBR 4个处理的水稻新鲜主茎幼穗,每重复取10个主茎,用液氮速冻,置于−80℃冰箱中保存,用于生理指标测定。
非结构性碳水化合物含量是可溶性糖和淀粉含量的总和。可溶性糖含量和淀粉含量测定采用Hansen等[16]的方法。将0.1 g冷冻的幼穗研磨成细粉并在100℃的蒸馏水中提取,然后将混合物在10 000×下离心10 min。沉淀物干燥后用于测定淀粉含量。0.1 mL上清液与0.5 mL蒽酮-乙酸乙酯溶液(1 g蒽酮溶于50 mL乙酸乙酯)和5 mL H2SO4混合。煮沸1 min后,监测反应混合物在630 nm处的吸光度变化。制备标准蔗糖溶液测定可溶性糖含量。上述离心后的沉淀,加入80%乙醇,80℃恒温水浴20 min,期间不断搅拌,冷却后加入2 mL 9.2 mol/L高氯酸,震荡10 min,加6 mL蒸馏水,10 000×下离心20 min,收集上清液的同时将残渣内加入2 mL 4.6mol/L高氯酸并震荡10 min,加入6 mL蒸馏水后10 000×下离心10 min,收集上清液,弃去残渣,上清液合并定容后测定淀粉含量。淀粉含量测定同样参考Hansen等[16]的方法。
1.3.6 可溶性酸性转化酶、蔗糖合酶、蔗糖酶、己糖激酶、丙酮酸激酶、丙酮酸脱氢酶活性测定
每个指标测定选取0.1 g冷冻的幼穗,利用可溶性酸性转化酶、蔗糖合酶、蔗糖酶、己糖激酶、丙酮酸激酶及丙酮酸脱氢酶活性测定试剂盒(苏州科铭有限公司提供)进行测定。
1.3.7 玉米素核苷含量测定
玉米素核苷(ZR)含量测定利用酶联免疫吸附法(ELISA),委托中国农业大学进行测定。
1.3.8 超氧阴离子含量、超氧化物歧化酶、氧化氢酶及过氧化物酶活性测定
每个指标测定选取0.1 g冷冻的幼穗,利用超氧阴离子含量、超氧化物歧化酶、氧化氢酶及过氧化物酶活性测定测定试剂盒(苏州科铭有限公司)进行测定。
1.3.9 幼穗RNA提取和实时荧光定量
取冷冻保存的幼穗样品0.1 g,用于蔗糖转运蛋白相关基因、、和细胞分裂素代谢相关基因、、、、、、和等的相对表达量测定。总RNA提取采用Trizol法[17]样品从−80℃冰箱取出后在冰上快速装入放置在液氮中的1.5 mL无NA离心管中,加1 mL TRIZOL(Aidlab Biotechnologies, 北京),混匀,室温放置5 min。然后加入200 μL氯仿,摇匀室温放置3 min后4℃、10 000×下离心10 min,吸上清到1.5 mL 无RNA离心管中,加入500 μL异丙醇,摇匀后冰上放置10 min,4℃、10 000×下离心10 min可出现RNA沉淀,小心倒掉上清,加1 mL 70%乙醇(DEPC水配制) 4℃、10 000×下离心10 min,小心倒掉上清后风干,加40 μL DEPC水溶解RNA沉淀。RNA反转录用试剂盒[ReverTra Ace quantitative PCR RT Master Mix(Toyobo, Osaka, Japan)]进行反转录。向反转录完的20 μL产物中加入140 μL的双蒸水稀释,实时荧光定量PCR利用7500实时 PCR系统(Applied Biosystems System)进行。基因表达分析所用引物序列如表1所示。以为内参基因,用2–ΔΔCT方法[18]进行标准化计算基因相对表达量。
1.4 数据统计与分析
采用Excel 2016进行数据统计;用SAS 9.4软件进行方差分析;采用邓肯新复极差法检验处理间差异(=3)。
2 结果与分析
2.1 水稻产量及其构成
外源喷施EBR对水稻单株产量及其构成有显著的影响。由表2可知,适温及高温条件下喷施EBR处理的单株平均产量比喷施清水对照处理分别提高11.1%和68.1%,其中以0.15 mg/L EBR喷施处理的增幅最大,适温条件下增加 20.9%,高温条件下增加114.8%。从产量结构上看,不同浓度下单株穗数和千粒重变化幅度不大,结实率虽然有显著变化,但没有呈现出明显的规律。EBR喷施对每穗粒数的影响最为明显,随着喷施浓度的增加,每穗粒数呈现出先上升后下降的趋势,在适温条件和高温条件下均在0.15 mg/L浓度喷施时有最大值,分别比清水喷施增加20.2%和65.5%。

表1 实时荧光定量PCR引物序列

表2 高温下不同浓度EBR喷施对水稻单株产量及其构成的影响
NT表示适温人工气候箱处理;HT表示高温人工气候箱处理;数据为平均数±标准差;同列中不同小写字母表示处理间差异显著(<0.05,=3)。
NT, Normal temperature phytotron; HT, High temperature phytotron; Values are Mean±SD; Values followed by different lowercase letters within the same column are significantly different at 0.05 level among treatments.
由图1可知,0.15 mg/L EBR促进了高温下主茎幼穗生长(图1-A)。高温处理15 d显著减少了主茎每穗颖花数,喷施0.15 mg/LEBR缓解了高温对颖花形成的伤害(图1-B),从颖花分化与退化上看,适温下喷施0.15 mg/LEBR对主茎颖花分化数和颖花退化率的影响不大,高温下不喷施EBR处理的主茎颖花分化数比适温下降低29.3%,主茎颖花退化率增加57.5%。高温下0.15 mg/LEBR喷施使主茎每穗颖花分化数比不喷施增加24.0%,主茎颖花退化率比不喷施降低18.6%。以上说明,喷施EBR对高温下穗发育抑制有缓解作用。
2.2 幼穗碳水化合物积累及蔗糖利用
碳水化合物积累是水稻幼穗发育的基础。由图2可知,高温下水稻上部全展叶净光合率并没有受到影响,喷施0.15 mg/LEBR,叶片净光合速率有轻微的增加,但效果并不显著(图2-A),说明幼穗分化期高温处理对水稻单株干物质积累不会造成影响。然而,高温处理抑制幼穗干物质积累,与适温处理相比,高温处理15 d幼穗干物质积累显著下降55.3%,高温下喷施0.15 mg/LEBR比不喷施EBR干物质积累增加63.9%,并且适温下喷施外源EBR对水稻幼穗干物质积累也有一定的促进作用(图2-B)。幼穗非结构性碳水化合物含量变化趋势与干物质积累量一致(图2-C)。蔗糖是碳水化合物转运的主要介质,与适温对照相比,高温下蔗糖转运蛋白相关基因、和相对表达量显著降低,外源喷施0.15 mg/LEBR可促进高温下、和的表达,特别是在高温处理7 d,外源喷施0.15 mg/LEBR显著促进了3个基因的表达,且在适温下喷施0.15 mg/LEBR对3个基因的表达也有一定的促进作用。

A-高温及适温处理7 d和15 d的幼穗表型,标尺分别为0.5 cm和1 cm; B-高温和适温处理15 d水稻抽穗期穗部表型, 标尺为2.5 cm; C-0.15 mg/L EBR喷施对高温及适温下水稻颖花分化数的影响;D-0.15 mg/L EBR喷施对高温及适温下水稻颖花退化率的影响。数据为平均数±标准差。不同小写字母表示处理间差异显著(P<0.05)。下同。
Fig. 1. Effect of exogenous 2, 4-epibrassinolide (EBR) application(0.15 mg/L) on young panicle development and spikelet formation under high temperature.

A-顶部全展叶净光合速率; B-幼穗干物质积累; C-非结构性碳水化合物含量; D-OsSUT1相对表达量; E-OsSUT2相对表达量; F-OsSUT4相对表达量。
Fig. 2. Effect of 0.15 mg/L exogenous 2, 4-epibrassinolide (EBR) application on carbohydrate distribution and transportation of young panicles under high temperature.
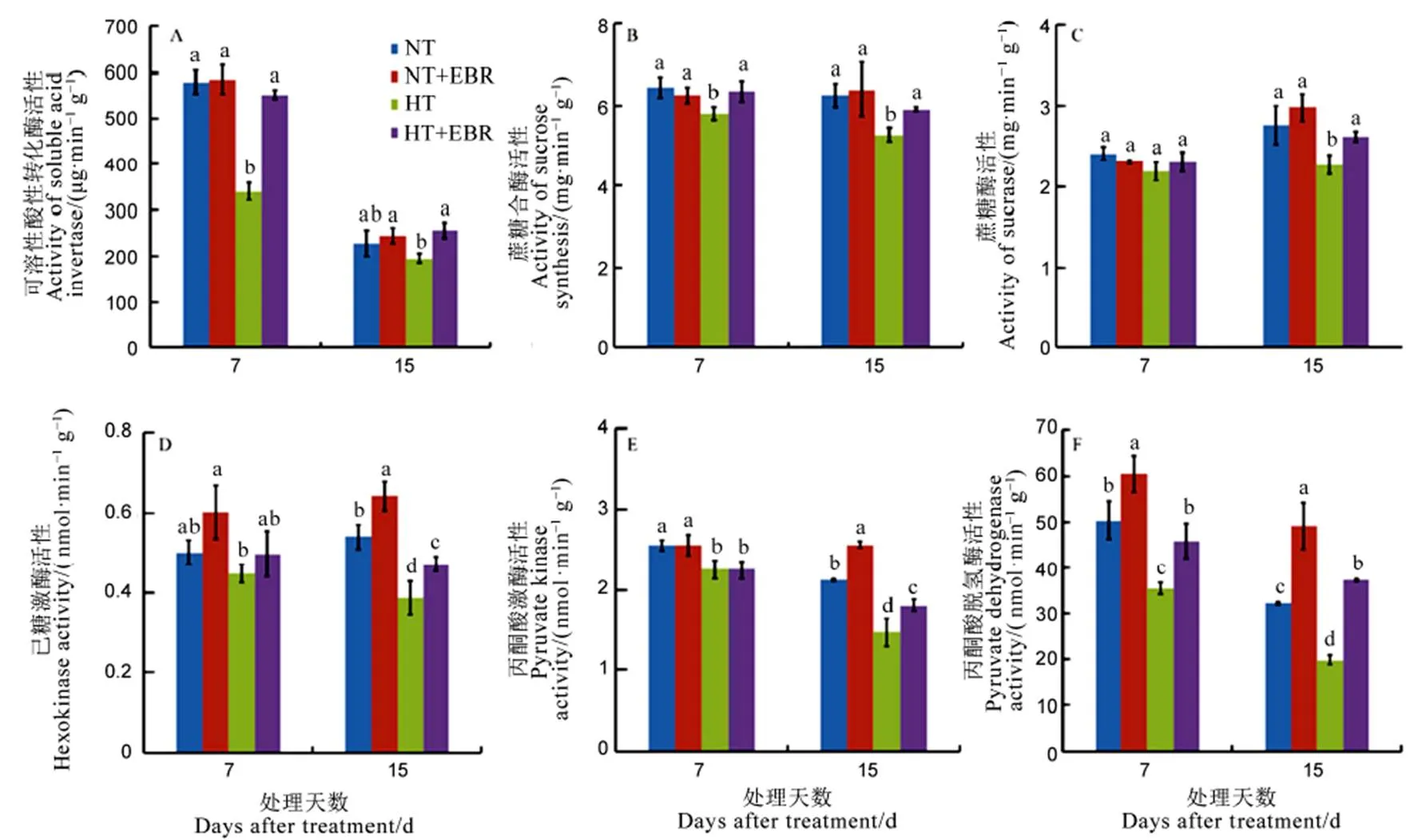
图3 高温下喷施EBR (0.15 mg/L)喷施对幼穗中蔗糖利用相关酶活性的影响
Fig. 3. Effect of 0.15 mg/L exogenous 2, 4-epibrassinalide (EBR) application on enzymes activities related to sucrose utilization under high temperature.
对蔗糖代谢进行分析,高温抑制了水稻幼穗中可溶性酸性转化酶,蔗糖合成酶活性及蔗糖酶活性,0.15 mg/LEBR喷施增加了高温对3个酶的活性,高温下喷施0.15 mg/LEBR 3个酶活性与适温下相比无显著差异(图3-A~C)。蔗糖一方面为幼穗发育的干物质积累提供原料,另一方面为幼穗发育提供能量。与适温相比,高温抑制糖酵解过程中己糖激酶、丙酮酸激酶及丙酮酸脱氢酶活性,喷施0.15 mg/LEBR增加了酶的活性,适温处理15 d喷施EBR 3个酶活性分别增加17.2%、15.6%和52.6%,高温下分别增加18.8%、22.0%和89.3%,高温下酶活性增幅要大于适温处理,然而高温处理下0.15 mg/LEBR喷施15 d丙酮酸脱氢酶活性高于适温之外,高温下0.15 mg/LEBR喷施3个酶活性仍然小于适温下喷施EBR(图3-D~E)。以上说明,外源喷施0.15 mg/L EBR促进碳水化合物向幼穗的转运和利用,进而缓解高温伤害。
2.3 玉米素核苷含量及细胞分裂素相关代谢基因表达
细胞分裂素是幼穗发育中最重要的激素,玉米素核苷是细胞分裂素的主要活性物质。由图4可知,与适温处理相比,高温处理7 d和15 d使玉米素核苷含量降低17.1% 和16.4%。喷施0.15 mg/LEBR使高温处理7 d和15 d玉米素核苷含量比不喷施EBR增加了17.2% 和10.9%,适温下增加10.5% 和22.3%。并且适温条件下喷施0.15 mg/LEBR也显著增加玉米素核苷的含量,说明喷施EBR利于提高玉米素核苷含量。
内源细胞分裂素水平由合成和降解速度共同决定,高温下细胞分裂素合成有关基因和表达降低,喷施0.15 mg/LEBR同时促进了高温和适温条件下和的表达(图5-A~B)。蛋白质OsCKX能够催化细胞分裂素降解,高温下和基因表达显著提高,喷施0.15 mg/LEBR抑制了和的表达,在适温条件下喷施EBR对两个基因表达影响不大(图5-C~D)。喷施0.15 mg/LEBR对细胞分裂素的信号转导也造成了一定的影响,A型响应调节因子()和B型响应调节因子()均受到了0.15 mg/LEBR的调节。与适温相比,高温抑制了、、和的表达,喷施0.15 mg/LEBR显著提高了4个基因在高温下的表达量,并且高于适温下的表达量,适温下喷施0.15 mg/LEBR也增加了、、和的表达量。以上说明,喷施0.15 mg/LEBR能够促进细胞分裂的合成,抑制高温下细胞分裂素的分解作用,并促进细胞分裂素的信号转导。

图4 高温下喷施EBR对幼穗玉米素核苷含量的影响
Fig. 4. Effect of 2, 4-epibrassinolide (EBR) application on zeatin riboside content in young panicles under high temperature.
2.4 幼穗抗氧化能力

图5 高温下喷施EBR (0.15 mg/L)对幼穗中细胞分裂素相关代谢基因表达的影响
Fig. 5. Effect of 0.15 mg/L EBR application on relative expression of cytokinin metabolism genes under high temperature.

图6 高温下喷施EBR (0.15 mg/L) 对幼穗抗氧化能力的影响
Fig. 6. Effect of 0.15 mg/L exogenous 2, 4-epibrassinolide (EBR) application on antioxidant capacity of young panicles.
与适温相比,高温处理7 d和15 d,超氧阴离子含量分别增加12.7%和7.1%。喷施EBR降低了高温下超氧阴离子含量(图6-A)。随着高温处理时间的延长,高温下超氧化物歧化酶活性、过氧化氢酶活性和过氧化物酶活性显著下降,喷施EBR增加了高温下3种酶的活性,高温处理15 d,喷施EBR处理的超氧化物歧化酶、过氧化氢酶、过氧化物酶活性分别比高温对照增加106.0%、43.7%和45.8%,但始终低于适温下的酶活性。随着处理时间的延长适温下喷施0.15 mg/LEBR对超氧化物歧化酶、过氧化氢酶和过氧化物酶活性也有一定的提高作用,适温处理15 d,喷施EBR超氧化物歧化酶活性、过氧化氢酶活性、过氧化物酶活性增加13.9%、18.1%和23.2%(图6-B~D)。
3 讨论
Wu 等[19]研究表明油菜素内酯含量提高能够增加水稻分蘖数,每穗粒数及干物质积累,从而增加水稻产量。本研究结果表明,喷施外源2,4-表油菜素内酯能够增加水稻每穗粒数,且喷施0.15 mg/L EBR效果最为明显,随着浓度增加,每穗粒数增幅下降,在适温条件下,喷施0.15 mg/L EBR对每穗粒数也有显著的增加效应,因此适宜浓度的EBR不仅可以缓解高温,且在正常条件下对水稻生产也有促进作用。有研究表明2,4-表油菜素内酯可以缓解水稻生产中的多种胁迫[20-21],高浓度的EBR喷施对颖花形成有不利的影响,这可能由于与高浓度喷施引起植株体内代谢紊乱有关。
颖花分化数和干物质积累量显著正相关,干物质的主要来源是叶片光合作用,前人研究表明外源喷施EBR能够提高植物叶片的净光合能力[12,22],这是由于喷施EBR延缓了叶片衰老。然而本研究中,适宜浓度的EBR喷施并没有对叶片净光合速率造成明显的影响, 这可能与油菜素内酯喷施的时期有关,本研究中的干物质同化的叶片主要是穗分化期上部全展叶,这个时期,全展叶在高温和适温下都表现出较高的光合速率,特别在高温条件下,由于强蒸腾作用的存在,水稻净光合速率甚至可以出现轻微的增加趋势[23],因而喷施EBR对这个时期全展叶的光合速率影响不大。高温抑制了蔗糖转运蛋白相关基因的表达,说明碳水化合物分配受阻,而EBR喷施缓解了这种抑制效果,说明EBR能够调控基因的表达,促进同化物从叶片到幼穗的运输,进而促进颖花分化。结果明确幼穗干物质积累受阻是由于水稻碳水化合物分配改变而不是同化物积累不足,然而,碳水化合物代谢也对物质积累造成影响,蔗糖代谢是幼穗发育中同化物供应的基础。李赞堂等[22]指出,EBR喷施可以提高蔗糖代谢相关酶的活性,促进籽粒灌浆。本研究表明高温抑制了蔗糖代谢相关酶的表达,并且同时抑制了糖酵解过程中的限速酶活性,杨洪建等[24]的研究也发现高温影响了蔗糖的卸载和利用,蔗糖代谢紊乱也是颖花退化加剧的重要原因,EBR喷施提高蔗糖代谢相关酶活性,本研究明确了EBR喷施促进了高温下碳水化合物利用,但这种效应在适温下也体现出来,也是适温下EBR喷施提高颖花数的原因之一。
穗发育和激素代谢密切相关,细胞分裂素是影响水稻穗发育的重要的激素[25-26]。玉米素核苷是细胞分裂素的主要类型。本研究表明,高温下玉米素核苷含量显著降低,而细胞分裂素合成相关基因和表达量并没有发生显著的变化,然而高温显著增加了细胞分裂素氧化酶基因和的表达量,说明高温使水稻细胞分裂素含量降低的主要原因是高温导致了细胞分裂素的分解。这与Wu等[10]研究结果是一致的。在高温条件下,EBR喷施抑制细胞分裂素氧化酶基因和的表达,并同时促进2和的表达, EBR喷施可以抑制细胞分裂素氧化分解[27]。在适温条件下,EBR喷施通过促进细胞分裂素合成而提高了幼穗中玉米素核苷的含量。本研究也发现,EBR喷施对细胞分裂素的转导也有促进作用,细胞分裂素A型调节因子和B型调节因子的基因表达说明,高温抑制了幼穗中的细胞分裂素转导,而随着时间的延长,EBR不仅缓解了这种抑制作用,而且促进了细胞分裂素的转导,说明EBR和细胞分裂素对水稻的生长调节之间有交互作用[28]。
本研究结果表明,EBR喷施导致水稻幼穗中抗氧化能力增强,降低了高温引起的超氧阴离子含量积累,可以减轻高温下超氧化物积累对细胞膜的破坏[29-30]。Xia等[31]研究发现,BR通过增强、和的信号级联反应而增加冷胁迫下番茄的抗氧化能力,热害条件下,油菜素内酯怎样调控细胞抗氧化能力的分子机制有待于进一步研究。研究中另外发现,外源表油菜素内酯的喷施也可以促进水稻花药开裂,对缓解水稻花期高温热害也有一定的作用。然而,由于表油菜素内酯成本相对较高,在实际生产中可以在穗分化期结合水稻病虫害的防治,在缓解高温热害的同时做到一喷多防,进而提高生产效率。
[1] Sanchez B, Rasmussen A, Porter J R. Temperatures and the growth and development of maize and rice: A review., 2014, 20: 408-417.
[2] Wu C, Cui K, Wang W, Li Q, Fahad S, Hu Q, Huang J, Nie L, Peng S. Heat-induced phytohormone changes are associated with disrupted early reproductive development and reduced yield in rice., 2016: 6.
[3] Wang Y, Wang L, Zhou J, Hu S, Chen H, Xiang J, Zhang Y, Zeng Y, Shi Q, Zhu D, Zhang Y. Research progress on heat stress of rice at flowering., 2019, 26: 1-10.
[4] 柳新伟, 孟亚利, 周治国, 曹卫星. 水稻颖花分化与退化的动态特征. 作物学报, 2005, 31: 451-455.
Liu X W, Meng Y L, Zhou Z G, Gao W X. Dynamic characteristics of floret differentiation and degeneration in rice., 2005, 31: 451-455. (in Chinese with English abstract)
[5] Zhang C, Feng B, Chen T, Fu W, Li H, Li G, Jin Q, Tao L, Fu G. Heat stress-reduced kernel weight in rice at anthesis is associated with impaired source-sink relationship and sugars allocation., 2018, 155: 718-733.
[6] Perdomo J A, Capo-Bauca S, Carmo-Silva E, Galmes J. Rubisco and rubisco activase play an important role in the biochemical limitations of photosynthesis in rice, Wheat, and maize under high temperature and water deficit., 2017: 8.
[7] Takehara K, Murata K, Yamaguchi T, Yamaguchi K, Chaya G, Kido S, Iwasaki Y, Ogiwara H, Ebitani T, Miura K. Thermo-responsive allele of sucrose synthase3 () provides high-temperature tolerance during the ripening stage in rice (L.)., 2018, 63: 336-342.
[8] Miyazaki M, Araki M, Okamura K, Iwaya-Inoue M. Assimilate translocation and expression of sucrose transporter,, contribute to high-performance ripening under heat stress in the heat-tolerant rice cultivar Genkitsukushi., 2013, 170: 1579-1584.
[9] 丁承强. 氮素穗肥调控水稻每穗颖花数的分子机制. 南京: 南京农业大学, 2012.
Ding C Q. Molecular mechanism of nitrogen fertilization in increasing the spikelet number per panicle of rice. Nanjing: Nanjing Agricultural University, 2012.
[10] Wu C, Cui K, Wang W, Li Q, Fahad S, Hu Q, Huang J, Nie L, Mohapatra P K, Peng S. Heat-induced cytokinin transportation and degradation are associated with reduced panicle cytokinin expression and fewer spikelets per panicle in rice., 2017:8.
[11] Vriet C, Russinova E, Reuzeau C. Boosting crop yields with plant steroids., 2012, 24: 842-857.
[12] Yu J Q, Huang L F, Hu W H, Zhou Y H, Mao W H, Ye S F, Nogues S. A role for brassinosteroids in the regulation of photosynthesis in., 2004, 55: 1135-1143.
[13] Zhang M, Zhai Z, Tian X, Duan L, Li Z. Brassinolide alleviated the adverse effect of water deficits on photosynthesis and the antioxidant of soybean (L.)., 2008, 56: 257-264.
[14] Ryu H, Cho Y. Plant hormones in salt stress tolerance., 2015, 58: 147-155.
[15] 松岛省三. 稻作的理论与技术. 庞城译, 北京: 农业出版社, 1966: 121-133.
Matsushima S. Theory and Technology of Rice Cultivation. Pang C Trans. Beijing: Agriculture Press, 1966: 121-133. (in Chinese)
[16] Hansen J, Møller I. Percolation of starch and soluble carbohydrates from plant tissue for quantitative determination with anthrone., 1975, 68 (1): 87-94.
[17] 王杰, 王全, 田娜, 王瑜, 王爱香, 张克中, 崔金腾. 不同植物组织RNA提取方法的比较分析. 北京农学院学报, 2015, 30(1): 76-80.
Wang J, Wang Q, Tian N, Wang Y, Wang A X, Zhang K Z, Cui J T. Comparison and analysis of RNA extracting method from different plant tissues., 2015, 30(1): 76-80.
[18] Czechowski T, Bari R P, Stitt M, Scheible W R, Udvardi M K. Real-time RT-PCR profiling of over 1400transcription factors: Unprecedented sensitivity reveals novel root- and shoot-specific genes., 2004, 38: 366-379.
[19] Wu C Y, Trieu A, Radhakrishnan P, Kwok S F, Harris S, Zhang K, Wang J, Wan J, Zhai H, Fujioka S, Feldmann K A, Pennell R I. Brassinosteroids regulate grain filling in rice., 2008, 20: 2130-2145.
[20] Wang F, Zhang Y, Guo Q, Tan H, Han J, Lin H, Wei H, Xu G, Zhu C. Effects of exogenous 5-aminolevulinic acid and 2,4-epibrassinolide on Cd accumulation in rice from Cd-contaminated soil., 2018, 25: 320-329.
[21] Clouse S D. Brassinosteroid/abscisic acid Antagonism in balancing growth and stress., 2016, 38: 118-120.
[22] 李赞堂, 王士银, 姜雯宇, 张帅, 张少斌, 徐江. 穗分化期外施24-表油菜素内酯(EBR)促进水稻源、库及籽粒灌浆的生理机制. 作物学报, 2018, 44(4): 581-590.
Li Z, Wang S, Jiang W, Zhang S, Zhang S, Xu J. Physiological mechanisms of promoting source, sink, and grain filling by 24-epibrassinolide (EBR) applied at panicle initiation stage of rice., 2018, 44(4): 581-590. (in Chinese with English abstract)
[23] Zhang C, Fu G, Yang X, Yang Y, Zhao X, Chen T, Jin Q, Tao L X. Heat stress effects are stronger on spikelets than on flag leaves in rice due to differences in dissipation capacity., 2016, 202: 394-408.
[24] 杨洪建, 杨连新, 黄建晔, 刘红江, 董桂春, 颜士敏, 朱建国, 王余龙. FACE对武香粳14颖花分化与退化的影响. 作物学报, 2006, 32: 1076-1082.
Yang H, Yang L, Huang J, Liu H, Dong G, Yan S, Zhu J, Wang Y. Effect of free-air CO2enrichment on spikelet differentiation and degeneration ofrice Wuxiangjing 14., 2006, 32: 1076-1082. (in Chinese with English abstract)
[25] Wang Z, Zhang W, Yang J. Physiological mechanism underlying spikelet degeneration in rice., 2018, 17: 1475-1481.
[26] Ashikari M, Sakakibara H, Lin S, Yamamoto T, Takashi T, Nishimura A, Angeles E R, Qian Q, Kitano H, Matsuoka M. Cytokinin oxidase regulates rice grain production., 2005, 309: 741-745.
[27] Yuldashev R, Avalbaev A, Bezrukova M, Khripach V, Shakirova F. Cytokinin oxidase is involved in the regulation of cytokinin content by 24-epibrassinolide in wheat seedlings., 2012, 55: 1-6.
[28] Hu Y, Bao F, Li J. Promotive effect of brassinosteroids on cell division involves a distinct CycD3-induction pathway in., 2010, 24: 693-701.
[29] Ahmad P, Jaleel C A, Salem M A, Nabi G, Sharma S. Roles of enzymatic and nonenzymatic antioxidants in plants during abiotic stress., 2010, 30: 161-175.
[30] 曹云英, 赵华. 高温胁迫下油菜素内酯对水稻幼苗的保护作用. 中国水稻科学, 2007, 21(5): 525-529.
Cao Y Y, Zhao H. Protective roles of brassinolide in rice seedling under heat stress., 2007, 21(5): 525-529. (in Chinese with English abstract)
[31] Xia X, Fang P, Guo X, Qian X, Zhou J, Shi K, Zhou Y, Yu J. Brassinosteroid-mediated apophatic H2O2-glutare doxin 12/14 cascade regulates antioxidant capacity in response to chilling in tomato., 2017, 41: 1052-1064.
Mechanism of Exogenous Brassinolide in Alleviating High Temperature Injury at Panicle Initiation Stage in Rice
CHEN Yanhua1, 3, WANG Yaliang1, 2, *, ZHU Defeng1, SHI Qinghua2, CHEN Huizhe1, XIANG Jing1,ZHANG Yikai1, ZHANG Yuping1, *
(China National Rice Research Institute,,,;College of Agronomy,,,;College of Agronomy,,,;Corresponding author,:;)
【】The purpose of the study is to ascertain the effects of 2,4-epibrassinolide(EBR) application on rice panicle development and spikelet formation under high temperature, and to explore the physiological mechanism. 【】Heat-sensitive inbred rice cultivar IR36 was subjected to high temperature (HT, 40℃) and normal temperature (NT, 32℃) in climate chambers with EBR application, and the carbohydrate supplement, sucrose metabolism, cytokinin metabolism, and antioxidant capacity of young panicle were investigated. 【】1) EBR application increased the number of spikelets per panicle by 13.7% and 45.7% on average under HT and NT, respectively, in comparison to the control. And 0.15 mg/L EBR application level performed the highest efficiency in increasing the number of spikelet number, EBR application prompted panicle development and spikelet differentiation, and inhibited spikelet degeneration. 2) EBR application did not influence leaf net photosynthesis, meanwhile increased the dry matter and nonstructural carbohydrate accumulation in young panicles. Under high temperature, EBR application significantly upregulated the expression levels of sucrose transport genes,, and, and EBR enhanced the related enzymes activities of sucrose metabolism especially in HT than in NT. 3) EBR application reduced the expression levels of cytokinin oxidase genes,and, under HT. Meanwhile, EBR application promoted the genes expression involved in cytokinin biosynthesis and signal transduction both under HT and NT treatments. 4) EBR application increased the activities of superoxide dismutase, catalase and peroxidase, reduced the content of superoxide under HT. 【】Under HT conditions, EBR application at appropriate concentration could alleviate heat damage to spikelet formation by promoting carbohydrates transportation to young panicles, inhibiting cytokinin oxidation, and reducing peroxidation injures. Meanwhile, EBR application could promote spikelet formation under normal temperature.
rice (L.); high temperature; spikelet formation; 2,4-epibrassinolide; physiological mechanism
S482.8; S511.01
A
1001-7216(2019)05-0457-10
10.16819/j.1001-7216.2019.9036
2019-03-29;
2019-04-15。
国家重点研发专项(2017YFD0300409);现代农业产业技术体系建设专项(CARS-01-07B);中国农业科学院创新团队资助项目。

