水稻重金属镉吸收和转运的分子遗传机制研究进展
丁仕林 刘朝雷 钱前 高振宇
水稻重金属镉吸收和转运的分子遗传机制研究进展
丁仕林 刘朝雷 钱前 高振宇*
(中国水稻研究所 水稻生物学国家重点实验室, 杭州 310006;*通讯联系人, E-mail: gaozhenyu@caas.cn)
镉是对人体健康具有高度毒害作用的重金属元素之一。人体摄入镉的主要来源是食用镉超标的稻米,因此研究水稻对镉吸收、转运、积累的遗传机制尤为重要。目前,虽然水稻镉积累的遗传通路尚未完全明晰,但已明确了一些重要基因在稻米镉积累过程中的调控作用。本文就镉胁迫对水稻的危害、水稻品种间镉积累量的变异、水稻镉积累相关QTL、水稻镉吸收转运相关基因的研究进展及其育种利用加以综述,探讨了未来研究的方向。
水稻;镉;镉吸收;镉转运;分子遗传机制
镉是对植物和人类都具有高度毒性的重金属元素。近年来,由于工业“三废”不合理排放、固体废弃物处理不善、污水灌溉、污泥农用以及施用含有重金属元素的肥料等原因,导致土壤中重金属镉含量剧增,镉污染问题日益严重[1]。镉在人体内的半衰期为10~35年,主要通过食物链进入人体内[1]。镉进入人体后主要在肾脏积累,并在体内不断富集。即使低水平的慢性镉摄入,同样会对人体的骨骼和呼吸系统造成危害,引起一系列疾病。因此,世界卫生组织已将镉划为一级致癌物质[2-4]。
水稻作为世界重要的粮食作物之一,是亚洲各国人民的主食。水稻作为食物链的初级生产者,当生长于有毒重金属污染的土壤中时,过量的有毒重金属在其根、茎、叶以及籽粒中大量积累,不仅阻碍水稻的正常生长发育,而且严重影响稻米品质,进而危及人体健康[5-6]。20世纪60年代在日本发生的食用镉污染严重超标土地产的镉大米而引发的痛痛病事件就是典型的例证[7]。我国规定糙米中镉含量安全标准为低于0.2 mg/kg[8]。然而,由于农田污染、使用镉吸收能力强水稻品种等原因,稻米镉超标事件常有发生。目前解决大米镉超标的措施主要有优化田间种植的水肥管理和遗传改良水稻品种,而选育镉低积累品种成为解决大米镉污染的首选方法[6]。因此,研究水稻重金属镉吸收和转运的分子调控机理,对低镉新品种选育具有重要的现实意义。
1 镉胁迫对水稻的危害
目前,我国的耕地面积约为1.35亿hm2,不同程度受到铬、汞、砷、铅和镉等重金属污染,其中以镉污染最为严重。据估算,我国耕地受镉污染面积约占全国总耕地面积的20%[9]。镉污染严重影响了水稻的生长,其在根系中大量富集,对其生长发育、生理代谢等方面具有毒害作用。在种子萌发时,镉离子可以抑制蛋白酶和肽酶的活性,从而抑制种子萌芽。当镉浓度大于0.5 mmol/L时,水稻的出苗率为零[10]。湖南农业大学杨明等[11]用不同浓度镉处理水稻种子,随着镉胁迫浓度的升高,种子萌发和幼苗生长受抑制程度逐渐增强。何俊瑜等[12]用不同浓度镉处理水稻幼苗,发现镉使根尖细胞的有丝分裂中期细胞增加,而前期、后期和末期细胞相对减少。总体来说,镉对水稻根尖细胞的有丝分裂具有阻滞作用,并且使染色体畸变率显著增加。
除了对水稻种子和根的影响,镉还能抑制水稻的光合作用。郭文燕等[13]采用土培法,发现在镉胁迫下,叶绿素a受影响程度高于叶绿素b,品种间差异显著。孙亚莉等[14]研究发现,镉胁迫导致水稻叶片的气孔限制值增加,光合作用减弱;同时,镉胁迫还导致水稻丙二醛(MDA)含量升高,过氧化氢酶(CAT)、过氧化物(POD)、超氧化物歧化酶(SOD)的活性增强,镉积累能力不同的品种在镉胁迫下活性氧(ROS)清除相关蛋白量存在显著差异,说明ROS可能在水稻籽粒镉胁迫相关信号的传递中发挥重要作用[15-16]。
镉胁迫还会使水稻的产量和品质降低。袁珍贵等[17]发现随着土壤镉含量的提高,水稻的有效颖花数、结实率和收获指数均下降,从而导致水稻减产。
2 水稻品种间镉积累量的变异
水稻是一种富集镉能力较强的作物,不同水稻品种间镉积累量差异较大[18-21]。Arao和Ae[18]将收集的49个水稻品种种植于镉污染地区,成熟后测定发现,不同品种间的籽粒镉含量差异达到了23倍。Liu等[19]测定的糙米镉含量变异范围在0.14~1.43 mg/kg。Ueno等[20]收集了146份水稻核心种质资源,结果发现幼苗地上部镉含量最高与最低之间相差13倍。最近,Yan等[8]在两种田间环境以及水培环境下研究发现,三种不同环境下镉积累分别达9.4、12.6和50.9倍差异。虽然不同品种间的镉积累差别较大,但总体来讲,籼稻品种地上部和稻米的镉积累量高于粳稻品种[21-23]。
3 水稻镉积累的遗传研究分析
3.1 水稻镉积累相关QTL
水稻地上部及籽粒镉积累量属于复杂性状,受到多个遗传位点共同调控。迄今为止,研究人员已利用不同的遗传群体检测到上百个控制水稻镉积累的QTL位点(表1)。Zhang等[24]利用粳稻品种京系17和籼稻品种窄叶青8号构建的DH群体,分别在水稻第3、4和6染色体定位到与糙米镉积累相关的QTL位点。在水稻苗期镉胁迫下,Wang等[25]也利用京系17和窄叶青8号构建的DH群体定位了3个叶片卷曲度和绿叶率相关QTL,并发现水稻苗期视觉测量叶片这两个指标是筛选耐镉种质的有效方法。Kashiwagi等[26]利用Kasalath/日本晴构建的回交群体检测到3个控制水稻地上部镉积累QTL。Ueno等[20]利用高镉品种Badari Dhan和低镉品种Shwe War杂交后代构建的F2群体,在水稻第11染色体上检测到一控制籽粒镉含量的主效QTL。使用不同品种构建的遗传群体,在水稻第7染色体短臂上曾多次检测到一控制水稻镉积累的主效QTL,可影响镉从地下部向地上部的转运以及籽粒镉含量[8, 27-34]。最近,Huang等[35]基于关联分析检测到3个籽粒镉含量QTL;Sun等[36]通过对长江中下游地区的617个优良杂交稻品种及全球68个自交系品种的关联分析检测到4个镉含量QTL。
虽然研究人员利用不同遗传群体和方法检测到一系列镉积累相关的QTL位点,但到目前为止,由QTL克隆到的基因只有2个,分别是和[30, 37]。Ueno等[30]利用镉高积累品种Anjana Dhan和日本晴构建的定位群体,克隆了水稻低镉积累基因——,该基因主要影响镉从地下向地上部的转运效率以及地上部的镉积累,此后发现该基因在品种间存在多个自然变异类型[8, 31-34]。Luo等[38]利用镉积累差异显著的两个品种台中1号和春江06,构建杂交群体克隆到了一个特异性调控水稻叶片镉积累的主效QTL——基因。该基因编码植物防御素类似蛋白(defensin-like protein),定向调控镉在叶片等营养器官的积累。此外,Ishikawa等[39]利用辐射诱变产生的水稻低镉突变体克隆了编码自然抗性相关巨噬细胞蛋白的基因,该基因的突变使水稻植株的镉积累量显著降低。
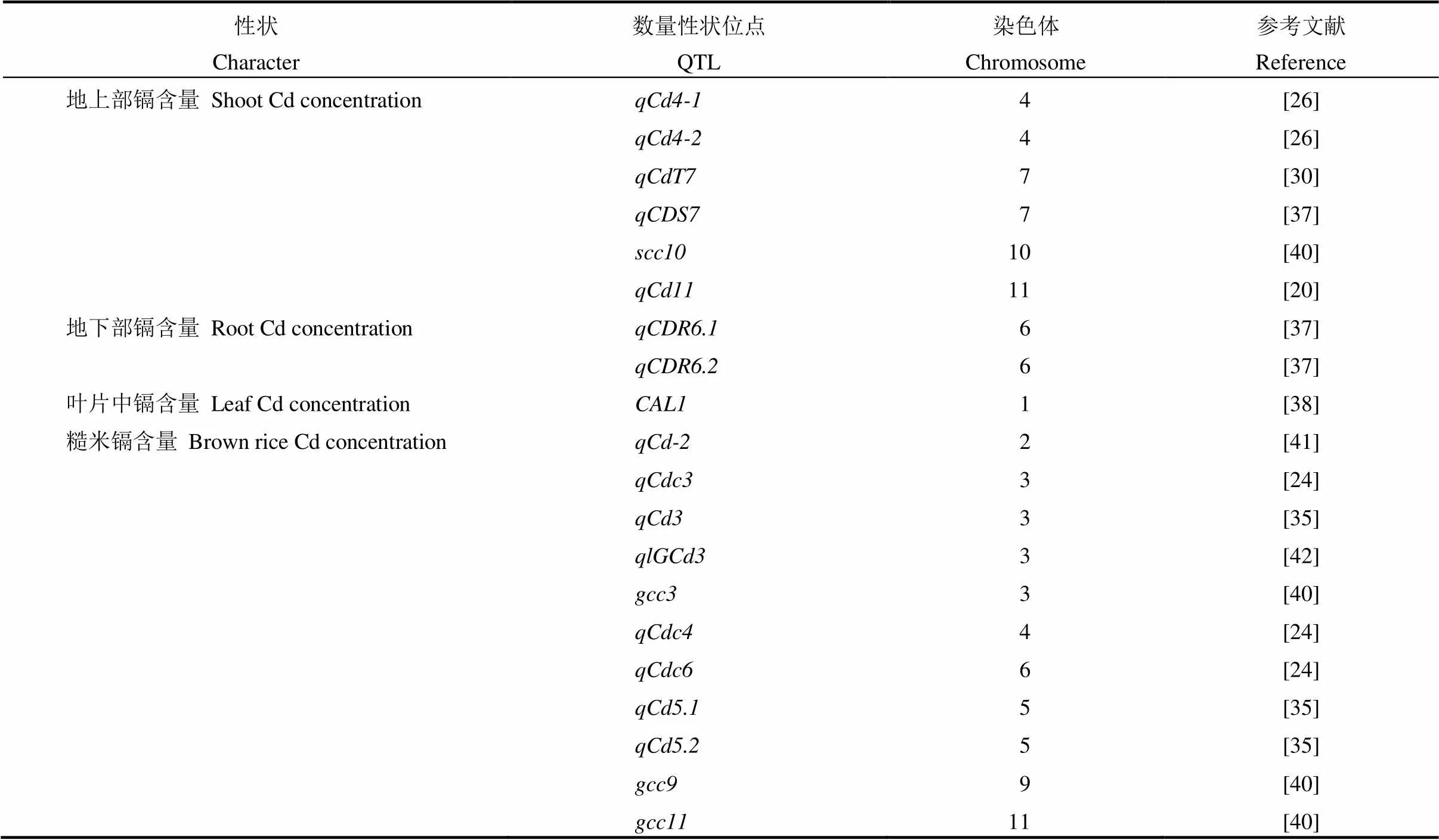
表1 水稻中已报道的调控镉吸收和转运相关的QTL
3.2 水稻镉吸收和镉转运相关基因
稻米积累镉主要经历四个生理阶段:1)根系从土壤中吸收镉,使镉进入根系组织;2)进入水稻根系细胞中的镉在木质部进行加载,完成由根系向地上部的转运过程;3)进入地上部镉在茎节处实现不同组织器官的转运分配;4)分配至叶片等器官中的镉通过韧皮部再转移[5]。随着水稻全基因组测序工作的完成和功能基因组研究的深入,一些参与水稻镉吸收和镉转运的功能基因相继克隆(表2)。根据上述四个生理过程,以下简要分述这些基因的功能与特点。
土壤中的镉进入水稻根系主要借助其他离子通道蛋白,目前水稻中尚未发现根系特异性吸收镉的转运蛋白。和分别编码亚铁离子转运蛋白和铁调控转运蛋白,是水稻控制吸收铁元素的主要转运蛋白[43-44]。在酵母中,转运蛋白OsIRT1和OsIRT2不仅表现出吸收铁的能力,还具有镉转运活性[44]。当稻田处于淹水状态时,OsIRTs受低铁环境诱导,表达水平上升,铁吸收量增加;而稻田排水后,OsIRTs则开始吸收土壤中的镉[5]。过表达植株在含有过量镉的MS培养基上培养时,其地下部和地上部的镉含量显著上升,但在田间未检测到此表型[45]。
目前普遍认为,镉进入水稻根系主要通过锰离子通道OsNRAMP5。OsNRAMP5属于自然抗性相关巨噬细胞蛋白家族成员,定位于质膜上[46],主要负责水稻根系吸收锰,同时还具备转运镉和铁的功能[47]。辐射诱变获得的水稻突变体的根系对镉吸收显著降低[39]。主要在水稻根和穗中表达,在茎中的表达适中,叶片和叶鞘中表达较低,且随着叶龄增加表达水平逐步降低。在根中,表达主要限定在水稻根的表皮、外皮层、皮层外层以及木质部的附近组织[47-48]。敲除可以大幅度降低水稻籽粒的镉含量,但敲除后会影响水稻对锰的吸收,获得的低镉品种材料在低锰环境中存在生长不良的风险[49]。Takahashi等[46]比较了高镉品种Habataki和低镉品种Sasanishiki中基因的序列差异,发现两个品种的氨基酸序列完全一致,但Habataki品种中基因启动子区域存在406 bp的缺失,导致在Habataki品种中转录表达水平显著高于Sasanishiki。属于自然抗性相关巨噬细胞蛋白家族基因另一个成员,含转入的酵母在添加镉的培养基培养时生长受到抑制,且该酵母中的镉含量显著高于转入空载体的酵母,说明具有转运Cd的活性。主要在水稻根系中表达,且不受镉诱导,但在铁缺乏条件下表达高度上调。
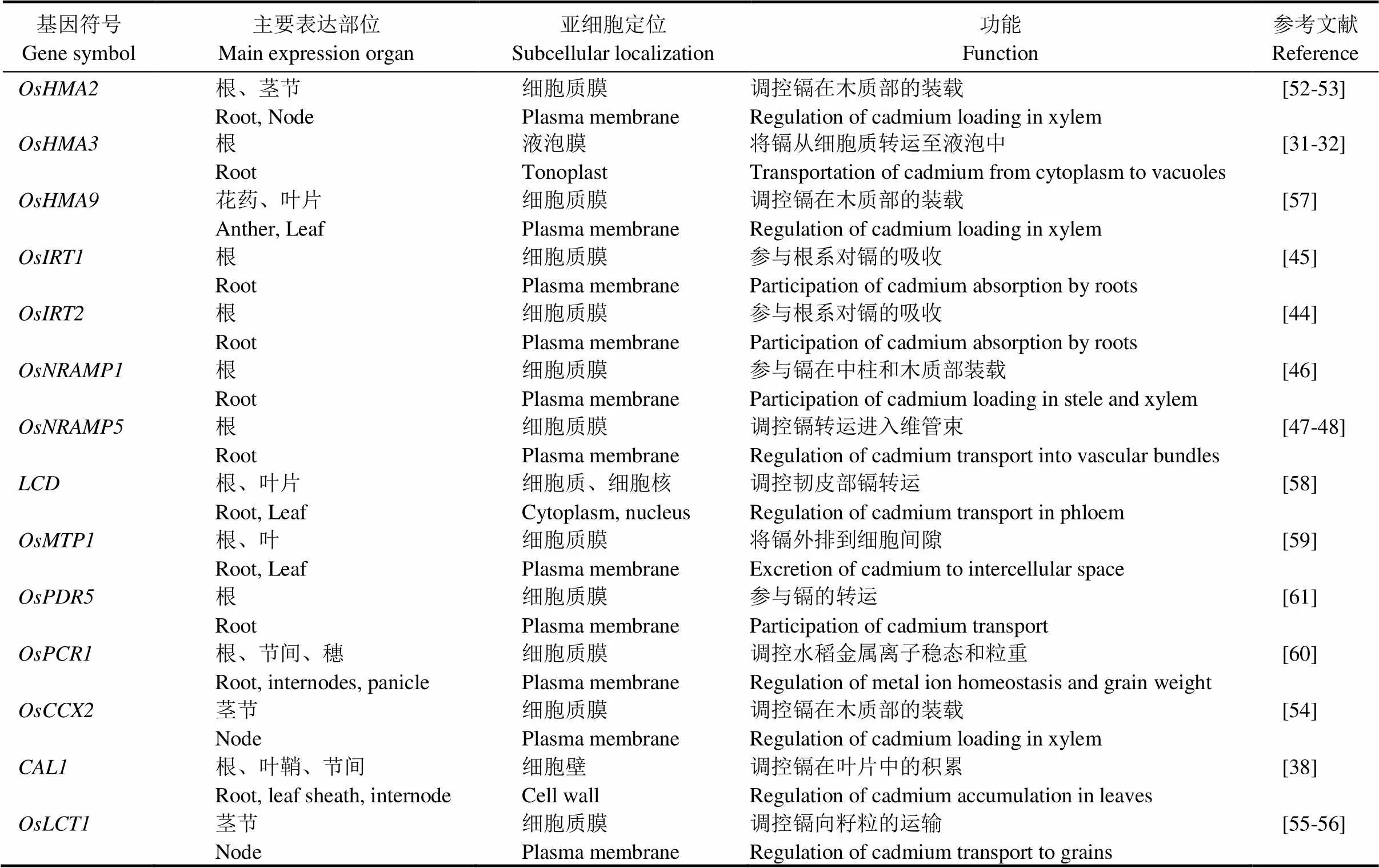
表2 水稻中已克隆的调控镉吸收和转运的基因
根系对镉的吸收能力决定了进入水稻植株的镉总量,但由木质部介导的镉从根系向地上部的转运能力是决定水稻茎秆和谷粒镉积累量的关键[50]。定位在水稻根部液泡膜上的镉转运蛋白OsHMA3在此过程中发挥主导作用。属于重金属ATP酶(HMA)基因家族成员,主要在根部表达,该基因的缺陷导致镉从地下部向地上部转运速率提高,秸秆和籽粒中镉含量增加[8, 32]。无镉条件下,过表达植株与空载对照植株的根部和茎部生长没有明显差异;但在镉胁迫条件下,镉对过表达植株生长的抑制作用明显减弱[32]。能够将镉转运入液泡从而将其隔离,减少镉向地上部运输,从而降低镉毒性[31-32]。过表达可显著降低水稻籽粒的镉含量,因此是培育低镉品种的有效途径之一[51]。在自然品种中存在多个变异类型,其中Ⅰ型和Ⅴ型是主要类型,在酵母中均具有较高的转运镉活性;而其余类型属于稀有类型,且大部分属于功能丧失类型,地上部和籽粒的镉含量高[8]。中国水稻研究所种质创新课题组最新发现,启动子区在籼粳亚种间具有自然变异,部分导致了籼粳亚种间的镉积累差异[33]。
与OsHMA3同源的同属于重金属ATP酶家族成员的OsHMA2,在水稻镉向木质部的装载和从地下部向地上部转运过程中也发挥着重要功能。主要在水稻根部表达,且在根的维管束组织大量富集,其编码蛋白定位在细胞质膜上。过表达植株的稻米镉含量下降近一半[52]。Satoh-Nagasawa等[53]发现,OsHMA2的C端区域对地上部镉的转运是必需的。
水稻钙离子/阳离子交换蛋白主要在水稻节点维管组织的木质部区域表达,蛋白定位在细胞质膜上,敲除可显著降低籽粒的镉含量。进一步研究表明,该基因的破坏导致镉从根部向地上部的转运效率降低[54]。
镉由根转运到地上部后,由韧皮部转运至地上各个组织器官中。由于水稻茎秆存在多个茎节,每个茎节通过连接根、叶片和上一个茎节的维管束,对镉在地上部运输及分配产生重要影响。Uraguchi等[55]分离了水稻镉运输蛋白基因,该基因主要在水稻生殖阶段的叶片和茎节表达,尤其是在大的维管束细胞周围以及分散的维管束中高表达。OsLCT1也定位在细胞质膜上。在的RNA干涉株系中,木质部介导的镉运输不受影响,但韧皮部介导镉运输途径受到阻碍;同时敲除株系的稻米镉含量仅是对照组的一半[56]。
在水稻地上部分配镉的过程中,最近克隆的基因发挥了重要调控作用。Luo等[38]对位于水稻第2染色体、贡献率达13%的叶片镉含量相关QTL位点进行精细定位,最终克隆了控制水稻叶片镉含量的基因。编码植物防御素类似蛋白,主要在根、叶鞘和节中表达,而在叶片中基本不表达。CAL1蛋白具有胞外信号肽的特点,可通过3个巯基与镉特异螯合。这些螯合态的镉随后从木质部薄壁细胞中分泌出来,经木质部中长距离转运后,在叶片中大量积累。可能由于与CAL1螯合的镉难以再次跨膜,因此无法参与由韧皮部向水稻籽粒的再分配过程[38]。
4 镉吸收和镉转运相关基因在水稻育种中的利用
水稻低镉积累品种是指在相同种植条件下水稻籽粒镉积累含量相对较低的品种,也就是种植在高镉土壤条件下稻米中镉含量相对较低、中镉土壤条件下稻米镉含量能达标、低镉土壤条件下稻米镉含量不超标的品种[62]。目前低镉积累水稻品种主要是从已有的水稻资源中筛选得到。从2014年开始,湖南农业科学院等单位开始大规模筛选低镉水稻主栽品种。经过多年多点的重复大田试验,从685个水稻主栽品种中筛选出49个镉积累相对较低的水稻品种。2017年,Duan等[21]又从中选了8个低镉积累水稻品种。低镉水稻新品种培育还可以通过将低镉积累等位基因转移到高镉高产骨干亲本中,从而培育出杂交稻新组合和常规稻新品系;对于低镉低产品种来说,也可以将控制产量的优秀等位基因聚合到低镉低产品种中,筛选出低镉高产的水稻新品种。
随着基因组学的迅速发展,越来越多与镉吸收和转运相关的基因陆续被发现。同时,随着基因编辑技术的兴起和发展,这些基因可被应用于低镉水稻品种的培育。Li等[49]利用CRISPR/Cas9基因编辑技术将杂交稻亲本华占和隆科638S中的基因敲除,用敲除后的亲本配制的杂交稻籽粒中,镉含量均较亲本降低了95%以上。但是,也负责必需营养元素锰的吸收和转运,敲除它会影响对锰的吸收转运,从而使产量下降。中国水稻研究所科研人员Liu等[63]经多年回交,构建了以93-11为背景的染色体片段代换系。与对照93-11相比,代换系不仅根系锰吸收能力增强、籽粒锰浓度上升,而且籽粒镉浓度显著降低。过表达则可以降低水稻籽粒中的镉含量,其他元素的吸收不受影响,所以有助于低镉高产水稻品种的选育。然而,由于OsHMA3主要是将镉截留在水稻根部细胞的液泡中,农田中的镉却仍然存在。而基因主要负责将镉通过木质部运输,最终在叶片中积累,而不影响镉在籽粒中的积累,CAL1促进了镉在叶片和秸秆中的分配,有利于培育“修复型”水稻品种[38]。
5 研究展望
随着工业化和城市化的发展,土壤镉及其他重金属污染日益严峻,解决土壤污染问题成为一项长期而艰巨的任务。降低和杜绝重金属污染物的排放是根本措施,但是我国经济正处在飞速发展时期,目前很难从源头上加以根本解决。因此,对于育种家来说,培育低镉、优质、高产、高抗的水稻新品种是解决土壤镉污染和保护国家粮食安全的有效措施之一。
水稻镉吸收、转运以及籽粒镉积累的分子机制解析,为低镉品种的筛选创造了条件。至今,调控水稻镉吸收和镉转运的基因报道较少,极大限制了低镉积累水稻品种的培育进程。因此,继续挖掘调控水稻镉吸收和镉转运的基因,明确水稻镉吸收和镉转运的分子遗传机制,才能为培育低镉高产水稻品种提供指导。今后一段时间的工作重点应放在通过创制遗传群体和利用自然群体,采用图位克隆、全基因组关联分析、QTL定位等方法克隆低镉QTL或功能基因,并将这些基因运用分子标记辅助育种(MAS)、常规育种等手段加以聚合,加快低镉积累的优质超级稻品种培育的速度和效率,实现镉污染农田的安全利用。
[1] Clemens S, Aarts M G, Thomine S, Verbruggen N. Plant science: The key to preventing slow cadmium poisoning., 2013, 18(2): 92-99.
[2] Nawrot T S, Staessen J A, Roels H A, Munters E, Cuypers A, Richart T, Ruttens A, Smeets K, Clijsters H, Vangronsveld J. Cadmium exposure in the population: From health risks to strategies of prevention., 2010, 23(5): 769-782.
[3] Satarug S, Garrett S H, Sens M A, Sens D A. Cadmium, environmental exposure, and health outcomes., 2010, 118(2): 182-190.
[4] Jarup L, Akesson A. Current status of cadmium as an environmental health problem., 2009, 238(3): 201-208.
[5] Uraguchi S, Fujiwara T. Cadmium transport and tolerance in rice: Perspectives for reducing grain cadmium accumulation., 2012, 5(1): 5.
[6] 鄂志国, 张玉屏, 王磊. 水稻镉胁迫应答分子机制研究进展. 中国水稻科学, 2013, 27(5): 539-544.
E Z G, Zhang Y P, Wang L. Molecular mechanism of rice responses to cadmium stress., 2013, 27(5): 539-544. (in Chinese with English abstract)
[7] Yamagata N. Cadmium pollution in perspective., 1970, 19(1): 1-27.
[8] Yan J, Wang P, Wang P, Yang M, Lian X, Tang Z, Huang C F, Salt D E, Zhao F J. A loss-of-function allele ofassociated with high cadmium accumulation in shoots and grain ofrice cultivars., 2016, 39(9): 1941-1954.
[9] 易江, 甘平洋, 陈渠玲, 张源泉, 裴健儒, 黄天柱, 毛青秀, 陈昌勇. 稻米镉污染及其消减技术研究进展. 湖南农业科学, 2018, 390(3): 110-113.
Yi J, Gan P Y, Chen Q L, Zhang Y Q,Pei J R,Huang T Z,Mao Q X,Chen C Y. Research progress on pollution of cadmium in rice and its removal technology., 2018, 390(3): 110-113. (in Chinese with English abstract)
[10] 田艳芬, 史锟. 镉对水稻等作物的毒害作用. 垦殖与稻作, 2003(5): 26-28.
Tian Y F, Shi K. Poisonous effects on rice and vegetables by cadmium., 2003(5): 26-28. (in Chinese with English abstract)
[11] 杨明, 陈璐, 徐庆国, 孙亚莉. 镉胁迫对不同水稻品种种子萌发和幼苗生长的影响. 作物研究, 2017, 31(6): 659-663.
Yang M, Chen L, Xu Q G, Sun Y L. Effects of cadmium stress on seed germination and growth characteristic of different rice cultivars., 2017, 31(6): 659-663. (in Chinese with English abstract)
[12] 何俊瑜, 任艳芳, 严玉萍, 朱诚, 蒋德安. 镉胁迫对水稻幼苗生长和根尖细胞分裂的影响. 土壤学报, 2010, 47(1): 138-144.
He J Y, Ren Y F, Yan Y P, Zhu C, Jiang D A. Impacts of cadmium stress on the growth of rice seedlings and division of their root tip cells., 2010, 47(1): 138-144. (in Chinese with English abstract)
[13] 郭文燕, 田雄, 李尚锟, 李伟, 黄永相, 胡燕, 赵夏夏, 郭建夫. 镉胁迫对水稻光合生理特征及相关营养元素吸收影响研究. 安徽农业科学, 2018, 46(14): 37-43.
Guo W Y, Tian X, Li S K, Li W, Huang Y X, Hu Y, Zhao X X, Guo J F. Effects of cadmium stress on the physiological and biochemical characters of rice at heading stage., 2018, 46(14): 37-43. (in Chinese with English abstract)
[14] 孙亚莉, 刘红梅, 徐庆国. 镉胁迫对不同水稻品种苗期光合特性与生理生化特性的影响. 华北农学报, 2017, 32(4): 176-181.
Sun Y L, Liu H M, Xu Q G. Effect of cadmium stress on photosynthetic characteristics and physiological and biochemical traits during seedling stage of different rice cultivars., 2017, 32(4): 176-181. (in Chinese with English abstract)
[15] Xue D W, Jiang H , Deng X X, Zhang X Q, Wang H, Xu X B, Hu J, Zeng D L, Guo L B, Qian Q. Comparative proteomic analysis provides new insights into cadmium accumulation in rice grain under cadmium stress., 2014, 280: 269-278.
[16] Zhang X Q, Chen H N, Jiang H, Lu W, Pan J J, Qian Q, Xue D W. Measuring the damage of heavy metal cadmium in rice seedlings by SRAP analysis combined with physiological and biochemical parameters., 2015, 95(11): 2292-2298.
[17] 袁珍贵, 陈平平, 郭莉莉, 屠乃美, 易镇邪. 土壤镉含量影响水稻产量与稻穗镉累积分配的品种间差异. 作物杂志, 2018(1): 107-112.
Yuan Z G, Chen P P, Guo L L, Tu N M, Yi Z X. Varietal difference in yield and Cd accumulation and distribution in panicle of rice affected by soil Cd content., 2018(1): 107-112. (in Chinese with English abstract)
[18] Arao T, Ae N. Genotypic variations in cadmium levels of rice grain., 2003, 49(4): 473-479.
[19] Liu J, Qian M, Cai G, Yang J, Zhu Q. Uptake and translocation of Cd in different rice cultivars and the relation with Cd accumulation in rice grain., 2007, 143(1-2):443-447.
[20] Ueno D, Kono I, Yokosho K, Ando T, Yano M, Ma J F. A major quantitative trait locus controlling cadmium translocation in rice ()., 2009, 182(3): 644-653.
[21] Duan G, Shao G, Tang Z, Chen H, Wang B, Tang Z, Yang Y, Liu Y, Zhao F J. Genotypic and environmental variations in grain cadmium and arsenic concentrations among a panel of high yielding rice cultivars., 2017, 10(1): 9.
[22] He J, Zhu C, Ren Y, Yan, Y, Jiang D. Genotypic variation in grain cadmium concentration of lowland rice., 2006, 169(5): 711-716.
[23] Uraguchi S, Fujiwara T. Rice breaks ground for cadmium-free cereals., 2013, 16(3): 328-334.
[24] Zhang X, Zhang G, Guo L B, Wang H Z, Zeng D L, Dong G J, Qian Q, Xue D W. Identification of quantitative trait loci for Cd and Zn concentrations of brown rice grown in Cd-polluted soils., 2011, 180(2): 173-179.
[25] Wang J H, Fang Y X, Tian B, Zhang X Q, Zeng D L, Guo L B, Hu J, Xue D W. New QTLs identified for leaf correlative traits in rice seedlings under cadmium stress., 2018, 85(2): 329-335.
[26] Kashiwagi T, Shindoh K, Hirotsu N, Ishimaru K. Evidence for separate translocation pathways in determining cadmium accumulation in grain and aerial plant parts in rice., 2009, 9(1): 8.
[27] Ueno D , Koyama E , Kono I, Ando T, Yano M, Ma J F. Identification of a novel major quantitative trait locus controlling distribution of Cd between roots and shoots in rice., 2009, 50(12): 2223-2233.
[28] Uraguchi S, Mori S, Kuramata M, Kawasaki A, Arao T, Ishikawa S. Root-to-shoot Cd translocation via the xylem is the major process determining shoot and grain cadmium accumulation in rice., 2009, 60(9): 2677-2688.
[29] Tezuka K, Miyadate H, Katou K, Kodama I, Matsumoto S, Kawamoto T, Masaki S, Satoh H, Yamaguchi M, Sakurai K, Takahashi H, Satoh-Nagasawa N, Watanabe A, Fujimura T, Akagi H. A single recessive gene controls cadmium translocation in the cadmium hyper- accumulating rice cultivar Cho-Ko-Koku., 2010, 120(6): 1175-1182.
[30] Ueno D, Yamaji N, Kono I, Huang C F, Ando T, Yano M, Ma J F. Gene limiting cadmium accumulation in rice., 2010, 107(38): 16500-16505.
[31] Miyadate H, Adachi S, Hiraizumi A, Tezuka K, Nakazawa N, Kawamoto T, Katou K, Kodama I, Sakurai K, Takahashi H, Satoh-Nagasawa N, Watanabe A, Fujimura T, Akagi H. OsHMA3, a P1B-type of ATPase affects root-to-shoot cadmium translocation in rice by mediating efflux into vacuoles., 2011, 189(1): 190-199.
[32] Sasaki A, Yamaji N, Ma J F. Overexpression ofenhances Cd tolerance and expression of Zn transporter genes in rice., 2014, 65(20): 6013-6021.
[33] Liu C L, Gao Z Y, Shang L G, Yang C H, Ruan B P, Zeng D L, Guo L B, Zhao F J, Huang C F, Qian Q. Natural variation in the promoter ofcontributes to differential grain cadmium accumulation betweenandrice., 2019, doi: 10.1111/jipb.12794.
[34] Sui F, Zhao D, Zhu H, Gong Y, Tang Z, Huang X Y, Zhang G, Zhao F J. Map-based cloning of a new total loss-of-function allele ofcausing high cadmium accumulation in rice grain., 2019, doi: 10.1093/jxb/erz093
[35] Huang Y, Sun C, Min J, Chen Y, Tong C, Bao J. Association mapping of quantitative trait loci for mineral element contents in whole grain rice (L.)., 2015, 63(50): 10885-10892.
[36] Sun L, Xu X, Jiang Y, Zhu Q, Yang F, Zhou J, Yang Y, Huang Z, Li A, Chen L, Tang W, Zhang G, Wang J, Xiao G, Huang D, Chen C. Genetic diversity, rather than cultivar type, determines relative grain Cd accumulation in hybrid rice., 2016, 7: 1407.
[37] Xue D W, Chen M C, Zhang G P. Mapping of QTLs associated with cadmium tolerance and accumulation during seedling stage in rice (L)., 2009, 165(3): 587-596.
[38] Luo J S, Huang J, Zeng D L, Peng J S, Zhang G B, Ma H L, Guan Y, Yi H Y, Fu Y L, Han B, Lin H X, Qian Q, Gong J M. A defensin-like protein drives cadmium efflux and allocation in rice., 2018, 9(1): 645.
[39] Ishikawa S, Ishimaru Y, Igura M, Kuramata M, Abe T, Senoura T, Hase Y, Arao T, Nishizawa N K, Nakanishi H. Ion-beam irradiation, gene identification, and marker-assisted breeding in the development of low-cadmium rice., 2012, 109(47): 19166-19171.
[40] Yan Y F, Lestari P, Lee K J, Kim M Y, Lee S H, Lee B W. Identification of quantitative trait loci for cadmium accumulation and distribution in rice ()., 2013, 56(4): 227-232.
[41] Liu W Q, Pan X W, Li Y C, Duan Y H, Min J, Liu S X, Liu L C, Sheng X N, Li X X. Identification of QTLs and validation ofassociated with grain cadmium concentrations in rice ., 2019, 26(1): 42-49.
[42] Abe T, Nonoue Y, Ono N, Omoteno M, Kuramata M, Fukuoka S, Yamamoto T, Yano M, Ishikawa S. Detection of QTLs to reduce cadmium content in rice grains using LAC23/Koshihikari chromosome segment substitution lines., 2013, 63(3): 284-291.
[43] Bughio N, Yamaguchi H, Nishizawa N K, Nakanishi H, Mori S. Cloning an iron-regulated metal transporter from rice., 2002, 53(374): 1677-1682.
[44] Nakanishi H, Ogawa I, Ishimaru Y, Mori S, Nishizawa N K. Iron deficiency enhances cadmium uptake and translocation mediated by the Fe transporters OsIRT1 and OSIRT2 in rice., 2006, 52(4): 464-469.
[45] Lee S, An G. Over-expression of OsIRT1 leads to increased iron and zinc accumulations in rice., 2009, 32(4): 408-416.
[46] Takahashi R, Ishimaru Y, Senoura T, Shimo H, Ishikawa S, Arao T, Nakanishi H, Nishizawa N K. The OsNRAMP1 iron transporter is involved in Cd accumulation in rice., 2011, 62(14): 4843-4850.
[47] Ishimaru Y, Takahashi R, Bashir K, Shimo H, Senoura T, Sugimoto K, Ono K, Yano M, Ishikawa S, Arao T, Nakanishi H, Nishizawa N K. Characterizing the role of rice NRAMP5 in manganese, iron and cadmium transport., 2012, 2(6071): 286.
[48] Yang M, Zhang Y, Zhang L, Hu J, Zhang X, Lu K, Dong H, Wang D, Zhao F J, Huang C F, Lian X. OsNRAMP5 contributes to manganese translocation and distribution in rice shoots., 2014, 65(17): 4849-4861.
[49] Tang L, Mao B, Li Y, Lv Q, Zhang L, Chen C, He H, Wang W, Zeng X, Shao Y, Pan Y, Hu Y, Peng Y, Fu X, Li H, Xia S, Zhao B. Knockout ofusing the CRISPR/Cas9 system produces low Cd-accumulating indica rice without compromising yield., 2017, 7(1): 14 438.
[50] Clemens S, Ma J F. Toxic heavy metal and metalloid accumulation in crop plants and foods., 2016, 67(1): 489-512.
[51] Lu C, Zhang L, Tang Z, Huang X Y, Ma J F, Zhao F J. Producing cadmium-freerice by overexpressing OsHMA3., 2019, 126: 619-626.
[52] Takahashi R, Ishimaru Y, Shimo H, Ogo Y, Senoura T, Nishizawa N K, Nakanishi H. The OsHMA2 transporter is involved in root-to-shoot translocation of Zn and Cd in rice., 2012, 35(11): 1948-1957.
[53] Satoh-Nagasawa N, Mori M, Nakazawa N, Kawamoto T, Nagato Y, Sakurai K, Takahashi H, Watanabe A, Akagi H. Mutations in rice () heavy metal atpase 2 (OsHMA2) restrict the translocation of zinc and cadmium., 2012, 53(1): 213-224.
[54] Hao X, Zeng M, Wang J, Zeng Z, Dai J, Xie Z, Yang Y, Tian L, Chen L, Li D. A node-expressed transporter OsCCX2 is involved in grain cadmium accumulation of rice., 2018, 9: 476.
[55] Uraguchi S, Kamiya T, Sakamoto T, Kasai K, Sato Y, Nagamura Y, Yoshida A, Kyozuka J, Ishikawa S, Fujiwara T. Low-affinity cation transporter (OsLCT1) regulates cadmium transport into rice grains., 2011, 108(52): 20 959-20 964.
[56] Uraguchi S, Kamiya T, Clemens S, Fujiwara T. Characterization of OsLCT1, a cadmium transporter fromrice., 2014, 151(3): 339-347.
[57] Zhao F Y, Han M M, Zhang S Y, Wang K, Zhang C R, Liu T, Liu W. Hydrogen peroxide-mediated growth of the root system occurs via auxin signaling modification and variations in the expression of cell-cycle genes in rice seedlings exposed to cadmium stress., 2012, 54(12): 991-1006.
[58] Shimo H, Ishimaru Y, An G, Yamakawa T, Nakanishi H, Nishizawa N K. Low cadmium (), a novel gene related to cadmium tolerance and accumulation in rice., 2011, 62(15): 5727-5734.
[59] Lan H X, Wang Z F, Wang Q H, Wang M M, Bao Y M, Huang J, Zhang H S. Characterization of a vacuolar zinc transporter OZT1 in rice (L.)., 2013, 40(2): 1201-1210.
[60] Song W Y, Lee H S, Jin S R, Ko D, Martinoia E, Lee Y, An G, Ahn S N. Rice PCR1 influences grain weight and Zn accumulation in grains., 2015, 38(11): 2327-2339.
[61] Oda K, Otani M, Uraguchi S, Akihiro T, Fujiwara T. Rice ABCG43 is Cd inducible and confers cd tolerance on yeast., 2011, 75(6): 1211-1213.
[62] 陈彩艳, 唐文帮. 筛选和培育镉低积累水稻品种的进展和问题探讨. 农业现代化研究, 2018, 39(6): 1044-1051.
Chen C Y, Tang W B. A perspective on the selection and breeding of low-Cd rice., 2018, 39(6): 1044-1051. (in Chinese with English abstract)
[63] Liu C L, Chen G, Li Y, Peng Y L, Zhang A P, Hong K, Jiang H Z, Ruan B P, Zhang B, Yang S L, Gao Z Y, Qian Q. Characterization of a major QTL for manganese accumulation in rice grain., 2017, 7(1): 17704.
Research Advances on Molecular Genetic Mechanism for Cadmium Absorption and Transportation in Rice
DING Shilin, LIU Chaolei, QIAN Qian, GAO Zhenyu*
(,,,;Corresponding author,:)
Cadmium is one of the heavy metals with serious toxicity to human health. The main source of cadmium in the human body is the consumption of rice with high levels of cadmium. Therefore, it is important to clarify the genetic mechanism of cadmium uptake, transport and accumulation in rice. So far, although the genetic pathway of cadmium accumulation has not been fully clarified in rice, the regulatory role of some genes in cadmium accumulation has been testified. Here, we briefly summarize the harm of cadmium stress on rice, the variation of cadmium accumulation among rice varieties, QTLs associated with cadmium accumulation in rice, genes related to cadmium absorption and transport, and application of them in rice breeding. Perspectives and research contents in the future were also advanced.
rice (); cadmium; absorption; transportation; molecular genetic mechanism
Q945.78; S511.034
A
1001-7216(2019)05-0383-08
10.16819/j.1001-7216.2019.9040
2019-04-08;
2019-06-16。
国家自然科学基金资助项目(31671761)。

