热休克蛋白65对小鼠溃疡性结肠炎的作用机制研究*
李小余,王莎,董颖,马旭东,王伟伟,韩江余,邵圣文
(湖州师范学院医学院 微生物与免疫学研究所,浙江 湖州 313000)
炎症性肠病(inflammatory bowel disease,IBD)在临床上包括2 个独立的疾病,即溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn's disease)[1]。目前关于IBD 的病因尚不很清楚,较为普遍的看法是遗传易感性、免疫异常、肠道菌群共同参与IBD 发病。UC 发病在我国逐年呈上升趋势[2-3]。有学者认为,UC属于自身免疫病范畴,患者自身免疫反应异常是UC发病的重要因素[4]。UC 疾病具有易复发、易慢性化的特点,在临床上易演变成慢性迁延性疾病,给临床治疗带来困难。目前还没有完全治愈UC 的药物。关于UC 治疗药物和方法的研究一直为临床所重视。有研究指出,热休克蛋白(heat schock protein,HSP)家族成员之一的HSP65 蛋白具有免疫调节功能[5]。本研究探讨HSP65 蛋白是否通过调节性T 细胞(regulatory T cells,Treg)对UC 小鼠产生免疫调节作用,从而抑制小鼠肠道炎症反应,使得小鼠UC 疾病得以缓解,现报道如下。
1 材料与方法
1.1 动物与试剂
68 只C57BL/6 小鼠,雄性,8 周龄,体重18~20 g,合格证编号201703199,购自常州卡文斯实验动物有限公司[许可证SCXK(苏)2016-0010]。PE 标记的抗小鼠CD4 单抗(cat100407)、APC 标记的抗小鼠FoxP3单抗(cat137221)、PE/Cy7 标记的抗小鼠CD25 单抗(cat101915)、FITC 标记的抗小鼠CD3 单抗(cat100305)为美国Biolegend 公司产品。HSP65 蛋白为本实验室自行制备。细胞流式分析采用美国BD 公司的FACS Canto流式细胞仪,数据分析应用FlowJo 软件。
1.2 UC 小鼠模型复制
随机选取62 只C57BL/6 小鼠,适应性饲养3 d 后开始模型复制,每天给予3.5%葡聚糖硫酸钠(DSS,相对分子质量36~50 kD)的灭菌水自由饮用,连续饮用7 d,第8 天起按无特定病原体(SPF)级要求继续饲养14 d,从存活小鼠中随机取2 只处死,取结肠组织行病理检查,结合小鼠UC 疾病活动指数(disease activity index,DAI)评分,验证UC 小鼠模型复制成功。
1.3 HSP65 治疗UC 小鼠
6 只健康小鼠设为正常对照组(A组)。48 只UC小鼠随机分成4组(各12 只):UC 模型对照组(B组)、低剂量组(C组)、中剂量组(D组)及高剂量组(E组)。A组和B组灌胃给予磷酸盐缓冲液(PBS),C组、D组、E组小鼠分别灌胃给予HSP65 0.5、2.5 及 5.0 mg/kg。每隔1 天灌胃1 次,共7 次。灌胃期间,按SPF 要求常规饲养,末次灌胃后继续饲养2 d。每天观察记录各组小鼠体重和大便性状、便血情况,参照文献计算DAI[6]。
1.4 小鼠检测样品取材
末次灌胃后饲养2 d,腹腔注射氯胺酮后,心脏取血处死小鼠。心脏穿刺取血后分离血清和血液有核细胞,分离小鼠脾脏和肠系膜淋巴结,分别置于无菌平皿中,研碎后提取有核细胞;距回盲部约2 cm 处,取结肠中段组织2 块,分别采用4%甲醛固定及-80℃冰箱冷冻保存备用。
1.5 HE 染色检查及病理评分
结肠中段组织超薄切片后行HE 染色,光学显微镜检查病理学变化情况,参照文献[7]进行结肠组织病理评分。
1.6 流式细胞术检测CD4+CD25+Foxp3+Treg 细胞
小鼠脾细胞、淋巴结细胞分离:组织用无菌毛玻璃片研磨1~2 次,200 目滤网过滤,1 500 r/min 离心5 min,弃上清液;加入1 ml 预冷的红细胞裂解液,冰上 裂解5 min,70 μm 孔径细胞筛再次过滤,1 500 r/min离心5 min,弃上清液,PBS 洗涤细胞2 次,重悬细胞,调整细胞浓度为5×105个/ml 待用。全血细胞处理:向抗凝血加入1 ml 预冷的红细胞裂解液,冰上裂解5 min,其余处理步骤同脾细胞处理方法,得到血液中的有核细胞。调节以上细胞浓度为5×105个/ml,在冰上加入PE 标记的CD4 单抗,FITC 标记的CD3单 抗,PE/Cy7 标记的CD25 单抗,4 ℃避光孵育30 min;染色结束后,PBS 洗涤,4%多聚甲醛重悬细胞,4℃孵育20 min;0.1%皂素4℃孵育20 min,细胞破膜;PBS 洗涤2 次,加入APC 标记的Foxp3 单抗,4℃孵育20 min,洗涤2 次,流式细胞仪收集数据进行分析:CD4+T 细胞数,CD4+CD25+Foxp3+Treg 细胞数,计算Treg 细胞数占CD4+T 细胞数的比例。
1.7 统计学方法
数据分析采用SPSS 16.0 软件。计量资料以均 数±标准差(±s)表示,比较采用重复测量设计的方差分析,组间比较采用Dunnett T3 法,独立测量数据两两比较采用独立样本t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 小鼠疾病活动指数
不同剂量HSP65 治疗UC 小鼠的DAI 评分见表1,结果显示:①不同时间点的小鼠DAI 评分有差异(F= 374.465,P=0.000);②各组小鼠DAI 评分有差异(F=57.057,P=0.000),HSP65 治疗UC 小鼠14 d 后,D组和E组小鼠DAI 评分均低于B组小鼠(P<0.05),E组小鼠DAI 评分低于D组(P<0.05);③HSP65 治疗UC 小鼠14 d 后,各组小鼠DAI 评分变化趋势有差异(F=64.895,P=0.000)。
表1 各组小鼠DAI 评分的比较(n =12,±s)

表1 各组小鼠DAI 评分的比较(n =12,±s)
组别 第1 天 第14 天B组 3.84±0.19 3.66±0.39 C组 3.87±0.18 3.07±0.15 D组 3.78±0.21 1.50±0.43 E组 3.82±0.31 0.83±0.31
2.2 小鼠结肠组织病理改变情况
A组小鼠结肠组织结构正常;B组小鼠结肠组织黏膜结构破坏严重,隐窝结构破坏,黏膜下和肌肉层大量细胞浸润;C组小鼠结肠组织黏膜结构有中度损伤,黏膜下和肌肉层有中等程度细胞浸润;D 和E组,小鼠结肠组织结构基本正常,黏膜下和肌肉层有少量细胞浸润。见图1。
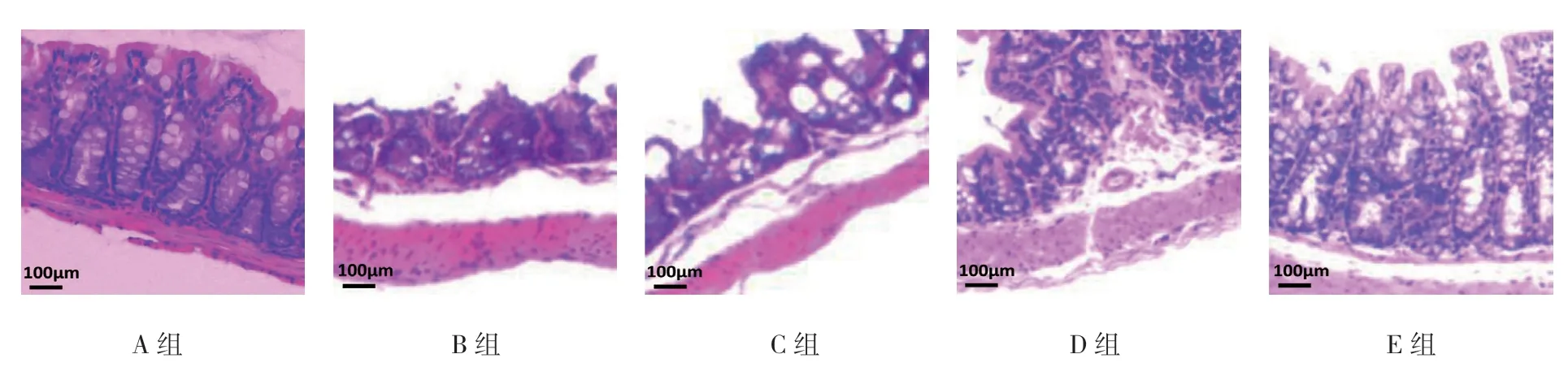
图1 小鼠结肠组织病理检查结果(HE×100)
HSP65 治疗UC 小鼠14 d 后,各组小鼠结肠病理评分有差异(F=68.641,P=0.000);C、D 及E组小鼠 的结肠组织病理评分分别为(3.20±0.42)、(1.80± 0.79)及(1.10±0.57)分,均低于B组(3.70±0.48)分(P<0.05);E组小鼠的结肠组织病理评分低于C、D组(P<0.05),D组小鼠结肠组织病理评分低于C组(P<0.05)。
2.3 小鼠血液、脾脏、淋巴结CD4+CD25+Foxp3+表型的Treg 细胞比例
HSP65 治疗14 d 后,各组小鼠的血液、脾脏以及肠系膜淋巴结中CD4+CD25+Foxp3+表型的Treg 细胞检测结果见表2。①各组小鼠血液Treg 细胞比例有差异(F=4.678,P=0.006),与A组比较,B、C、D、E组小鼠血液Treg 细胞比例均降低(P<0.05);②各组小鼠脾脏Treg 细胞比例有差异(F=5.786,P=0.002),与A组比较,B、C、D、E组小鼠脾脏Treg 细胞比例均降低(P<0.05);③各组小鼠肠系膜淋巴结Treg 细胞比例有差异(F=8.579,P=0.000),与A组比较,B、C组小鼠肠系膜淋巴结Treg 细胞比例降低(P<0.05),与B组比较,C、D、E组小鼠肠系膜淋巴结Treg 细胞比例升高(P<0.05)。
表2 各组小鼠血液、脾脏、淋巴结中的Treg 细胞 比例比较(%,±s)

表2 各组小鼠血液、脾脏、淋巴结中的Treg 细胞 比例比较(%,±s)
注:①与A组比较,P <0.05;②与B组比较,P <0.05。
淋巴结Treg 比例A组 6 5.29±1.78 10.46±1.21 10.96±1.19 B组 12 3.06±0.81① 7.52±1.10① 6.29±1.41①C组 12 3.15±0.97① 8.13±1.05① 9.12±0.97①②D组 12 3.32±0.74① 8.65±0.91① 9.79±1.52②E组 12 3.20±0.65① 8.83±1.30① 10.07±2.10②组别 n 血液Treg 比例脾脏Treg 比例
3 讨论
HSP 家族蛋白广泛存在于真核及原核生物细胞中。一般而言,当细胞处于应激状态时,HSP 家族蛋白启动表达,发挥保护细胞之功能。HSP 家族蛋白成员众多,包括HSP60、HSP70、HSP90 等家族蛋白。HSP60 家族蛋白成员包括哺乳动物来源的HSP60 蛋白和结核杆菌HSP65 蛋白,两者高度同源,能够发生交叉免疫反应[8]。国外学者发现,在UC 患者结肠黏膜组织内,包括HSP60、HSP10、HSP70、HSP90 蛋白在内的多种HSP 家族蛋白异常增多,这些异常增多的HSP 家族蛋白通过分子模拟机制激活机体免疫系统,诱导机体产生针对结肠黏膜组织的异常自身免疫应答,造成结肠黏膜组织发生炎症反应,患者则出现相应的UC 临床症状[9-10]。
已有研究表明,口服HSP60 蛋白或HSP65 蛋白,可以缓解自身免疫性疾病[5]。有学者报道,对ApoE基因敲除小鼠,通过高脂饮食饲养复制动脉粥样硬化模型,实验组小鼠在高脂饮食同时口服给与HSP60 蛋白,实验组小鼠大动脉根部的粥样斑块大小比模型组减小,实验组小鼠血浆IL-10 比模型组增加,实验组小鼠血浆Ⅱ型干扰素(IFN-γ)比模型组减少,表明口服HSP60 蛋白可以使小鼠动脉内的粥样斑块减小,同时可以抑制小鼠体内的炎症反应[11]。本研究结果证实,HSP65 蛋白可以改善UC 小鼠的疾病活动指数,使UC 小鼠病变的结肠组织结构基本恢复正常。本研究还观察到,HSP65 蛋白对UC 小鼠的治疗效应跟HSP65 蛋白之间存在剂量依赖性。考虑到治疗成本和依从性,笔者建议治疗方案为:HSP65 蛋白以2.5 mg/kg体重的剂量灌胃UC 小鼠,1 次/d,间隔1 d,连续7 次。
Treg 细胞属于CD4+T 细胞亚群,主要通过抑制效应T 细胞的免疫活性而发挥负向免疫调节作用,在维持免疫耐受、抑制过度炎症反应和免疫病理方面有重要作用[12-13]。Treg 细胞包括2 种表型,即静止Treg 细胞和活化Treg 细胞。核转录因子叉头蛋白(forkhead box p3,Foxp3)是活化Tregs 细胞的特异性标志[13]。当静止Treg 细胞开始表达Foxp3,细胞转变成活化Treg细胞,细胞表型也由静止Treg 细胞(CD4+CD25+表型)转变为活化Treg 细胞(CD4+CD25+Foxp3+表型)。活化Treg 细胞能够分泌抑制性细胞因子白细胞介素-10(IL-10)和转化生长因子-β(TGF-β),抑制效应性T 细胞的功能,进而阻止或减轻炎症反应[13]。
本研究显示,UC 小鼠给予HSP65 蛋白后,小鼠血液和脾脏组织中的活化Treg 细胞比例未发生改变,但是小鼠肠系膜淋巴结中的活化Treg 细胞比例增加。由此,笔者认为,HSP65 蛋白是通过诱导UC 小鼠肠系膜淋巴结中的活化Treg 细胞比例增加来实现。接下来的问题是:UC 小鼠给予HSP65 后,肠系膜淋巴结中增多的活化Treg 细胞来源是哪里?由于小鼠血液和脾脏组织中的活化Treg 细胞比例未发生明显改变,这就排除肠系膜淋巴结中增多的活化Treg 细胞是从血液和脾脏组织迁移而来的可能。那么,肠系膜淋巴结中增多的活化Treg 细胞很可能是由肠系膜淋巴结中的静止Treg 细胞转化而来。
总之,采用灌胃方式给予HSP65 蛋白可以缓解小鼠溃疡性结肠炎,其中可能的机制是:HSP65 蛋白通过激活小鼠肠系膜淋巴结中的静止Treg 细胞,使之转变成活化Treg 细胞,进而增加小鼠肠系膜淋巴结中的活化Treg 细胞比例,随后通过活化Treg 细胞分泌抑制性细胞因子,从而发挥抑制肠道炎症反应作用。

