采用聚丙烯酰氨凝胶电泳技术鉴别龟甲及其混伪品△
徐清,李梦,罗雪梅,孟杰亲,张帆,陈秀芬,刘春生,杨瑶珺*
1.北京中医药大学 中药学院,北京 102488;2.中国中医科学院 中药资源中心,北京 100700
龟甲为龟科动物乌龟Chinemysreevesii(Gray)的背甲及腹甲,具有滋阴潜阳、益肾强骨、养血补心、固精止汗的作用,用于阴虚潮热、骨蒸盗汗、头晕目弦、虚风内动、筋骨痿软、心虚健忘、崩漏经多等症[1]。
龟甲及其混伪品药材在活体动物上的鉴别有很强的鉴别特性,易于区分,但在处理成龟甲药材时或在处理成粉末时,带有鉴别特征的龟甲条纹外层部分易脱落,增加了性状鉴别的难度[2-4]。2015版《中华人民共和国药典》中规定的龟甲鉴别方法为薄层色谱法,通过查阅相关文献[5-7]及前期实验,发现薄层色谱法对不同品种龟甲的鉴别有一定局限性,高效液相色谱法分析时间较长且操作较复杂,故笔者采用SDS-PAGE电泳技术对龟甲及其混伪品的蛋白质条带进行初步鉴别,从蛋白水平上对其进行鉴别研究。
1 材料
1.1 样品
样品为来自表1中不同产地及批次的共53批龟甲及混伪品药材,其中35批龟甲为正品龟甲,经北京中医药大学杨瑶珺教授鉴定,均为龟科动物乌龟Chinemysreevesii(Gray)的背甲及腹甲。
1.2 仪器
电泳仪(型号AE-8135,ATTO公司);电泳槽(型号Tetra System,Bio-Rad);玻璃板(长板/短板,Bio-Rad);灌胶架(型号1653304,Bio-Rad);加样梳[10孔(1 mm)(Bio-Rad)];超声清洗器(型号KQ5200E,昆山市超声仪器有限公司);冷冻离心机(3K-15低温高速离心机,SIGMA公司);脱色摇床(型号TS-1,其林贝尔仪器销售公司);玻璃培养皿(型号100 mm,北京高华伟业食品添加剂有限公司)。
1.3 试剂
蒸馏水(规格4.5 L,广州屈臣氏食品饮料有限公司);SDS(规格100 g,北京博迈德科技发展有限公司);三羟甲基氨基甲烷(规格500 g,北京化工厂);盐酸(规格100 mL,北京化工厂);丙烯酰胺(规格100 g,北京化工厂);甘氨酸(规格500 g,北京化工厂);蔗糖(规格500 g,北京化工厂);考马斯亮蓝G250(规格25 g,北京化工厂);蛋白Marker(规格20次,北京拜尔迪生物技术有限公司);四甲基乙二胺(规格50 mL,北京拜尔迪生物技术有限公司);4×样品缓冲液(规格5 mL,北京拜尔迪生物技术有限公司);Ripa裂解液(规格50 mL,北京拜尔迪生物技术有限公司);胰蛋白酶(规格1 g,北京拜尔迪生物技术有限公司)。

表1 龟甲样品信息
2 方法
2.1 样品制备
取研磨后的正品龟甲细粉样品,用液氮再次研细,精密称取20 mg,加入4×蛋白质Loading Buffer 100 μL,双蒸水300 μL,将其稀释成1×的缓冲液,100 ℃水浴10~20 min,冷却后,用冷冻离心机14 000 r·min-1离心10 min,取上清液至1.5 mL离心管中,存放至4 ℃环境备用。
2.2 胶板制备
2.2.1 分离胶(12%)和浓缩胶(5%)的配制 按表2配制十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE),过硫酸铵(APS)和四甲基乙二胺(TEMED)(需要在最后向制胶器中倒入凝胶前再加),加的时候要迅速,防止胶提前凝固。所需试剂及具体用量见表2。

表2 SDS-PAGE配制所需试剂 mL
注:—表示不添加试剂。
2.2.2 胶板的制备 用蒸馏水将玻璃板冲洗干净并晾干。按照装置的说明书组装好制胶器,用水检测是否漏水。吸取配好的12%离胶,注入两玻璃板之间至约占整个板的四分之三的高度。待分离胶凝固好,倒净两块玻璃板中剩余的液体,注满5%的浓缩胶,插入梳子,放置2 h以上。待浓缩胶完全凝固后缓慢拔出梳子,用电泳缓冲液填满点样孔准备点样。
2.2.3 SDS-PAGE电泳 将离心得到的上清样品与4× Protein Loading buffer按照3∶1的比例充分混匀。涡旋混匀后,沸水浴15~20 min使蛋白变性,沸水浴之后立即放置冰上冷却2 min,再用14 000 r·min-1离心2 min。将离心之后的上清液进行点样(10 μL),先用80 V的电压使蛋白条带跑过浓缩胶,再调整电压至120 V,待蛋白条带跑到玻璃板底部即可停止跑胶。
2.2.4 胶板的染色与脱色 将胶小心地从玻璃板中取出,用考马斯亮蓝染色液染色,振荡过夜。倒出染色液,将胶放入脱色液中,多次振荡脱色,直到蛋白条带清晰,蓝色背景脱掉为止。将凝胶拍照并保存。
3 结果
3.1 龟甲背甲及腹甲药材的SDS-PAGE
通过对不同品种龟甲背甲与腹甲的SDS-PAGE电泳实验发现,对于同一品种的龟甲,其背甲与腹甲的蛋白质亚基相似,电泳得到的蛋白质条带几乎无明显差别,难以通过一维电泳方法对龟甲的背甲与腹甲进行区分。在本实验中其蛋白质亚基几乎没有区别,以至于蛋白条带几乎相同,同时也意味着在后续本实验中无需将龟甲背甲与腹甲分开进行讨论。

图1 2a2b对比图

图2 3a3b对比图

图3 4a4b对比图
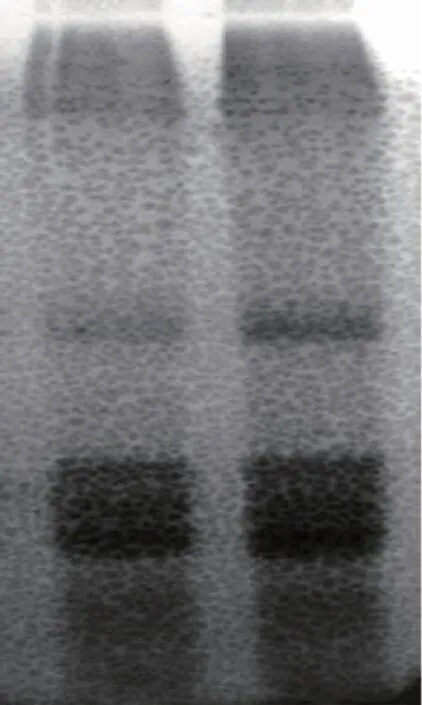
图4 5a5b对比图
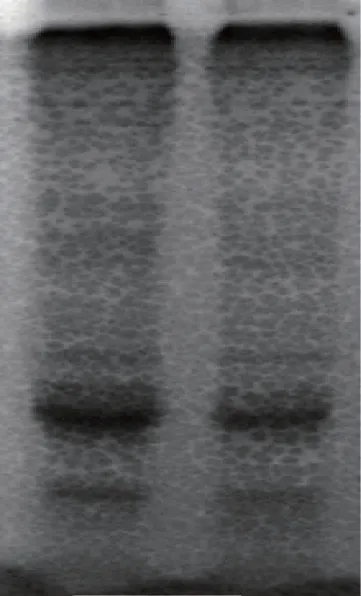
图5 6a6b对比图

图6 13a13b对比图
3.2 不同批次正品龟甲的SDS-PAGE
通过得到的电泳图发现(见图7~8),该20批正品龟甲药材分离得到的蛋白亚基几乎相同,即正品龟甲在一维电泳中显现出的蛋白亚基条带差异性很小,其得到的蛋白条带及蛋白分离情况不易受产地、批次等因素影响,同时也可看出龟甲的一维电泳实验有较强的稳定性与重现性。

图7 1~10批正品龟甲电泳胶图

图8 11~20批正品龟甲电泳胶图
3.3 正品及伪品龟甲药材的SDS-PAGE
结果见图9。
通过比较分析图9,可以看出各品种龟甲的蛋白条带各有差异,蛋白亚基的分子质量均在10~200 kDa。在63~180 kDa,12个品种的龟甲蛋白质条带相似,无明显区别;在15~63 kDa,各品种的龟甲蛋白质条带有明显区别;在11~15 kDa以及11 kDa以下,各品种的龟甲几乎无明显蛋白条带,难以进行区分。故可以推测各品种龟甲分离出的蛋白在63 kDa以上的大分子量范围内很相似,可能有很多共同蛋白。若想计算某一蛋白条带的蛋白分子量,对蛋白Marker条带进行迁移率的计算并与对应的蛋白分子量做标准曲线,得到方程即可知道未知条带的蛋白分子量。


注:1.为正品;5、3、6~14.为伪品。图9 正品及混伪品龟甲电泳胶图
正品龟甲(样品1)除遵守上述规律外,还可以观察到在42 kDa蛋白分子量附近,有明显的蛋白条带,以及在25 kDa附近,有两条很细的颜色稍浅的蛋白条带且几乎连在一起,在21 kDa附近,有一条较粗的颜色稍深的蛋白条带,在14~19 kDa,有3条高丰度蛋白聚合在一起,这“二细一粗三聚合”的条带群,可以初步作为鉴别正品龟甲和其他龟甲混伪品的依据,因为通过上述多次平行及对比实验,发现正品龟甲的蛋白条带均能满足这一特点,故将这部分蛋白条带与其他品种的龟甲进行区分。
为了更好地观察各品种龟甲的蛋白条带,对所得胶图蛋白条带尤其是差异明显的15~63 kDa部分进行条带归类分析,有条带记为1,无条带记为0,以Marker及特征明显的蛋白分子量为准来观察各品种龟甲在不同位置下是否也有同等分子量的蛋白条带,具体信息见表3。
对比电泳胶图及归类整理后的蛋白条带归类表,可以发现蛋白分子量在63 kDa以上时无法将各品种龟甲鉴别开,且在135、130、65 kDa等蛋白分子量位置上,各品种龟甲均有相同条带。对上述数据进行聚类分析,通过得到的聚类树状图可以对上述12品种的龟甲蛋白条带信息进行进一步分析,从而更好地对龟甲及其混伪品进行鉴别。分析见图10。

表3 样品蛋白条带有无情况
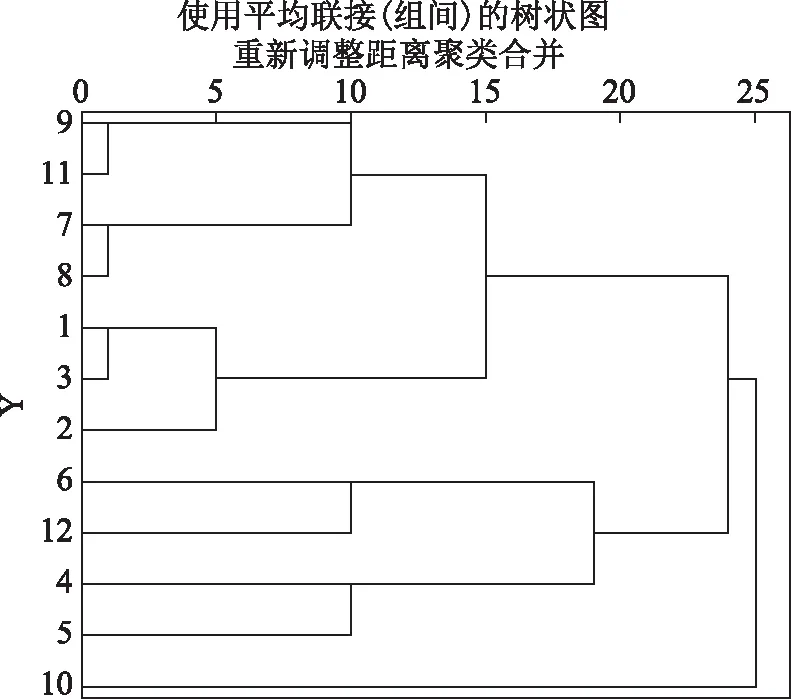
图10 龟甲及其混伪品药材蛋白条带聚类图
聚类分析结果:以不同品种龟甲蛋白条带谱的相似系数为距离,采用系统聚类法对以上数据进行聚类,得到的结果与胶图的蛋白条带以及对蛋白条带的分析结果均相似,根据各品种(系)间遗传距离的远近来统计分析,同一组内各品种(系)间遗传距离较近,不同组间各品种(系)遗传距离较远。故样品9、11为一组,7、8为一组,1、3为一组,这3组样品的相似性较高,其次样品6、12为一组,4、5为一组,这两组样品的相似性较差。
4 讨论
对采集的不同产地及批次的多批正品龟甲药材进行电泳实验,发现其分离得到的蛋白条带几乎相同,蛋白亚基条带差异性很小,即同一品种的龟甲其蛋白分离得到的条带难以受产地、批次等因素影响,有较强的稳定性和重现性。
对聚类结果进行观察,发现分到同一组的样品可能由于种属比较近似,如1号样品乌龟为龟科水龟属,3号样品黄喉拟水龟为龟科拟水龟属;7号样品小鳄龟与8号样品大鳄龟均为鳄龟科鳄龟属,可能其相似性较多以至于电泳的条带比较相似,因此将电泳得到的龟甲的蛋白条带谱特征部分作为不同品种龟甲分类的补充依据的同时,要注意是否存在电泳条带相似的黄喉拟水龟龟甲药材。
———在龟甲、兽骨上刻字的朝代

