八重绯寒樱组培工厂化技术研究
陈齐明


摘要:阐述了八重绯寒樱的工厂化育苗技术。以萌芽条茎段为外植体材料,研究不同培养基和植物生长调节剂组合对八重绯寒樱组培快繁的影响,试验研究结果表明:八重绯寒樱较好的诱导培养基为:MS+6BA 0.8 mg·L-1+IBA 0.3 mg·L-1+ NAA 0.5 mg·L-1+白糖30 g·L-1+卡拉胶5.8 g·L-1,诱导率达91.2%;继代增殖最佳培养基配方为改良MS+6BA 0.5 mg·L-1+ IBA 0.1 mg·L-1+NAA 0.3 mg·L-1+白糖30 g·L-1+卡拉胶5.8 g·L-1,继代增殖系数可达38倍;根诱导最佳培养基配方为改良1/2MS+ABT 03 mg·L-1+IBA 12 mg·L-1+白糖30 g·L-1+卡拉胶58 g·L-1+活性炭0.2 g·L-1+L-半胱氨1 mg·L-1,生根率可達95.8%;八重绯寒樱的最佳组培苗移栽基质为泥炭∶发酵杉木树皮∶珍珠岩=2∶1∶1,30 d统计的移栽成活率94.8%。
关键词:八重绯寒樱;工厂化育苗;组织培养;继代培养;生根培养
中图分类号:S753文献标识码:A文章编号:1004-3020(2019)05-0013-05
Study on the Tissue Culture and Factorybased Seedling Technology
of Cerasus campanulata Maxim. ‘DoublefloweredChen Qiming
(Xinmin Seedling Limitted Company of Fujian ProvinceFuqing350301)
Abstract: This paper expounds the factory nursery technology of Cerasus campanulata Maxim. ‘Doubleflowered. Using the sprouted stem segments as explant materials, we studied the effects of the combinations of different media and plant growth regulators on the rapid propagation of Cerasus campanulata Maxim. ‘Doubleflowered by tissue culture. The results indicate that: The preferred induction medium is MS+6BA 0.8 mg·L-1+IBA 0.3 mg·L-1+ NAA 0.5 mg·L-1+white sugar 30 g·L-1+carrageenan 5.8 g·L-1, and the induction rate is as high as 91.2%; The optimal medium for subculture is modified MS+6BA 0.5 mg·L-1+IBA 0.1 mg·L-1+NAA 0.3 mg·L-1+white sugar 30 g·L-1+carrageenan 5.8 mg·L-1,and the subculture coefficient can reach 3.8 times; The optimal medium for root induction is improved 1/2MS+ABT 0.3 mg·L-1+IBA 1.2 mg·L-1+white sugar 30 g·L-1+carrageenan 5.8 mg·L-1+activated carbon 0.2 g·L-1+L-Cysteine 1 mg·L-1,and the rooting rate can reach 95.8%; The best tissue culture seedling transplanting substrate is peat∶ fermented fir bark∶ perlite = 2∶1∶1, and the 30day transplant survival rate reached 948%.
Key words:Cerasus campanulata Maxim. ‘Doubleflowered;factory nursery;tissue culture;multiplication culture;rooting culture
八重绯寒樱Cerasus campanulata Maxim.‘Doubleflowered系福建山樱花C.campanulata少数几个改良品种之一[1], 属落叶性小乔木或中乔木,树形圆整,每年冬末春初开花,先花后叶,花呈下垂性开展,重瓣型花朵,花色浓艳,较福建山樱花单瓣种具有更喜充足光照和温暖环境,且有较好的耐高温和阴凉性,适宜东南沿海低海拔地区和其它夏季高温高湿地区种植[2]。八重绯寒樱是优良的园林观赏及景观美化的极佳树种,花重瓣,花朵大,花色艳丽,观赏价值极高,可地栽造景,孤植、数株丛植,既适用于庭院绿化美化,也可植于公园草坪之上,又可列植充当行道树使用,在公园、生态观光地等可大片群植,景色震撼,游人如织,具有广阔的开发应用前景。八重绯寒樱在台湾地区有大规模的种植,福建、广东等地近年来已引种成功,并生长良好,但因其只开花不结果[3],目前其繁殖方法主要采用嫁接繁殖的方式,嫁接虽能在较短时间内获得新植株,但嫁接所用砧木、嫁接时间与天气、嫁接方法及嫁接后的管理直接影响到嫁接的成活率,苗木培育成本较高,难于规模化生产,繁殖数量有限[4],无法满足不了市场的巨大需求。尽管目前有关福建山樱花组培的研究报道已有一些[410],但对八重绯寒樱品系组培工厂化技术研究尚未见系统地报道。本研究采用八重绯寒樱优良单株的当年生萌条为材料,进行了组织培养技术研究,包括无菌材料的建立、腋芽诱导、增殖、生根、移栽等技术内容,构建八重绯寒樱优良无性系组培快繁技术体系,为八重绯寒樱优良无性系的大规模组培苗生产提供技术支撑。
1材料与方法
1.1试验材料
本次试验材料来自福建省鑫闽种业有限公司引进台湾优良观赏花木八重绯寒樱的当年生半木质化、生长健壮、无病虫害的枝条做为外植体。
1.2试验方法
1.2.1外植体的灭菌
八重绯寒樱外植体采前先使用托布津800~1000倍喷洒,待4~5 d后,选择晴朗天气剪取八重绯寒樱桃新萌半木质化萌芽条,流水冲去表面污物,用洗衣粉及消毒粉浸泡清洗30 min后再用清水反复冲洗干净。将洗净后的嫩枝转移到超净工作台上,在无菌条件下,先用75%酒精浸30 s,再用0.1% Hgcl2液浸泡10 min,最后用无菌水冲洗4~5次。将表面灭菌后的外植体切取带芽的茎段,长2~3 cm左右,接于各种外植体诱导培养上。
1.2.2诱导培养基的筛选
以MS为基本培養基,分别附加3种主要激素成份A(6BA)、B(IBA )、C(NAA),每因素各取3个水平,即A(0.6、0.8、1.0)mg·L-1、B(0.1、0.3、0.5) mg·L-1、C(01、03、05)mg·L-1,用L9(34)正交表安排,每个处理接种30瓶,每瓶1个外植体,重复3次,培养30 d后观察统计不定芽诱导结果,统计外植体诱导出芽率。
诱导率(%)=诱导出芽(单芽或丛生芽)的外植体数÷接种的外植体数(无污染)×100
丛生芽诱导率(%)=诱导出丛生芽的外植体数÷接种的外植体数(无污染)×100
1.2.3增殖培养基的筛选
(1)基本培养基的筛选。 选用 MS、改良MS、1/2MS、1/4 MS等4种基本培养基,附加1.0 mg·L-16BA、0.1 mg·L-1NAA组合。每种培养基转接30个(丛)单芽或丛生芽。接种20天后,统计观察增殖情况。
(2)不同植物生长调节剂配比对增殖效果的影响。以(1)筛选出的培养基为基本培养基,附加不同种类不同浓度植物生长调节水平进行正交设计试验。试验选用因子、水平为:6BA采用3个浓度水平0.3、0.5、1.0 mg·L-1;IBA 采用3个浓度水平0.1、0.2、0.3 mg·L-1;NAA采用3个浓度水平0.1、0.3、0.5 mg·L-1。试验共设9个处理,每处理20瓶,每瓶放置材料3个,每处理重复3次,转接20 d后,统计在各培养基上芽苗存活率和增殖倍率,筛选适宜的植物生长调节剂浓度组合。继代培养基附加30 g·L-1白糖,5.8 g·L-1卡拉胶,pH值均调制为5.8~6.0。
1.2.4生根培养基的筛选
以1/2MS、1/4MS、改良1/2MS为基本培养基,分别添加0.3、0.6、1.2 mg·L-1的ABT和03、06、12 mg·L-1的IBA。共9个处理,每个处理重复3次,每个重复30瓶,每瓶接种10个有效芽,即每个重复300个有效芽。生根培养20 d,观察统计各培养基芽苗生根率、根系生长状况,筛选出理想的生根培养基。生根培养基附加0.2 g·L-1的活性炭 (AC),1 mg·L-1的L-半胱氨酸,30 g·L-1白糖,5.8 g·L-1卡拉胶,pH值均调制为5.8~6.0。
1.2.5组培苗的移栽
将芽段基部长有2~3条不定根的生根瓶苗移至炼苗温室里,炼苗7 d后,当生根苗高2.0 cm、根长1.0 cm以上时即可进行移栽,将小苗移栽到于不同基质处理的基质中。本研究以泥炭∶发酵杉木树皮∶珍珠岩(2∶2∶1)、腐殖土∶椰糠∶珍珠岩(2∶2∶1)、杉木木屑∶黄心土∶珍珠岩(2∶1∶1)3种基质为研究对象进行对比试验。移栽30 d后统计其存活率以及生长情况。
1.2.6培养条件
培养室温度控制在(20±2)℃ ,相对湿度60%~70%,光照强度2 000~2 500 lx,光照时间长度为12 h·d-1。
2结果与分析
2.1不同激素浓度对外植体诱导的影响
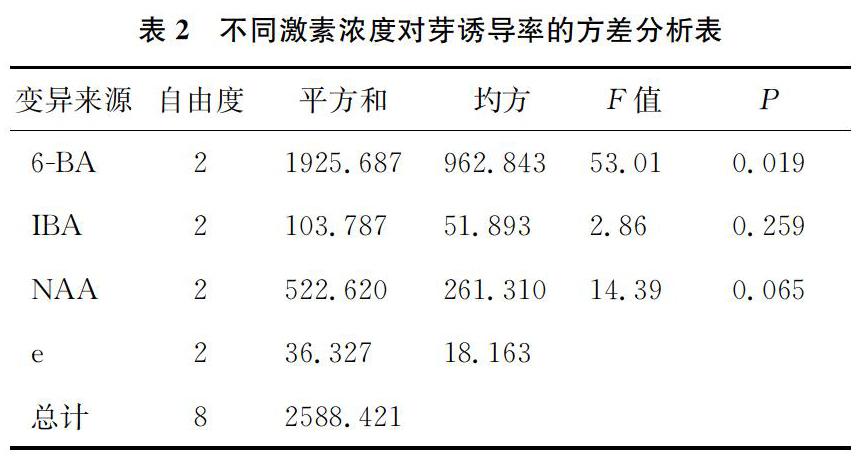
以MS培养基为腋芽诱导基本培养基,添加不同浓度的6BA、NAA、IBA进行外植体腋芽诱导培养基配方的筛选,其结果如表1所示。由表1可知,6BA的极差最大,其次是NAA,再次是IBA,说明6BA对诱导率的影响最大。从平均值看,6BA 0.8 mg·L-1、IBA 0.3 mg·L-1、NAA 0.5 mg·L-1效果最好。由此可知,八重绯寒樱诱导培养的最优培养基组合是MS + 6BA 0.8 mg· L-1+IBA 0.3 mg·L-1+ NAA 0.5 mg·L-1。由于这一组合在正交试验中没有体现,因此对这一组合进行了验证试验,用此组合进行初代培养,其诱导率可达91.2%以上。方差分析结果(表2)表明:6BA对诱导率有显著影响,而IBA、NAA对诱导率影响不显著。
2.2继代增殖培养影响
2.2.1增殖培养基本培养基的筛选
诱导培养20 d或小芽长0.4~0.5 cm即可转入继代增殖培养(初代培养),试验结果见表3。由表3可以看出,处理2的存活率和增殖培率均为最高,达到89.6%和3.8倍,且与其他处理差异显著。因此,改良MS是适宜初代培养的基本培养基。
2.2.2不同植物生长调节剂配比对增殖效果的影响
从表4可以看出,6BA的极差值最大,其次是NAA,再次是IBA,说明6BA对有效芽增殖的影响最大,其次是NAA,再次是IBA。从平均值看,
采用筛选出的培养基进行批量繁殖,芽丛的增殖率可达3.8倍,芽生长快、丛芽很多,有效苗比例高,可以不经壮苗培养直接进入生根培养。
2.3培养基及生长调节剂浓度组合对生根率的影响
9种组合培养基诱导生根结果见表6。由表6可知,从平均生根率的极差值可推断,3个因素对生根率影响的大小顺序为 IBA> 基本培养基>ABT,试验观察到附加IBA的培养基芽苗主根多、根系发达。在7号培养基改良1/2MS中取得较高的生根率,根据K值大小分析,在改良1/2MS+ABT 0.3 mg·L-1+IBA 1.2 mg·L-1条件下八重绯寒樱生根可以得到满意的效果。因此,八重绯寒樱的理想生根培养基应为:改良1/2MS+ABT 03 mg·L-1+IBA 12 mg·L-1+白糖30 g·L-1+卡拉胶5.8 g·L-1+0.2 g·L-1活性炭+L-半胱氨酸1 mg·L-1。八重绯寒樱的该培养基中的生长情况见图2。
2.4组培苗木移栽
为筛选适合于八重绯寒樱组培苗生长的移栽基我们比较了不同移栽基质对八重绯寒樱移栽成活率的影响。在9~11月季节,生根培养20 d后,将经炼苗后的组培苗移栽到不同基质中,30 d后调查移栽成活率。结果见表7。由表7可知,1号处理(泥炭:发酵杉木树皮:珍珠岩=2∶1∶1)的移栽成活率最高,30 d统计的移栽成活率94.8%。此基质配方在福建省鑫闽种业有限公司八重绯寒樱组培苗工厂化育苗生产中得到了较好的实践运用。
3小结与讨论
本研究以当年半木质化的八重绯寒樱茎段为外植体,通过不同培养基、外源激素种类和浓度等因子对重绯寒樱的芽诱导、继代增殖、生根的影响以及不同移栽基质对八重绯寒樱移栽成活率的影响等研究,系统开展了八重绯寒樱组培工厂化育苗技术研究,试验研究结果表明:八重绯寒樱较好的诱导培养基为:MS+6BA 0.8 mg·L-1+IBA 0.3 mg·L-1+NAA 0.5 mg·L-1+白糖30 g·L-1+卡拉胶5.8 g·L-1,诱导率高达];继代增殖最佳培养基配方为改良MS+6BA 0.5 mg·L-1+IBA 0.1 mg·L-1+NAA 0.3 mg·L-1+白糖30 g·L-1+卡拉胶5.8 g·L-1,继代增殖系数可达3.8倍;根诱导最佳培养基配方为活性炭0.2 g·L-1+白糖30 g·L-1+活性炭0.2 g·L-1+白糖30 g·L-1+卡拉胶5.8 g·L-1,生根率可达95.8%;八重绯寒樱的最佳组培苗移栽基质为泥炭:发酵杉木树皮:珍珠岩=2∶1∶1,30 d统计的移栽成活率94.8%。
樱花资源丰富,其野生资源和栽培种类全世界有150余种[12]。随着樱花的广泛应用,研究樱花的快速繁殖技术显得尤为重要。迄今,已有很多学者对观赏福建山樱花组织培养技术进行了研究[411],但对八重绯寒樱组培技术系统地研究未见报道,由于同一物种不同品系材料自身生物学特性差异,所需培养基种类和激素浓度存在较大差异,不同无性系(基因型)离体培养表现的差异性普遍存在[1314],其组织培养快繁体系技术也存在较大差异。因此,本研究以八重绯寒樱茎段为试验材料,筛选八重绯寒樱离体培养各阶段的适宜配方,建立八重绯寒樱组培快繁体系,可使八重绯寒樱能在短时间内快速成苗,实现大规模产业化生产,满足园林生产的需求,此研究具有重要的理论和现实意义。
组培工厂化育苗不受时间的限制,可终年生产。在实际生产产能做到终年生产,但瓶苗移栽则受到自然条件的制约。为了提高瓶苗移栽率,便于集约管理,一般要求在温室内进行,但炎热的夏季,如温室仅有遮荫和喷雾设施温室内温度仍可达40℃以上,伴随而来的是小苗失水快,补水工作量大,温室湿度大,病虫害防、治困难,移栽成活率会下降;寒冷季节如12~2月,如没有加温措施栽成活率,仅达9~11月的60%,成本相对增加了一倍[4]。本研究试验组培生根苗移栽时间集中在9~11月份,其他季节时间移栽及管理技术在今后的实践中需要继续探索,有待进一步提高。目前八重绯寒樱无性系组培苗已进入规模化繁育阶段,此研究方案已在福建省鑫闽种业有限公司福建省花卉苗木品种引进与研发创新项目中得到了较好的实践运用,已生产八重绯寒樱组培苗木达80多万株。
参考文献
[1]HUANG TC.Flora of Taiwan[C]//Committee of the Flora of Taiwan.2nd ed.Taipei:Bot Dept NTU,19931996.
[2]吕月良,陈璋,施季森.福建山樱花研究现状、开发前景与育种策略[J].南京林业大学学报(自然科学版),2006,30(1):115118.
[3]陈璋.台湾优良观赏花木八重绯寒樱嫁接繁育试验研究[J].福建林业科技,2007,34(4):2730.
[4]唐伟洲.福建山樱花优良品系组培快繁技术研究[D].广州:华南农业大学,2016.
[5]吕月良,陈璋,施季森,等.福建山樱花不定芽诱导和植株再生规模化繁殖试验[J].南京林业大学学报(自然科学版),2006,30(3):105108.
[6]邹娜,陈璋,林思祖,等.福建山樱花愈伤组织的诱导及植株再生[J].核农学报,2013,27(10):14171423.
[7]王光萍,黄敏仁.福建山樱花的组织培养及植株再生[J].南京林业大学学报(自然科学版),2002,26(2):7375.
[8]李勇,方扬辉,郑雪燕,等.福建山樱花组培快繁技术[J].林业科技开发 2015,29(1):2023.
[9]王贤荣,荣冬青.钟花樱组织培养中多因子正交试验研究[J].安徽农业大学学报,2008,35(2):169173.
[10]邹娜,曹光球,林思祖,等.观赏樱花繁殖技术研究进展[J].西南林学院学报,2007, 27(6):4246.
[11]邹娜,徐楠,曹光球,等.福建山樱花试管苗生根条件的优化[J].江西农业学报,2008,20(4):2629.
[12]王贤荣.中国樱花品种图鉴[M].北京:科技出版社,2014.
[13]刘庆昌,吴国良.植物细胞组织培养[M].北京:中国农业大学出版社,2002:3537.
[14]韋三立.花卉组织培养[M].北京:中国林业出版社,2002:3839.

