咪鲜胺和多菌灵对斑马鱼联合毒性效应
李健,吴声敢,赵慧宇,杨桂玲
农业部农产品质量安全风险评估实验室(杭州) 浙江省农业科学院 农产品质量与标准研究所,杭州 310021
咪鲜胺(prochloraz)是一种广谱咪唑类杀菌剂,能够防治子囊菌和半知菌在作物上引起的病害,对大田作物、水果、蔬菜、草皮及观赏植物上的多种病害具有治疗和铲除作用[1]。1998年至2006年,全国20个省、市76家企业登记产品95个厂次[1]。2008年,我国咪鲜胺原药产量达到6 000余t[2]。随着其大量使用,在水稻[3]、黄瓜[4]等多种作物和土壤中被检出。土壤中残留的咪鲜胺可以随着雨水淋溶作用等进入地表水,可能会对水生生物的生长、发育以及群落稳定等造成不利影响。
多菌灵(carbendazim)是美国杜邦公司开发的杀菌剂苯菌灵的中间产物。20世纪70年代中期,中国、德国先后实现多菌灵的工业化生产,到20世纪80年代,多菌灵已发展成为我国工业化产量最大的内吸性杀菌剂品种之一[5]。统计至2016年12月底,我国29个省、区、市686家企业登记多菌灵农药产品929个(原药20个,单剂253个,复配制剂656个)。从登记作物来看,多菌灵大多数登记在谷物、果蔬等30多种可食用作物上,少量登记在绿萍、观赏类花卉、橡胶树和棉花等非食用作物上。在美国、欧盟和澳大利亚等国家和组织,除了少量园林植物,多菌灵已退出在食用农作物上的登记[5]。2003年,英国抽查的252份梨样品中,发现12%的样品含有多菌灵残留[6],在我国许多农作物中也普遍检测到多菌灵[7-8]。有研究表明,多菌灵在土壤中的半衰期为6~12个月[6],土壤中残留的多菌灵会随着雨水淋溶作用进入地表水,加上其光稳定性强,可能会对水生生物造成潜在的威胁。
在实际生产中,咪鲜胺可与大多数杀菌剂混合或复配使用[9],其中咪鲜胺和多菌灵复配使用较为普遍。李锐等[10]的研究表明25%咪鲜胺·多菌灵可湿性粉剂对芒果炭疽病防治效果优于单独使用咪鲜胺和多菌灵。王良吉[11]的研究表明105 g·hm-2的咪鲜胺·多菌灵复配对油菜菌核病有较好的防治效果。农药的混合使用或者滥用导致环境和农产品中农药多残留现象普遍。我国有超过70%的河流和地下水检测出含有5种以上的农药残留[12]。本实验室历年检测结果显示,咪鲜胺和多菌灵在果蔬中检出率较高,分别为21.41%和27.68%,且存在同时检出的情况。
近年来,多个文献报道了农药联合暴露对水生生物的联合毒性研究。Wu等[13]研究了三唑磷与吡虫啉联合暴露对斑马鱼的联合毒性。Wang等[14]报道了嘧菌环胺和醚菌酯对斑马鱼的联合毒性。目前,有关咪鲜胺和多菌灵联合暴露对水生生物的危害报道较少。本文以斑马鱼为模式生物,运用静态法和实时荧光定量PCR方法,研究咪鲜胺和多菌灵,及其二元组合对斑马鱼胚胎的急性毒性和对斑马鱼幼鱼甲状腺轴相关基因表达的影响,以期为全面评估农药复合污染风险提供必要的基础数据,同时为农产品质量安全的监测预警提供科学依据。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
仪器:5415R台式离心机(Eppendorf公司,德国);RXZ-280智能光照培养箱(宁波江南仪器厂,中国);StepOnePlusTM Real-Time PCR仪(Applied Biosystems公司,美国)。
试剂:咪鲜胺(纯度为97%,湖北正兴源精细化工有限公司);多菌灵(纯度为99%,湖北康宝泰精细化工有限公司);TakaRaMiniBEST Universal RNA Extraction Kit提取RNA试剂盒,购自大连Takara公司。
1.2 实验材料
实验鱼:斑马鱼(Brachydaniorerio),由浙江省农业科学院生态监测中心提供。无明显的疾病和肉眼可见的畸形。斑马鱼饲养于恒温(27±1) ℃鱼房,保持14 h∶10 h光/暗条件,每天喂养2次新鲜孵化的丰年虾。
鱼卵收集:实验前一天晚上,将成熟的斑马鱼以雌雄比1∶2的比例,配对放入产卵缸,次日清晨,开灯给予光照刺激使其交配产卵。收集鱼卵,用系统水清洗并在显微镜下观察,选取正常发育的胚胎,用于后续的暴露实验。
1.3 实验方法
1.3.1 斑马鱼胚胎急性毒性试验
急性毒性试验参照经济合作与发展组织(OECD)的方法[15],以24孔细胞培养板作为染毒容器,每孔放置1枚受精卵,每个浓度设置2个重复。根据预备实验结果,设定咪鲜胺和多菌灵对斑马鱼胚胎的毒性试验浓度(见表1)。分别于24、48、72、96 h时间点观察并记录死亡数和孵化数,及时取出死亡个体。根据卵是否出现白色凝结、小鱼有无心率、血液是否流动等条件判断斑马鱼死亡情况。
1.3.2 斑马鱼胚胎联合毒性试验
咪鲜胺和多菌灵联合毒性试验浓度设置为:以咪鲜胺和多菌灵单剂对斑马鱼胚胎的96 h-LC50作为各自的毒性单位,采用毒性单位1∶1的比例设置6个浓度梯度(见表1),并设置1个空白对照(CK)。
联合毒性评价按Marking的水生毒理联合效应的相加指数法(Additional Index)进行评定[16]。公式如下:
S=Am/A1+Bm/B1+…
式中,S为生物毒性相加作用之和;A1,B1分别为A,B等毒物的毒性LC50值;Am,Bm为混合物毒性中各毒物的毒性LC50值[16]。
当S≤1时:AI=1/S-1.0;当S>1时:AI=1.0-S。
用相加指数法(AI)评价农药的联合效应:AI>0时为协同作用,AI<0时为拮抗作用,AI=0时为相加作用。
1.3.3 斑马鱼胚胎基因表达试验
根据咪鲜胺和多菌灵单剂的LC50,设置高、中和低3个浓度和1个空白对照(见表2)。每个浓度设置3个重复,每个浓度随机挑选100枚正常发育的胚胎放入500 mL烧杯中。将实验组和对照组放入(26±1) ℃培养箱中暴露96 h,光暗周期为14 h∶10 h,每24 h更换一次药剂。暴露结束后,每个浓度随机挑选15条斑马鱼幼鱼用于基因测定。
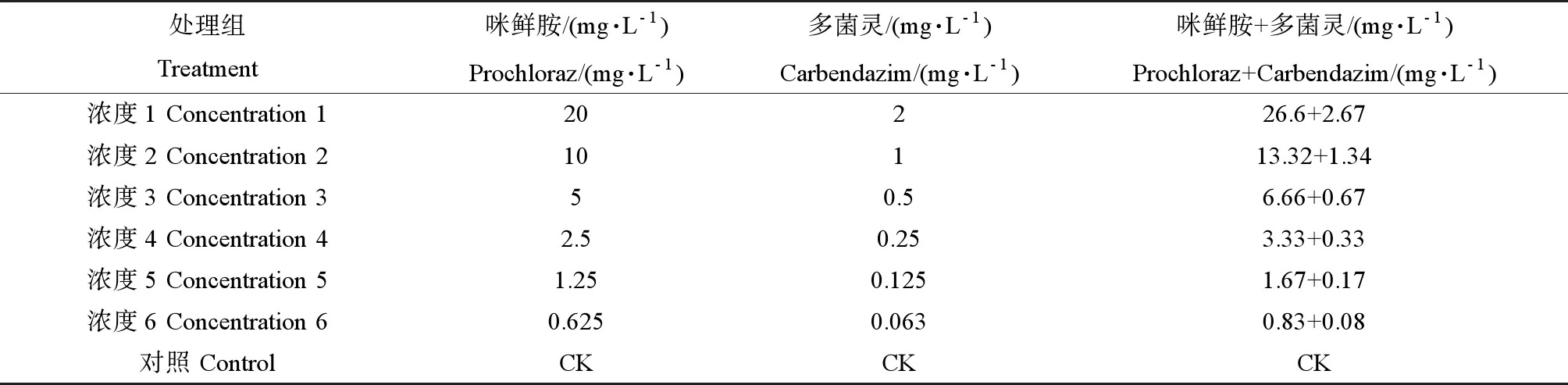
表1 咪鲜胺和多菌灵急性毒性实验浓度设置Table 1 The concentration of prochloraz and carbendazim in acute toxicity experiments
按照试剂盒说明书的步骤进行RNA的提取和反转录;用Quawell超微量分光光度计测定RNA的浓度和纯化质量;按照实时荧光定量PCR试剂盒说明书在冰上配制20 μL反应体系;反应程序为95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,共40个循环;72 ℃延伸20 s;所用基因引物序列参考常菊花[17]的报道(见表3)。
1.4 数据统计与分析
试验数据用SPSS 7.5软件进行整理和分析,以浓度的对数值作为自变量(x),斑马鱼死亡率作为因变量(y),建立“剂量-效应”线性方程,计算LC50和95%置信区间。
采用2-△△Ct方法[18]计算各基因mRNA的相对表达量,并通过T-test检验试验组和对照组的差异显著性(P<0.05、P<0.01表示差异显著),并用Origin 8.0软件完成制图。
2 结果(Results)
2.1 咪鲜胺和多菌灵对斑马鱼胚胎急性毒性
咪鲜胺对斑马鱼胚胎的96 h-LC50值为8.41 mg·L-1,根据现行毒性标准[19]属于中毒(1~10 mg·L-1),线性方程为y=4.71x-4.35,95%置信区间为4.75~10.35 mg·L-1,咪鲜胺对斑马鱼胚胎的LC50值随着暴露时间的增加而降低(见表4)。
多菌灵对斑马鱼胚胎的96 h-LC50值为0.81 mg·L-1,属于高毒(0.1~1 mg·L-1),线性方程为y=4.59x-0.41,95%置信区间为0.57~1 mg·L-1,多菌灵对斑马鱼胚胎的LC50值随着暴露时间的增加而降低(见表4)。

表3 实时荧光定量PCR引物序列Table 3 Primers used for quantification of mRNA expression by real-time PCR
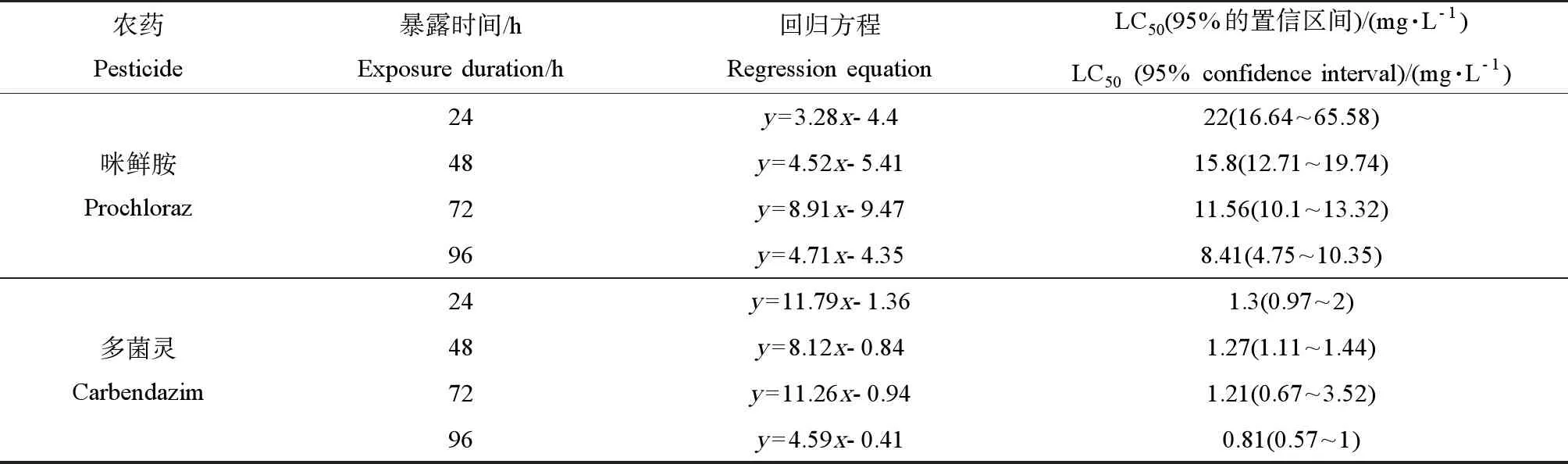
表4 咪鲜胺和多菌灵对斑马鱼胚胎的急性毒性Table 4 Acute toxicity of prochloraz and carbendazim to zebrafish
2.2 咪鲜胺和多菌灵对斑马鱼胚胎联合急性毒性
咪鲜胺对斑马鱼胚胎的96 h-LC50值为5 mg·L-1,线性方程为y=2.9x-2.03,95%置信区间为1.46~30.27 mg·L-1;多菌灵对斑马鱼胚胎的96 h-LC50值为0.61 mg·L-1,线性方程为y=7.08x+1.52,95%置信区间为0.52~0.71 mg·L-1。相加指数法计算结果表明,在24~96 h内,AI值均小于0,表现为拮抗作用(见表5)。
2.3 斑马鱼幼鱼甲状腺轴基因表达
本实验选取了6种斑马鱼甲状腺轴上关键基因,来探究不同浓度的咪鲜胺、多菌灵及其二元组合对斑马鱼甲状腺轴基因表达的影响。6种基因分别为:促甲状腺激素释放激素(CRH)、促甲状腺激素(TSH)、甲状腺激素受体(TRα)、脱碘酶(D1、D2)基因和甲状腺激素转运蛋白(TTR)。
(1)咪鲜胺、多菌灵和二元组合与对照组的基因表达比较
咪鲜胺抑制斑马鱼幼鱼体内的CRH、TSH、TRα、D1和D2基因的表达,对TTR基因的表达没有显著影响(图1)。暴露于低浓度咪鲜胺,斑马鱼幼鱼体内的CRH、TSH、TRα、D1和D2基因的表达量分别下调99%、98%、61%、99%和99%,影响最为显著;暴露于中浓度咪鲜胺,CRH、TSH、TRα、D1和D2基因的表达量分别下调82%、85%、50%、87%和80%;暴露于高浓度咪鲜胺,CRH、TSH、TRα、D1和D2基因的表达量分别下调37%、9%、39%、99%和95%。随着咪鲜胺暴露浓度的增加,斑马鱼体内的CRH、TSH和TRα基因的表达逐渐上调。
多菌灵抑制斑马鱼幼鱼体内的CRH、TSH、D1和D2基因的表达,对TTR基因的表达没有显著影响,不同浓度的多菌灵对TRα基因表达的影响存在差异(图1)。暴露于低浓度多菌灵,斑马鱼体内的CRH、TSH、D1和D2基因的表达量分别下调89%、87%、93%和85%,TRα基因的表达量上调36%;暴露于中浓度多菌灵,CRH、TSH、TRα、D1和D2基因的表达量分别下调96%、94%、64%、62%和97%;暴露于高浓度多菌灵,CRH、TSH、TRα和D1基因的表达量下调70%、62%、45%和91%。
二元组合抑制斑马鱼体内的CRH、TSH、D1和D2基因的表达,对TTR基因的表达没有显著影响,且不同浓度的二元组合对TRα基因表达的影响存在差异(图1)。暴露于低浓度二元组合,斑马鱼幼鱼体内的CRH、TSH、TRα、D1和D2基因的表达量分别下调94%、85%、72%、90%和95%;暴露于中浓度二元组合,CRH、TSH、D1和D2基因的表达量分别下调99%、98%、99%和99%,TRα基因的表达量上调37%;暴露于高浓度二元组合,CRH和TRα基因的表达量分别下调28%和51%,其他基因没有显著变化。
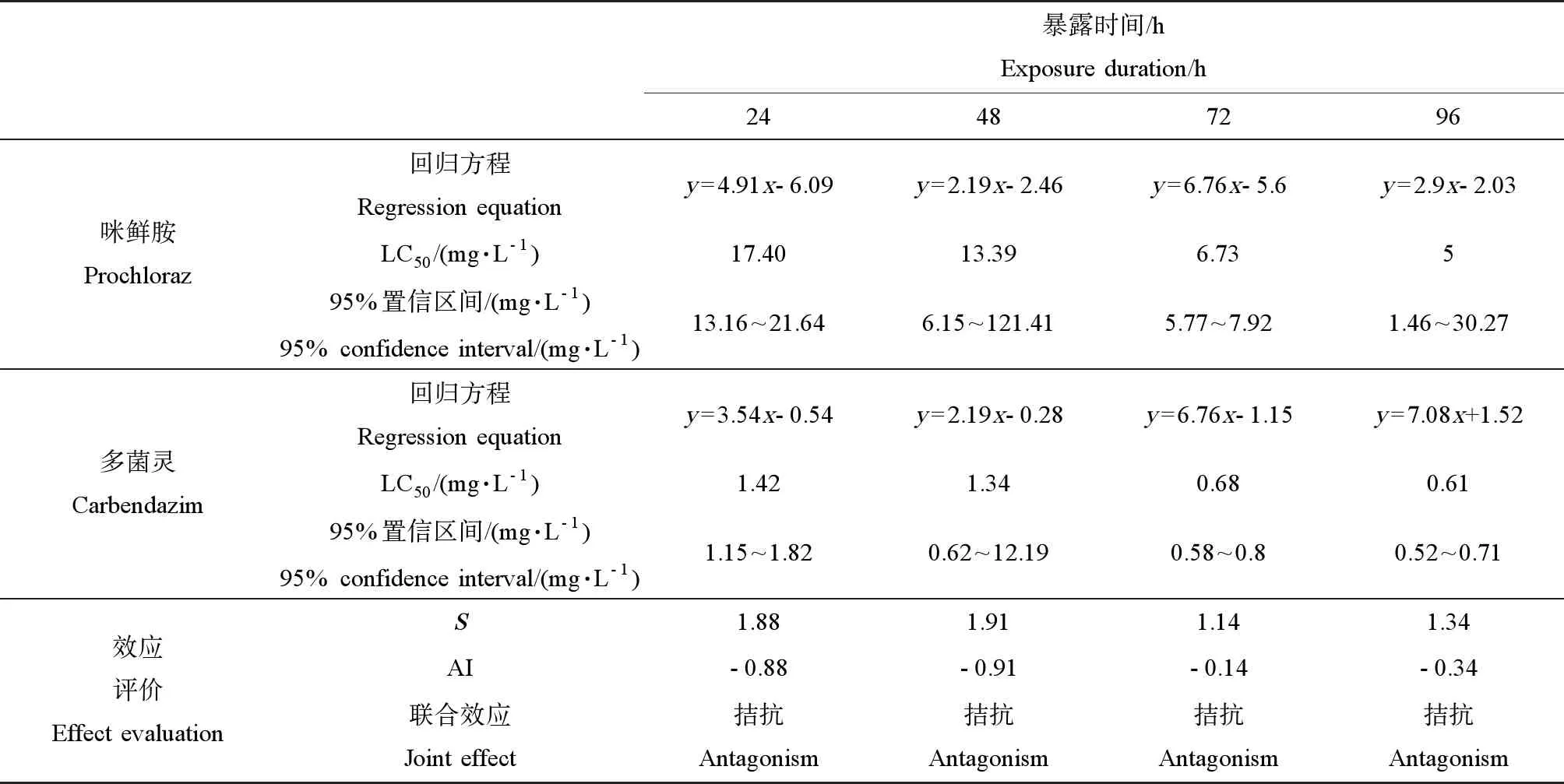
表5 咪鲜胺和多菌灵对斑马鱼胚胎联合急性毒性Table 5 Combined acute toxicity of prochloraz and carbendazim to zebrafish
(2)二元组合与咪鲜胺、多菌灵的基因表达比较
二元组合对斑马鱼体内的TRα、TSH、D1和D2基因表达量的影响存在明显差异。由图1可知,暴露于0.11 mg·L-1咪鲜胺或0.01 mg·L-1多菌灵,TRα基因的表达量分别下调50%或64%,暴露于二元组合(0.11 mg·L-1咪鲜胺+0.01 mg·L-1多菌灵),TRα基因的表达量上调37%;暴露于0.44 mg·L-1咪鲜胺,TSH、D1和D2基因的表达量分别下调9%、99%和95%,暴露于0.04 mg·L-1多菌灵,TSH、D1和D2基因的表达量分别下调62%、91%和21%,暴露于二元组合(0.44 mg·L-1咪鲜胺+0.04 mg·L-1多菌灵),TSH、D1和D2基因的表达量与对照组相比没有显著差异。
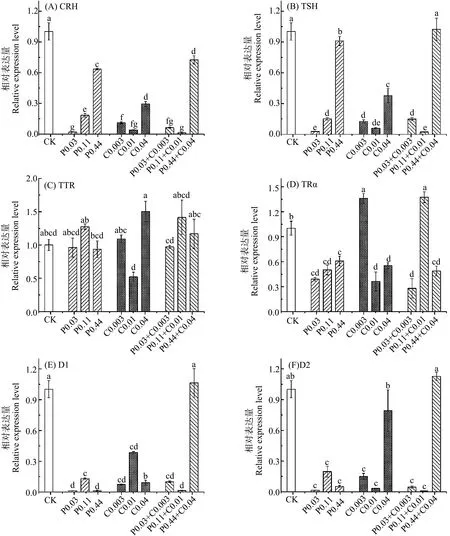
图1 咪鲜胺、多菌灵和咪鲜胺+多菌灵联合暴露对斑马鱼幼鱼甲状腺轴基因表达量的影响注:P表示咪鲜胺,C表示多菌灵,P+C表示咪鲜胺+多菌灵。CRH为促甲状腺激素释放激素基因, TSH为促甲状腺激素基因,TRα为甲状腺激素受体基因,D1、D2为脱碘酶基因,TTR为甲状腺激素转运蛋白基因。Fig. 1 Effects of different concentrations of prochloraz, canbendazim and prochloraz+canbendazim on the thyroid axis gene expression of zebrafish larvae Note: P denotes prochloraz; C denotes carbendazim; P+C denotes prochloraz+canbendazim. CRH stands for hormone releasing hormone gene; TSH stands for thyroid-stimulating hormone gene; TRα stands for thyroid hormone receptor gene; D1, D2 stand for deiodinase gene; TTR stands for thyroid hormone transporter gene.
3 讨论(Discussion)
3.1 咪鲜胺和多菌灵对斑马鱼胚胎的单一和联合毒性
咪鲜胺和多菌灵对斑马鱼胚胎的96 h-LC50值分别为8.41和0.81 mg·L-1,表现为中毒和高毒。这与咪鲜胺对斑马鱼胚胎96 h-LC50值为8.5 mg·L-1[20],多菌灵对斑马鱼胚胎96 h-LC50值在0.85~1.6 mg·L-1范围内[21]的结果类似。有研究表明,咪鲜胺对斑马鱼幼鱼的96 h-LC50值为1.45 mg·L-1[22],对斑马鱼成鱼96 h-LC50值为4.6 mg·L-1[20];多菌灵对斑马鱼成鱼96 h-LC50值为7.64 mg·L-1[23],对日本青鳉幼鱼、仔鱼96 h-LC50值分别为20.54和12.47 mg·L-1[24]。由此可见,不同种类的农药对不同生物不同发育阶段的毒性是不同的。在等浓度配比下,咪鲜胺和多菌灵对斑马鱼胚胎的96 h-LC50值分别为5和0.61 mg·L-1,联合毒性表现为拮抗效应,其结果与杨桂玲等[25]以HepG2肝脏细胞为试验材料所得的结果是一致的。
3.2 咪鲜胺影响斑马鱼幼鱼甲状腺轴基因的表达
在咪鲜胺对斑马鱼染毒试验中,咪鲜胺对CRH、TSH、TRα、D1和D2基因的表达具有不同程度的抑制作用,且低浓度(0.03 mg·L-1)暴露组的抑制效果更为显著(P<0.01)。结果表明,咪鲜胺对斑马鱼幼鱼可能具有潜在的甲状腺干扰效应,这与Brande-Lavridsen等[26]得到的咪鲜胺影响蝌蚪甲状腺形态学变化的结论类似。甲状腺轴相关基因的表达受到抑制可能会减弱甲状腺激素的合成和分泌,从而抑制幼鱼的发育。例如,CRH、TSH表达量下调可能会减弱下丘脑和垂体对甲状腺组织的刺激作用,使甲状腺激素的合成和分泌减少;D2基因是催化甲状腺激素(T4)脱碘生成高活性三碘甲腺原氨酸(T3)的关键酶,将D2基因敲除后,斑马鱼的发育将严重滞后[27];D1基因在促进T3的生成过程中发挥着重要作用[28],D1和D2表达量同时下调,则可能会使T3的合成受到严重抑制;TRα基因表达量的下调,会导致甲状腺激素合成受到抑制[29]。本研究中CRH、TSH、TRα、D1和D2基因表达量的下调,可能是因为甲状腺激素合成受到抑制,从而使得与受体的结合减弱。
3.3 多菌灵影响斑马鱼幼鱼甲状腺轴基因的表达
在多菌灵对斑马鱼的染毒试验中,多菌灵抑制斑马鱼体内CRH、TSH、D1和D2基因表达。结果表明,多菌灵对斑马鱼幼鱼具有潜在的甲状腺干扰效应。可能的干扰机制为:多菌灵抑制斑马鱼体内的甲状腺激素的合成,从而使得与受体的结合减弱。Barlas等[30]的研究表明多菌灵导致大鼠体内的T3激素含量升高,且对大鼠甲状腺造成组织病理损伤。Gawande等[31]的研究表明多菌灵导致大鼠体内甲状腺和肾上腺腺体组织病理学损伤。
3.4 联合暴露影响斑马鱼幼鱼甲状腺轴基因的表达
与对照组基因表达相比,二元组合抑制斑马鱼体内的CRH、TSH、D1和D2基因的表达,对TTR基因的表达没有显著影响,且不同浓度的二元组合对TRα基因表达的影响存在差异;与咪鲜胺、多菌灵基因表达相比,二元组合(0.11 mg·L-1咪鲜胺+0.01 mg·L-1多菌灵)对斑马鱼体内的TRα、TSH、D1和D2基因表达量的影响表现出协同效应。结果表明,CRH、TSH、D1和D2基因是斑马鱼内分泌干扰分子毒性的重要靶位点,且不同剂量组对斑马鱼幼鱼甲状腺干扰效应存在差异。Wu等[13]研究发现三唑磷+吡虫啉联合暴露与单独暴露相比,斑马鱼体内TSH、D1和D2基因有显著差异,且这些基因表达量的变化可为早期的分子预警。楼钦钦等[32]研究发现对于内分泌干扰物而言,其暴露于低剂量时可引起非剂量-效应关系。
综上所述,咪鲜胺和多菌灵对斑马鱼胚胎毒性表现为中毒和高毒,联合暴露表现出拮抗效应;咪鲜胺和多菌灵单剂对斑马鱼具有潜在的甲状腺干扰效应,二元组合对斑马鱼幼鱼体内的基因表达存在非剂量-效应关系。因此,在农药的风险评估工作中,应充分考虑二者的联合毒性效应。在未来的农药登记管理以及农药残留限量标准制定中,单个农药的评估应逐步向多残留联合暴露评估转变,同时联合毒性评价的结果也将需要应用到相关残留限量的制定中。

