SCNN1B与胃癌细胞上皮间质转化相关性实验研究*
柯东平,毛俊倩,郭甲民,马龙安
陕西省肿瘤医院(西安 710061)
胃癌是一种起源于胃壁黏膜上皮细胞的恶性肿瘤,是发病率和病死率最高的消化道恶性肿瘤之一,全世界每年约有700,000例患者死于胃癌,其治疗失败的主要原因是肿瘤的侵袭和转移[1]。研究显示,上皮间质转化(Epithelial-mesenchymal transitions,EMT)在肿瘤的发展过程中具有重要作用[2]。该过程上皮细胞失去细胞极性和细胞间粘附,同时获得迁移和侵袭性,成为间充质表型细胞,造成肿瘤的转移。因此,探究影响胃癌细胞EMT的靶向分子对胃癌的治疗具有重要意义。SCNN1B位于16p12.2号染色体上,编码上皮钠通道(ENaC)的β亚单位,与α、γ亚单位组成多蛋白复合物,控制不同器官中水和电解质的跨上皮转运。同时,有报道显示,包括SCNN1B编码的β亚单位在内,ENaC亚单位均参与细胞分化[3],并且在多种癌细胞中编码ENaC亚单位的基因启动子区发生高甲基化导致基因沉默[4-5]。近来研究发现,SCNN1B沉默与胃癌患者不良的疾病特异性和生存率显著相关[6]。本研究拟采用SCNN1B过表达人胃癌细胞系SGC-7901细胞,建立胃癌裸鼠移植瘤模型,探究SCNN1B对胃癌移植瘤生长情况的影响及其与胃癌细胞上皮间质转化的相关性,为胃癌临床治疗提供新靶点。
材料和方法
1 主要材料 E-cadherin抗体、N-cadherin抗体(中国Proteintech);Vinmentin抗体、β-actin抗体、全蛋白提取试剂盒、BCA蛋白浓度测定试剂盒(中国Wanleibio);HRP标记山羊抗兔IgG、HRP标记山羊抗小鼠IgG(美国ThermoFisher);苏木精、山羊血清、DAB显色液、SYBR Green(中国Solarbio);TRIpure、Super M-MLV反转录酶(中国BioTeke)。
2 实验方法
2.1 细胞培养:人胃癌细胞系SGC-7901细胞采用含10 %胎牛血清的DMEM培养基于37 ℃、5 % CO2培养箱内培养。构建针对人SCNN1B过表达载体,待SGC-7901细胞生长至90 %融合时,进行转染,G418筛选稳定转染细胞系。
2.2 裸鼠成瘤实验:取4周龄雌性18~22 g,BALB/c裸鼠,随机均分为未转染组(Control)、空载体对照转染组(Empty vector)、SCNN1B过表达转染组(SCNN1B)。调整各组细胞密度,制备细胞悬液,于裸鼠右前肢皮下接种1×106个SGC-7901细胞,建立裸鼠移植瘤模型。常规饲养3周后处死裸鼠,剥取肿瘤组织,观察移植生长情况,部分用液氮冻存转移至-70℃超低温冰箱保存,部分用4 %多聚甲醛固定,用于后续实验。
2.3 Real-time PCR检测移植瘤组织中SCNN1B和EMT标志分子mRNA的表达:采用TRIpure总RNA抽提试剂提取各组移植瘤组织样本总RNA,并通过反转录PCR合成cDNA样本。根据人相应基因序列,使用Primer premier 5.0软件设计相应引物。取上述cDNA产物作为模板,采用Real-time PCR检测SCNN1B、E-cadherin、N-cadherin及Vimentin mRNA的表达。

表1 Real-time PCR引物序列
2.4 Western blot检测移植瘤组织中SCNN1B和EMT标志分子蛋白的表达:采用RIPA裂解液裂解各组移植瘤组织样本,提取总蛋白。BCA法测定蛋白浓度,取40 μg蛋白样本,进行SDS-PAGE电泳,转至PVDF膜上,5 %脱脂奶粉溶液封闭,分别加入SCNN1B、E-cadherin、N-cadherin及Vimentin一抗4 ℃孵育过夜,HRP标记二抗37 ℃孵育45 min。ECL显影,暗室曝光。采凝胶成像分析仪采集图片,并用Gel-Pro-Analyzer软件分析条带的光密度值。
2.5 免疫组化检测肿瘤组织中EMT标志分子蛋白表达:制备石蜡组织切片,常规脱蜡至水,蒸馏水和PBS清洗后,置于抗原修复液内,低火持续加热10 min;室温下自然冷却,滴加3 %过氧化氢溶液,孵育15 min;滴加山羊血清封闭15 min,完成后去除血清,勿洗,分别加入E-cadherin、N-cadherin及Vimentin一抗4 ℃孵育过夜,二抗37 ℃孵育30 min;DAB显色、苏木精复染、脱水透明处理;中性树胶封片,晾干后于400×显微镜下观察并摄图记录。
3 统计学方法 采用GraphPad Prism 6.0统计学软件,计量资料以均数±标准差表示,t检验分析组间差异,P<0.05表示差异有统计学意义。
结 果
1 SCNN1B过表达抑制胃癌移植瘤生长 采用BALB/c裸鼠皮下注射SCNN1B过表达SGC-7901细胞,培养3周。结果显示,Control组和Empty vector组瘤体大小比较无统计学差异;与Empty vector组相比,SCNN1B组移植瘤的生长明显受到抑制(图1)。
2 SCNN1B过表达效果验证 采用Real-time PCR和Western blot检测各组小鼠移植瘤组织中SCNN1B的表达情况,结果显示,与Control组相比,Empty vector组移植瘤组织中SCNN1B mRNA和蛋白表达水平比较均无统计学差异(P>0.05);与Empty vector组相比,SCNN1B组移植瘤组织中SCNN1B mRNA和蛋白表达水平明显升高,差异均具有统计学意义(P<0.01,图2)。
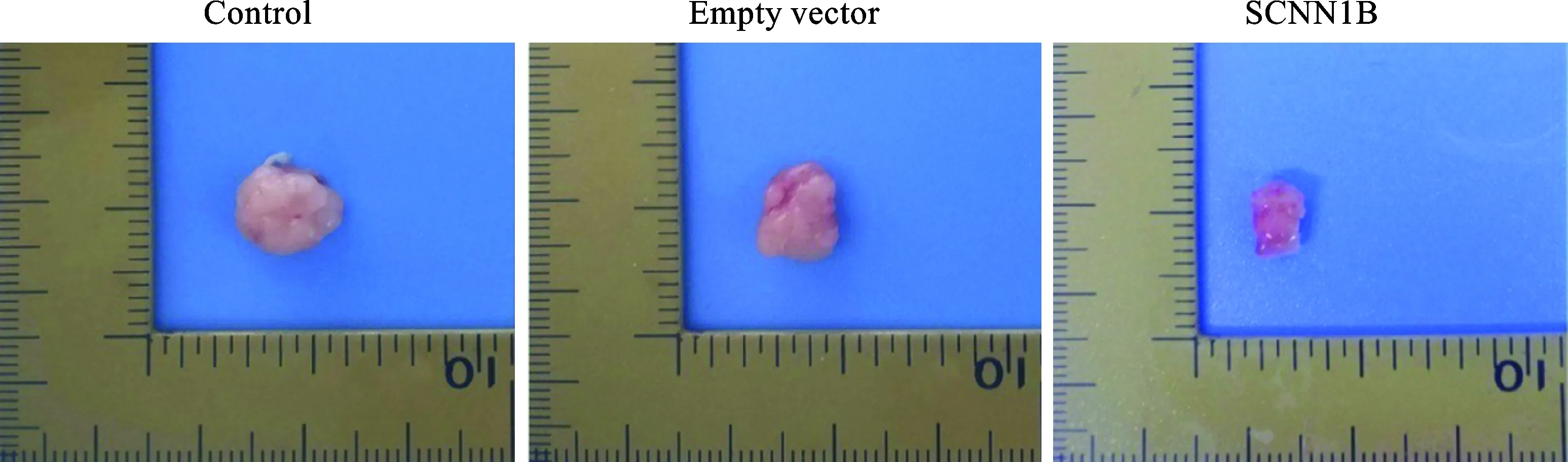
图1 各组小鼠移植瘤瘤体情况
3 小鼠移植瘤组织中EMT标志物的表达情况 Real-time PCR和Western blot检测各组小鼠移植瘤组织中EMT标志分子的表达情况,结果显示,与Control组相比,Empty vector组移植瘤组织中上皮细胞标志物E-cadherin、间质标志物N-cadherin及Vimentin mRNA和蛋白表达水平均无统计学差异(P>0.05);与Empty vector组相比,SCNN1B组移植瘤组织中E-cadherin mRNA和蛋白表达水平明显升高,N-cadherin和Vimentin mRNA和蛋白表达水平明显降低,差异均具有统计学意义(P<0.01,图3)。

图2 移植瘤组织中SCNN1B表达情况(与Empty vector组相比,**P<0.01)

图3 移植瘤组织中EMT标志物表达情况(与Empty vector组相比,**P<0.01)
4 SCNN1B过表达抑制胃癌细胞EMT 免疫组化结果显示,阳性染色为棕黄色颗粒。与Control组相比,Empty vector组移植瘤组织中E-cadherin、N-cadherin及Vimentin蛋白表达水平均无明显变化;与Empty vector组相比,SCNN1B组移植瘤组织中E-cadherin蛋白表达水平明显升高,N-cadherin和Vimentin蛋白表达水平均明显降低(图4)。
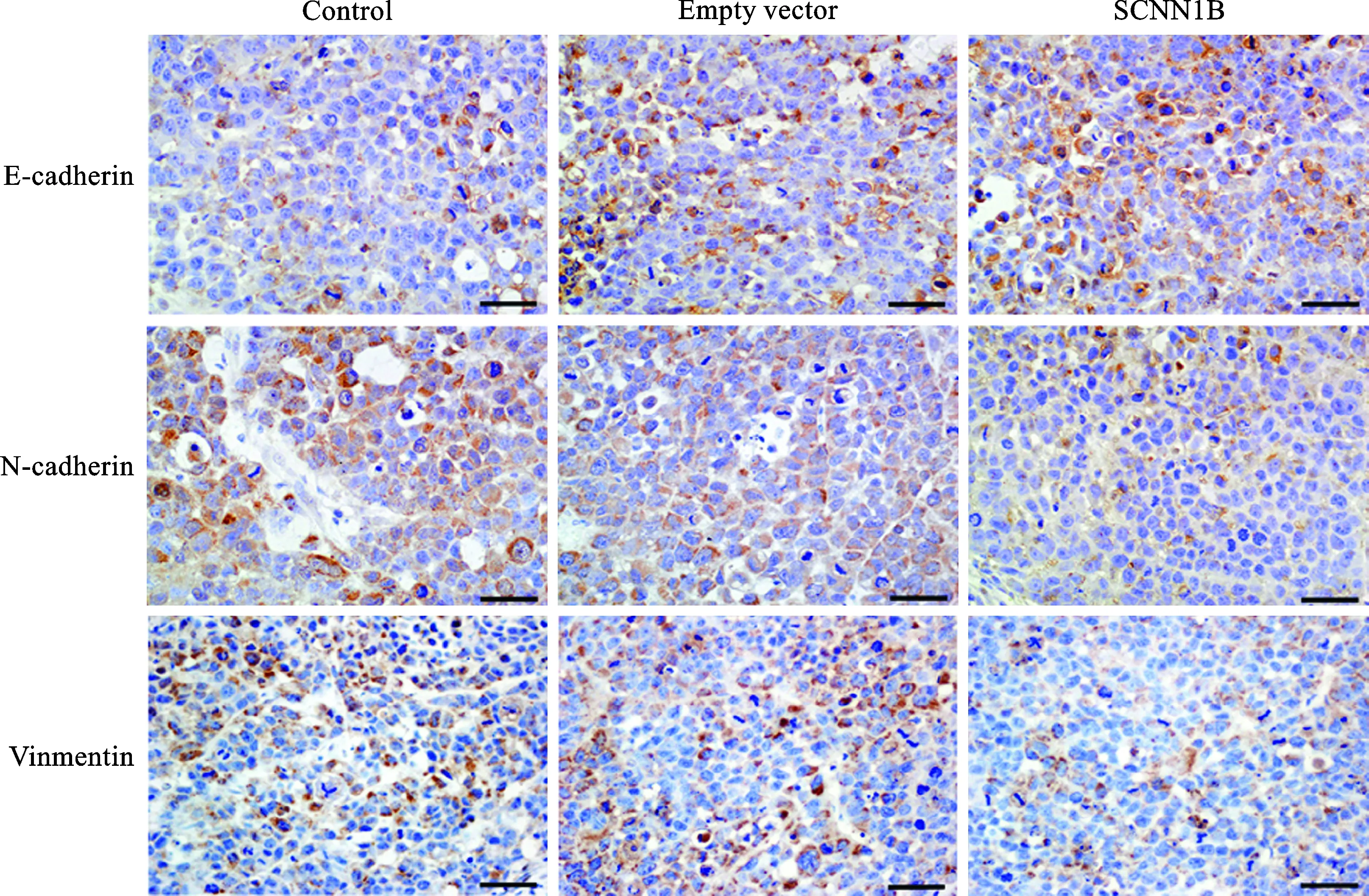
图4 SCNN1B过表达对胃癌移植瘤上皮间质转化的影响(400×)
讨 论
胃癌是世界上最常见的恶性肿瘤之一,也是第三大致人死亡的肿瘤疾病,给社会带来巨大的压力。由于胃癌早期临床表现不典型,不易发现,多数患者就诊时已处于中晚期,加之治疗手段有限,导致胃癌的治愈率并不高。当前,随着分子靶向治疗的深入开展,探究影响胃癌上皮间质转化的关键分子对于有效治疗胃癌的转移具有重要意义。
SCNN1B编码上皮钠通道(ENaC)的β亚单位,参与控制不同器官中水和电解质的跨上皮转运及细胞分化过程。目前关于ENaC在癌症中的研究显示,在乳腺癌、神经母细胞瘤中,编码ENaC α亚单位的SCNN1A基因启动子区发生高甲基化引起的SCNN1A基因沉默,是上述肿瘤疾病患者预后较差的主要原因[4,7]。新近研究发现,SCNN1B可以抑制胃癌细胞的生长和转移,且SCNN1B表达水平与胃癌患者生存率正相关[6],上述研究提示,SCNN1B在癌症中发挥抑癌作用,然而,其作用机制却鲜有相关文献进行报道,因此,为进一步阐明SCNN1B在胃癌中的作用与机制,本研究使用过表达SCNN1B的人胃癌细胞系SGC-7901细胞建立裸鼠移植瘤模型,观察SCNN1B过表达对胃癌移植瘤生长情况的影响。上述结果显示,SCNN1B过表达后,移植瘤的生长明显受到抑制表明SCNN1B能够抑制体内胃癌细胞的生长。
上皮间质转化是指上皮细胞向间质细胞转化的过程,与胚胎发育、伤口愈合及肿瘤侵袭转移等过程密切相关[8]。越来越多研究显示,EMT在胃癌细胞生长、侵袭和迁移等过程中发挥重要作用[9-10]。为明确SCNN1B对胃癌细胞的影响是否与EMT相关,本研究分别采用Real-time PCR和Western blot技术检测过表达胃癌细胞形成的移植瘤组织中上皮细胞标志物E-cadherin、间质细胞标志物N-cadherin和Vimentin mRNA和蛋白表达水平。结果显示,在SCNN1B过表达胃癌细胞形成的移植瘤组织中,E-cadherin mRNA和蛋白表达水平均明显上调,N-cadherin、Vimentin mRNA和蛋白表达水平均明显降低。同时,本研究进一步采用免疫组化检测移植瘤组织中EMT标志分子蛋白的表达,结果同样表明,SCNN1B过表达导致E-cadherin蛋白表达水平上调,N-cadherin、Vimentin蛋白表达水平下调。以上结果显示,SCNN1B过表达抑制胃癌细胞上皮间质转化。
综上所述,SCNN1B能够通过抑制胃癌细胞上皮间质转化进程对胃癌细胞移植瘤的生长起到明显的抑制作用。因此,SCNN1B可能成为治疗胃癌的潜在分子靶点。

