脉冲电磁场调控SREBP-1c及氧化应激改善db/db小鼠肝脂肪变性研究*
刘 颖,李远辙,周声毅,阮俊勇,罗二平,景 达,翟明明△
1.解放军陆军防化学院(北京 100113);2.空军军医大学军事生物医学工程学系(西安 710032)
非酒精性脂肪性肝病(Non-alcoholic fatty liver disease,NAFLD)是目前我国第一大慢性肝病,已成为备受关注的公共卫生问题[1]。NAFLD的早期症状为异常肝脏脂肪堆积,15%~20%的病人会进展成为更严重的非酒精性脂肪性肝炎(Non-alcoholic steatohepatitis,NASH)。NASH表现为胰岛素抵抗和氧化应激等,导致肝细胞膨胀、凋亡和肝星状细胞活化,增加了肝硬化和肝癌的风险[2]。目前,NAFLD尚无公认特效治疗药物,因此寻找针对NAFLD及相关肝脂肪代谢的有效治疗手段具有重要临床意义。
低频脉冲电磁场(Pulsed electromagnetic fields,PEMF)作为一种安全的、非侵入式治疗手段被FDA所批准,其生物学效应也被用于肝脏研究。Ottani等对肝部分切除术后大鼠施加PEMF,促进了肝再生[3]。崔红等对db/db小鼠施加PEMF刺激后,胰岛素抵抗(Insulin resistance,IR)得到明显改善,并且减轻了肝脂肪变[4]。虽然已经发现PEMF改善肝脏脂肪变性及IR的积极效果,但具体机制尚不明确。
IR发生机制虽然尚未完全阐明,但目前的研究认为氧化应激是其诱因[5-6]。氧化应激是由过度产生的活性氧(Reactive oxygen species,ROS)引起的,主要是在线粒体氧化磷酸化过程中产生。作为营养代谢的中心,肝脏富含线粒体,因此易受ROS攻击[7]。通常血糖代谢由多种激素调节以保持动态平衡,而肝脏是这些激素作用的主要目标,在糖酵解和葡聚糖生成中起到主要作用。众多激素中,只有胰岛素可以降低血糖,一旦肝脏对胰岛素产生抵抗,血糖控制将出现问题,常伴随肥胖、糖尿病等其它改变。大量研究表明,抗氧化手段可以有效改善IR的发生、发展。
固醇调节元件结合蛋白1 (Sterol regulatory element-binding proteins 1,SREBP-1)是调控脂质代谢的关键转录因子,在 NAFLD 患者肝组织中过度表达,引起肝脏脂肪堆积[8]。SREBP-1c作为核转录因子 SREBP-1的亚型,参与调控葡萄糖代谢、脂肪酸及脂质合成。动物实验及临床研究均发现,SREBP-1c在体内异常过度表达,会诱导脂肪合成上调,导致肝脏等脂质堆积。当SREBP-1c 表达下调,可以改善肝细胞脂质代谢失衡[9]。然而,SREBP-1c是否介导PEMF改善NAFLD肝脏脂肪变性尚不明确。
本研究使用脉冲波形PEMF作用于NAFLD模型小鼠,以探究其改善db/db小鼠肝脂肪变性的潜在机制。
材料与方法
1 主要试剂 二奎琳甲酸(Bicinchoninic acid,BCA)蛋白定量试剂盒购自Thermo Scientific公司。抗体均购自Santa公司。胰岛素ELISA试剂盒购自武汉华美生物工程有限公司。血糖试纸购自Roche。甘油三酯(Triglyceride,TG)、丙二醛(Methane dicarboxylic aldehyde,MDA)、还原性谷胱甘肽(Reduced glutathione,GSH) /氧化型谷胱甘肽(Oxidized GSH,GSSG)定量试剂盒购自南京建成生物工程有限公司。
2 实验动物 动物实验获得空军军医大学动物伦理委员会批准。8只8周龄雌性C57BL/KsJ 小鼠(18.07 ± 1.54) g和16只8周龄雌性 C57L/6J db/db小鼠(29.73 ± 2.27) g购自南京大学。动物在标准环境下饲养:12 h/12 h明暗交替,温度调节(22±1)℃,自由摄食、水。
3 实验方法
3.1 实验分组与处理:对照组由8只C57BL/KsJ小鼠组成;将16只 C57BL/6J db/db小鼠随机平均分为NAFLD组及PEMF组。NAFLD组模型小鼠不加任何处理,PEMF组模型小鼠每天施加1 h刺激(PEMF频率为15.38 Hz,场强为20 Gs,持续12 周)。
3.2 胰岛素抵抗评价:小鼠禁食过夜后,取尾尖静脉血检测空腹血糖。实验动物处死前用乙醚麻醉,摘眼球取全血,并在37℃静置2 h后进行570 g离心10 min,取上清。按照胰岛素ELISA试剂盒说明对血清胰岛素含量进行测定。按照公式:
计算稳态模型的胰岛素抵抗指数。
3.3 油红O染色:10 μm冰冻肝脏切片在20℃进行油红O染色10 min,经磷酸盐缓冲液漂洗后置于Olympus光学显微镜下观察脂质堆积。
3.4 甘油三酯测定:按照说明书,取100 mg肝组织样本在0.9 ml无水乙醇中进行冰浴匀浆,然后570 g离心10 min,取上清,进行甘油三酯检测。
3.5 抗氧化酶活性检测:按照说明书,取100 mg肝组织样本在0.9 ml 生理盐水(0.9%)中进行冰浴匀浆570 g离心10 min后取上清检测MDA。GSH/GSSG的检测严格按照说明书中操作。
3.6 蛋白印迹:肝脏组织样本使用RIPA裂解液在冰上进行裂解30 min,然后进行20000 g离心,取上清,使用BCA蛋白检测试剂盒进行定量。蛋白样品加入上样缓冲液后,95℃加热5 min进行变性处理,然后按照常规SDS-PAGE方法进行检测。蛋白条带采用Quantity One软件进行定量。β-actin作为内参蛋白。
结 果
1 PEMF改善模型小鼠的胰岛素抵抗 对照组小鼠空腹血糖为(4.10±0.18)mmol/L,血清胰岛素为(10.80±1.08)mIU/L,HOMA-IR为2.13±0.22;NAFLD组db/db小鼠空腹血糖为(30.22±1.18)mmol/L,血清胰岛素为(6.90±0.30)mIU/L,HOMA-IR为(6.97±0.32);经PEMF干预后,db/db鼠空腹血糖为(22.9±2.18)mmol/L,空腹血清胰岛素(3.53±0.65)mIU/L,HOMA-IR(4.01±0.54)。PEMF组较NAFLD组胰岛素抵抗明显改善(图1)。
2 PEMF缓解模型小鼠肝氧化应激 与NAFLD组相比,PEMF组MDA及GSSG水平显著下降,而GSH与GSH-Px水平明显上升(图2)。
3 PEMF减少肝脂质堆积 油红O染色在40倍镜下观察结果显示,PEMF组脂滴数量和大小均显著降低(图3 A)。PEMF组SREBP-1c的蛋白表达量较NAFLD组减少约35%左右(图3 B)。除此之外,肝脏TG含量PEMF组降低至(4.49±0.86) mmol/gprot,而NAFLD组含量为(7.60±0.21) mmol/gprot(图3C)。
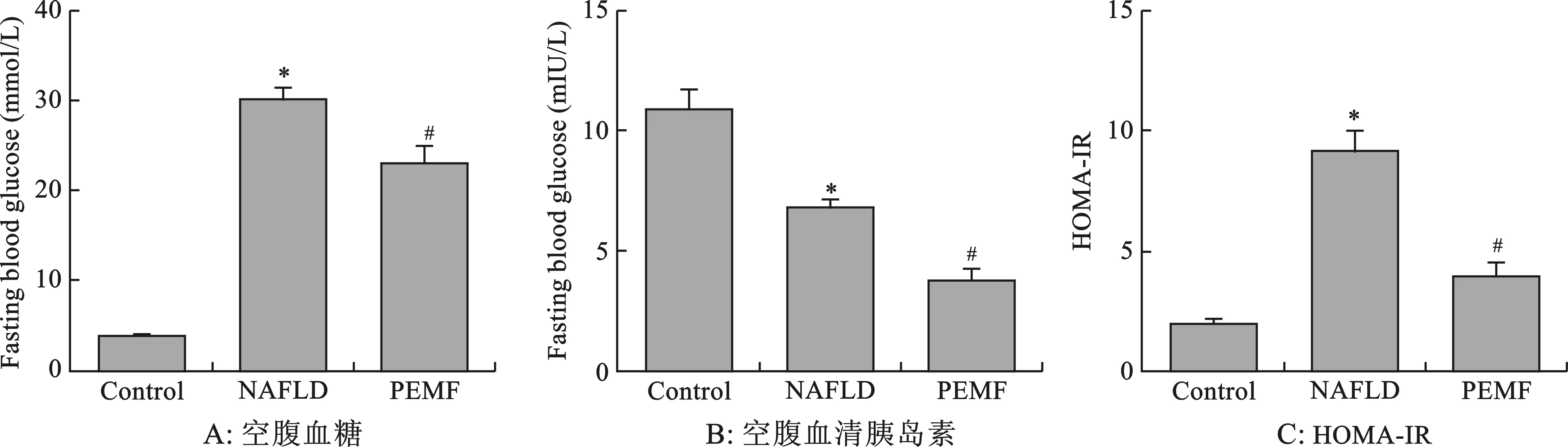
图1 PEMF改善NAFLD模型小鼠的胰岛素抵抗(与对照组相比,*P<0.05;与NAFLD组相比,#P<0.05)
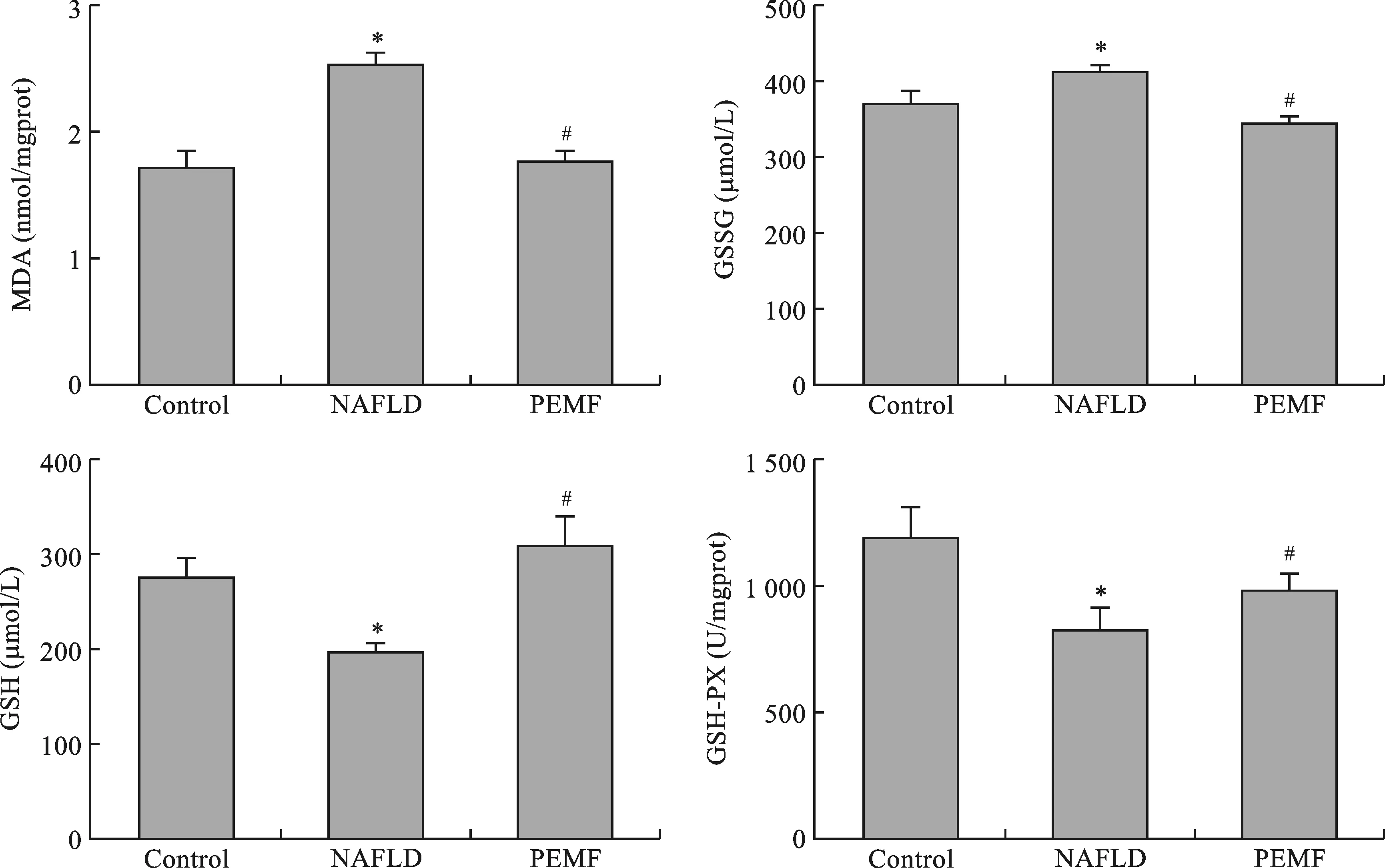
图2 PEMF改善NAFLD模型小鼠的氧化还原稳态(与对照组相比,*P<0.05;与NAFLD组相比,#P<0.05)
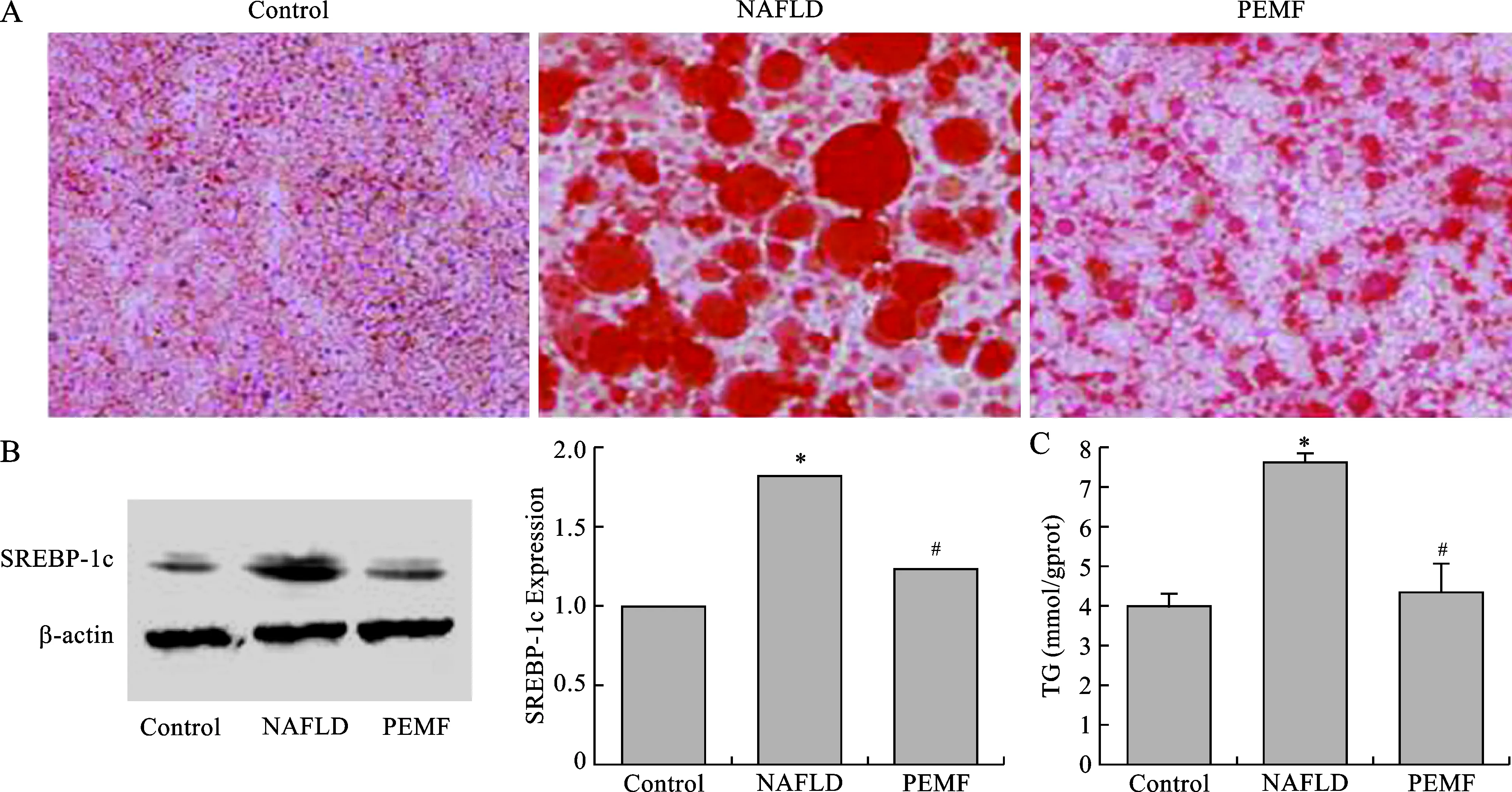
图3 PEMF改善NAFLD模型小鼠肝脂质堆积[A:冰冻切片油红O染色 (×40);B:SREBP-1c蛋白表达;C:肝脏三酰甘油含量]
讨 论
当前我国肥胖和代谢综合征患病率增长迅速,NAFLD的患病率已超过西方国家,成为我国肝、代谢领域的新挑战,对全民健康构成严重威胁[10]。2型糖尿病并发NAFLD存在着显著的胰岛素抵抗[11]。因此迫切需要寻找到有效的、公认的治疗方法,用以预防和治疗NAFLD。PEMF作为安全、非侵入式物理手段已经被广泛用在临床治疗骨愈合等疾病[12]。基于PEMF的积极生物学效应,本研究验证了PEMF改善db/db小鼠肝脂肪变性的作用,并对潜在分子机制进行了探究。
2018年更新的《非酒精性脂肪性肝病防治指南》中指出,治疗NAFLD的首要目标为减肥和改善胰岛素抵抗。NAFLD与胰岛素抵抗密切相关,伴随有过量的游离脂肪酸在肝脏转换为TG储存,导致脂肪变性[10]。本研究对模型小鼠施加外源性物理刺激后,模型小鼠的空腹血清胰岛素水平、HOMA-IR指标均显著降低,验证了PEMF对胰岛素抵抗的积极作用。目前已有体外实验证明过氧化氢会诱发3T3-L1细胞IR[13]。Zucker大鼠的体内实验也证明了这点[14]。人体研究表明高脂饮食会增加线粒体过氧化氢生成和IR[6,15]。当对啮齿动物采用线粒体靶向抗氧化剂干预或过度表达过氧化氢酶时,能有效改善高脂饮食引起的IR[15]。氧化应激目前被认为是NAFLD发病机制的关键因素,活性氧的产量增加导致脂质过氧化反应。为了探究PEMF改善模型小鼠IR是否与氧化应激相关联,本研究检测发现,与NAFLD组相比较,PEMF组的MDA下调,而GSH与GSH-Px水平明显上升,GSSG水平显著下降。MDA是氧化应激相关指标,肝脏MDA形成与过氧化脂质常被作为肝组织损伤和氧化损伤的生物标志。MDA是脂质过氧化作用的产物,最终能被降解,进而改变细胞和细胞膜的生物功能,其下调表明氧化应激减弱。此外,脂质在肝脏堆积经常加速MDA的释放,这就导致核线粒体DNA的损伤以及活性氧诱导的细胞凋亡。GSH是一种重要的非酶的抗氧化剂,上调起到避免氧化应激损伤的作用;GSH-Px是一种广泛分布在体内的重要酶,可代谢毒性过氧化物,如过氧化氢和脂质水解过氧化物,进入非毒性的羟基化合物中,利用GSH作为一种共同底物合成GSSG,以保护细胞的结构和功能,防止过氧化物的干扰和损伤。总之,PEMF通过上调GSH-Px表达提高总抗氧化酶的活性,通过上调GSH表达提高抗氧化能力,进而弱化了db/db小鼠肝脏的氧化应激,MDA的下调印证了PEMF保护肝脏避免氧化应激损伤。
SREBP-1c是肝脏内调节脂肪新生的重要的转录因子,它专门调控脂肪酸生物合成途径中多种关键酶的表达。SREBP-1c在db/db小鼠体内表达水平升高,经组织学确诊为NAFLD的患者体内也同样表达水平升高。已有研究发现当大鼠的胰岛素分泌受到破坏,SREBP-1c水平降低,注射胰岛素后,SREBP-1c表达上调。SREBP-1c介导胰岛素对脂质合成的调控,在新脂质合成中具有重要作用[16]。而在转基因小鼠肝脏过表达SREBP-1c会诱发脂肪肝,增加TG含量,脂质过量合成堆积。Guo等的研究发现有氧运动训练通过显著下调SREBP-1c表达来改善脂肪肝[17]。本研究的结果也发现:PEMF组较NAFLD组下调SREBP-1c蛋白表达,并且肝脏TG含量显著降低,肝脏脂滴数量和大小均得到了显著改善。预示PEMF通过下调SREBP-1c表达,进而调节TG的合成,减少肝脏内新脂质的合成,改善肝脏的脂质合成堆积。
综上所述,本研究的结果预示PEMF可能通过提高db/db小鼠肝脏的抗氧化能力,改善胰岛素抵抗,从而降低了血清胰岛素含量,进而下调SREBP-1c表达,调节肝脏TG和脂质的合成,缓解肝脂肪变性。

