不同抗体型幽门螺旋杆菌感染者胃黏膜功能状态的实验研究
闻华 张润玲 莫丽美 郑俊胜
(中国科学院大学深圳医院 广东深圳518107)
胃部疾病是临床常见病、多发病,近年来随着人们饮食结构及生活习惯的不断改变,胃部疾病发生率不断增加,严重影响人们日常生活。临床研究显示,幽门螺旋杆菌(Helicobacter Pylori,Hp)感染是诱发胃部疾病常见病因,Hp 依据其细胞毒素可分为Ⅰ型Hp 感染和Ⅱ型Hp 感染,而不同分型Hp 感染诱发的症状有所不同,因此临床准确鉴别Hp 感染分型是治疗疾病的关键所在[1~3]。Hp 感染后不仅可阻断胃酸对G 细胞分泌的负反馈作用,还可破坏胃黏膜结构,从而导致胃内酸碱失衡,削弱胃黏膜屏障,进而诱发胃部疾病,故临床可通过评估胃黏膜功能来诊断疾病[4]。胃蛋白酶原(Pepsinogen,PG)是胃黏膜分泌的一种胃蛋白酶前体,可准确反映机体胃黏膜功能状态[5]。本研究探讨不同抗体型Hp 感染者胃黏膜功能状态,以期为临床治疗方案的制定、患者预后评估提供依据。现报道如下:
1 资料与方法
1.1 一般资料 选取2018 年2 月~2019 年1 月在我院行Hp 抗体分型检测结果为阳性的患者332 例纳入试验组,其中男188 例,女144 例;年龄24~77岁,平均(40.56±11.83)岁。另选取同期在我院行Hp抗体分型检测结果为阴性的患者300 例纳入对照组,其中男161 例,女139 例;年龄22~76 岁,平均(36.30±11.01)岁。两组年龄、性别组成比较,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入与排除标准
1.2.1 纳入标准 临床资料完整;无血液系统疾病;入组前2 周未使用铋剂、抗菌药物、H2受体阻滞剂、质子泵抑制剂治疗;无精神系统疾病。
1.2.2 排除标准 合并重要脏器器质性损伤,合并其他感染疾病。
1.3 检测方法 采取两组清晨空腹肘静脉血3 ml,以3 500 r/min 离心10 min,取上层血清备测。采用免疫比浊法测定胃蛋白酶原Ⅰ(PGⅠ)、胃蛋白酶原Ⅱ(PGⅡ),试剂盒购自北京九强生物公司。测定出PGⅠ、PGⅡ水平后,计算胃蛋白酶原比值(PGR)水平:PGⅠ/PGⅡ。血清Hp 抗体分型采用免疫印迹法定性检测,试剂盒由深圳伯劳特生物公司提供,共分出Ⅰ型Hp 感染233 例,Ⅱ型Hp 感染99 例。
1.4 观察指标 比较Hp 阳性、阴性患者PGⅠ、PGⅡ、PGR 水平;比较不同Hp 抗体分型患者PGⅠ、PGⅡ、PGR 水平,并分析PGⅠ、PGⅡ、PGR 水平与Hp 抗体分型的相关性。
1.5 统计学方法 采用SPSS23.0 统计学软件处理数据。计量资料用表示,采用t 检验;相关性分析采用双变量Pearson 相关性检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组胃黏膜功能对比 试验组PGⅠ、PGⅡ水平高于对照组,PGR 水平低于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组胃黏膜功能对比

表1 两组胃黏膜功能对比
组别 n PGⅠ(μg/L) PGⅡ(μg/L) PGR对照组30058.71±21.0110.24±3.635.73±1.23试验组33274.07±29.9816.80±8.224.41±1.51 t 7.51713.1989.519 P 0.0000.0000.000
2.2 不同Hp 抗体分型胃黏膜功能对比 Ⅱ型Hp感染者PGⅠ、PGⅡ较Ⅰ型Hp 感染者低,PGR 水平较Ⅰ型Hp 感染者高,差异有统计学意义(P<0.05)。见表2。
表2 不同Hp 抗体分型胃黏膜功能对比
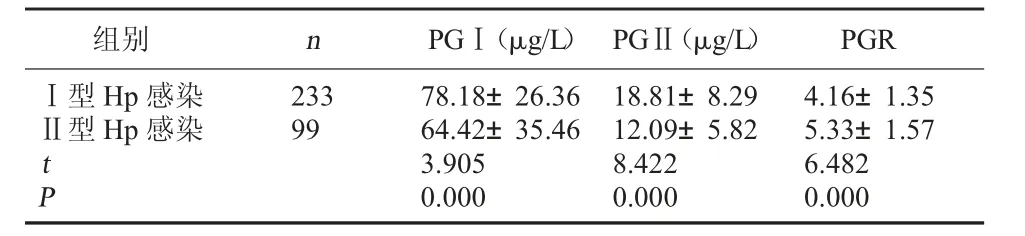
表2 不同Hp 抗体分型胃黏膜功能对比
组别 n PGⅠ(μg/L) PGⅡ(μg/L) PGRⅠ型Hp 感染23378.18±26.3618.81±8.294.16±1.35Ⅱ型Hp 感染9964.42±35.4612.09±5.825.33±1.57 t 3.9058.4226.482 P 0.0000.0000.000
2.3 胃黏膜功能与Hp 抗体分型的相关性 经Pearson 相关性分析,PGⅠ、PGⅡ与Hp 抗体分型呈负相关(r<0,P<0.05),PGR 与Hp 抗体分型呈正相关(r>0,P<0.05)。见表3。

表3 胃黏膜功能与Hp 抗体分型的相关性
3 讨论
Hp 感染是诱发胃部疾病重要因素,Hp 属于革兰阴性杆菌,其生物学特征表现为嗜酸性,可存在于十二指肠和胃内。临床研究表明,Hp 感染后可诱导炎症反应,破坏胃黏膜屏障,损伤胃黏膜,从而引起胃部疾病,甚至诱发胃癌[6]。故临床通过评估胃黏膜功能状态来诊断Hp 感染情况。
PG 属于胃蛋白酶的前体,主要由胃黏膜分泌,依据其免疫原性及生化特性可分为PGⅠ、PGⅡ两个胃蛋白酶原亚型。PGⅠ由颈黏液细胞和胃黏膜主细胞合成并分泌至胃腔,PGⅡ主要由近端十二指肠Brunner 腺、胃窦幽门腺、胃贲门腺合成分泌[7]。当胃黏膜受到炎症刺激后,可增加血管通透性及胃上皮细胞间隙,从而增加PG 释放,故血清中PG 含量可反映胃黏膜功能和状态,反映胃黏膜组织病理变化情况,为临床早期筛查胃部疾病提供重要依据[8~9]。临床研究表明,血清PG 水平可直观地反映不同部位胃黏膜功能和形态,其中PGⅠ可反映胃酸分泌功能,PGⅠ水平越高,表明胃酸分泌越多。在Hp 感染初中期,因Hp 感染刺激腺体细胞而出现PGⅠ水平增高的假象;而当Hp 感染后期,随着胃黏膜腺体出现萎缩,胃酸的分泌减少,进而降低了PGⅠ水平。PGⅡ水平与胃底黏膜病变具有密切联系,当机体出现假幽门腺化生、胃上皮化生及异型增生、胃底腺萎缩时,其水平可显著提升。PGR 可反映胃黏膜萎缩及恶变情况[10~11]。
本研究结果显示,试验组PGⅠ、PGⅡ水平较对照组高,PGR 水平较对照组低,可见机体发生Hp 感染后可损伤胃黏膜功能,降低PGR 水平,提升PGⅠ、PGⅡ水平。Ⅱ型Hp 感染者PGⅠ、PGⅡ水平较Ⅰ型Hp 感染低,PGR 水平较Ⅰ型Hp 感染高,可见Ⅰ型Hp 感染者胃黏膜的损伤要明显重于Ⅱ型Hp感染者。Pearson 相关性分析显示,PGⅠ、PGⅡ与Hp抗体分型呈负相关(r<0),PGR 与Hp 抗体分型呈正相关(r>0),说明胃黏膜萎缩进展情况及恶变情况与Hp 抗体分型呈正相关。由上可知,Hp 抗体分型与胃黏膜功能状态有密切联系。综上所述,不同抗体型Hp 感染与胃黏膜功能状态有密切联系,血清PG 水平变化有助于鉴别Hp 抗体分型,可为临床治疗方案的制定、患者预后评估提供依据。

