IL-6、IL-18 与心房颤动的关系研究
胡耀明 雷慧娟
(1 江西省高安市人民医院急诊科 高安330800;2 江西省高安市中医院 高安330800)
心房颤动(AF)是最常见的心律失常类型。房颤不仅影响患者生活质量,同时还增加患者住院、心力衰竭、中风和死亡的风险。试验和流行病学研究表明,炎症在AF 的发病机制中起着重要作用[1~2]。有研究表明,白细胞介素-6(IL-6)[3]、白细胞介素-18(IL-18)[4]与房颤密切相关,但具体机制仍不明确。本研究旨在研究不同房颤患者的IL-6、IL-18 水平及其与房颤的关系。现报道如下:
1 资料与方法
1.1 一般资料 选取2017 年12 月~2018 年12 月我院急诊内科及心血管内科收治的71 例房颤患者,按其房颤持续时间分为阵发性房颤组11 例、持续性房颤组23 例和永久性房颤组37 例;其中男41 例,平均年龄(55.2±28.3)岁,女30 例,平均年龄(53.2±27.5)岁。同时选取年龄和性别相匹配的30名健康志愿者作为对照组,其中男19 例,平均年龄(54.1±27.6)岁,女11 例,平均年龄(51.2±27.2)岁,均为健康体检者,排除患有严重心脏病,肝、肾功能不全,脑血管意外等疾病者。
1.2 检测方法 (1)IL-6、IL-18 测定:抽取受试对象清晨空腹肘静脉血5 ml,其中2 ml 注入干净试管中待凝固,尽快分离血清,置-40℃低温冰箱保存;IL-6、IL-18 检测采用酶联免疫吸附测定法(ELISA)。另3 ml 送检血酯、血糖等。(2)左心房内径(LAD)测定:应用超声心动图测定左心房内径。
1.3 统计学处理 数据处理采用SPSS16.0 统计学软件,计数资料以%表示,采用χ2检验,计量资料以表示,采用t 检验,相关分析行Pearson 分析。P<0.05 为差异有统计学意义。
2 结果
2.1 四组IL-18、IL-6 水平及左房内径比较 永久性房颤组血清IL-18 和IL-6 均高于持续性房颤组,持续性房颤组血清IL-18 和IL-6 水平均高于阵发性房颤组,阵发性房颤组血清IL-18 和IL-6 水平均高于对照组,差异均有统计学意义,P<0.05;房颤患者LAD 均大于对照组,永久性房颤组LAD 大于持续性房颤组,持续性房颤组LAD 大于阵发性房颤组,差异均有统计学意义,P<0.05。见表1。
表1 四组IL-18、IL-6 水平及左房内径比较
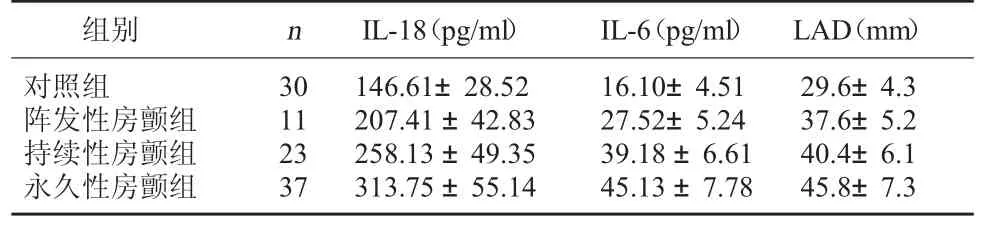
表1 四组IL-18、IL-6 水平及左房内径比较
组别 n IL-18(pg/ml) IL-6(pg/ml) LAD(mm)对照组30146.61±28.5216.10±4.5129.6±4.3阵发性房颤组11207.41±42.8327.52±5.2437.6±5.2持续性房颤组23258.13±49.3539.18±6.6140.4±6.1永久性房颤组37313.75±55.1445.13±7.7845.8±7.3
2.2 房颤患者血清IL-18 和IL-6 水平与LAD 的相关性分析 IL-18 水平与LAD 成正相关r=0.26,P<0.01;IL-6 水平与LAD 成正相关r=0.31,P<0.01;IL-18 与IL-6 水平成正相关,r=0.34,P<0.01。
3 讨论
目前,AF 患病率高且缺乏完全有效的治疗,AF仍然是现代医学的一个挑战。现有数据表明,全身炎症反应可能与房颤及其发病机制有关,但尚不清楚炎症反应是AF 发生的原因还是房颤产生的结果。通过研究房颤发生和维持的机制有助于制定有效的治疗策略。
IL-6 是由免疫细胞、内皮细胞、血管平滑肌细胞和缺血心肌细胞产生,是一种调节免疫应答、急性期反应和造血作用的多肽递质。IL-6 与房颤的关系研究是个热点,有研究表明IL-6 与房颤的发生及复发密切相关[5]。Henningsen 等研究发现IL-6 与冠状动脉病变、旁路移植术、复律术和射频导管消融术后房颤的诱发及持续密切相关[6]。在房颤患者心血管危险因素研究中,经校正相关危险因素后,IL-6 与中风及体循环血栓栓塞独立相关[7]。有研究表明,在慢性肾脏病的患者中,发现只有IL-6 水平升高与基线心电图诊断的AF 风险增加及后续随访中的新发AF相关[8]。本研究结果表明,永久性房颤组血清IL-6 水平高于持续性房颤组,持续性房颤组血清IL-6 水平高于阵发性房颤组,阵发性房颤组血清IL-6 水平高于对照组,差异均有统计学意义,P<0.05。王龙等研究发现房颤患者IL-6 水平较对照组明显升高,与本研究结果相似[9]。故IL-6 水平可能与房颤的发生、发展相关,具体机制可能是:(1)IL-6 激活交感神经和肾素-血管紧张素系统,同时影响LA 直径和LV 功能障碍程度,导致AF。(2)IL-6 使白细胞流变学特性发生改变,血浆纤维蛋白含量增加,血液粘滞度增加,损伤血管内皮细胞;同时从多种途径促进血管平滑肌及心肌的增生增殖而导致重构,诱发房颤。
IL-18 是一种重要的炎症细胞因子,其参与Th1/Th2 分化,自身免疫和炎症通路的激活。目前,IL-18 与房颤的相关性研究不多,两者关系仍不明确。Okura 等在实验中发现IL-18 有致心肌肥厚作用,从而参与心肌重构[10]。故IL-18 有致心肌重构作用,而心肌重构是房颤发生的病理生理机制之一。夏平等的研究表明IL-18 参与了房颤的发生及发展[5]。本研究结果表明永久性房颤组IL-18 水平高于持续性组,持续性房颤组IL-18 水平高于阵发性组,阵发性房颤组IL-18 水平高于对照组,差异均有统计学意义,P<0.05。与陈恩平等研究结果一致[11]。因此,IL-18 可能参与AF 的发生发展过程,但目前两者间的关系尚不明确。其可能机制为:(1)IL-18 可促进促炎因子(如IL-1 及TNF-α 等)的产生,使心肌细胞增殖及纤维化,心房间质纤维化进展导致心房异常传导是房颤发生发展的机制,房颤持续时间越长,患者左房纤维化程度越重,左房纤维化越重越易触发房颤[12];(2)可使Th1 细胞增殖及自然杀伤细胞Fas配体表达上调,促进心肌细胞凋亡,心房内的置换纤维化,从而导致心房解剖和电重构。
本研究发现房颤患者随着房颤持续的时间不同,左房内径数值有差异,持续时间越长,左房内径越大。永久性房颤组左房内径大于持续性组、持续性组左房内径大于阵发性组,阵发性组左房内径大于对照组,差异均有统计学意义,P<0.05。左房内径增大,说明左房重构加重,而炎症是导致重构的原因,而进一步证实了炎症与房颤存在某种联系。房颤患者IL-6、IL-18 水平分别与左房内径成正相关,说明炎症越重,左房重构越明显,更易诱发房颤并使房颤持续。且在房颤患者中两者成正相关,说明两者在房颤的发生发展中存在一定的相互促进作用。
Wang 等对慢性房颤患者研究后发现,经校正各种混杂因素后,IL-18 单核苷酸多态性与房颤风险降低相关;特别是rs187238-g c 基因型和c 等位基因、rs360719-ag 基因型和g 等位基因、rs549908-gt基因型和g 等位基因可降低房颤相关风险[13]。可见IL-18 虽然参与房颤的发生及发展,但其特定位点基因可能是房颤防治的潜在靶点。而在IL-6 与房颤发生的炎症链条中也可能存在相似的位点,有待进一步研究。由此可见,IL-18、IL-6 参与的炎症反应可能参与房颤发生及发展病理生理机制。

