不同菌种发酵对铁皮石斛多糖及其生物活性的影响
王丹,袁永俊,谭青云,黄河,蒋林利,彭洁,潘亚瑜
(西华大学 食品与生物工程学院,成都 611730)
铁皮石斛又名黑节草,被誉为“药中黄金”,具有极高的药用和食用价值[1]。主要分布在我国温暖的南方,如广西、云南、浙江等地[2],常用于阴伤津亏、口干烦渴、目暗不明等[3,4]。多糖是铁皮石斛最重要的组成部分,其含量和活性决定了铁皮石斛的品质[5]。研究表明,铁皮石斛多糖具有降血糖、降血脂、抗氧化、抗衰老、增强机体免疫力等生理功能[6]。因此铁皮石斛具有极高的食用价值,传统食用方式为泡茶、煲汤、直接食用等。随着精加工技术的发展和对功能性的重视,铁皮石斛的应用日益广泛,近来将铁皮石斛用于调味品如调味汁、酱油、料酒中,以增强调味品的营养性和保健性,这为铁皮石斛和调味市场提供了新的方向。
微生物含有丰富的酶系,具有分解转换物质及产生次生代谢物质的能力[7]。中药的成分和结构复杂,使得活性物质被包裹,药性不能得到完全释放[8]。通过微生物发酵可以破坏细胞壁,促进中药活性物质的释放,降解有毒物质,产生次生代谢物如多酚、黄酮等[9]。此外,微生物发酵还可以促进活性成分的吸收[10],提高有效成分的提取率。本文选用了几种常见菌种,比较了不同菌种在发酵过程中多糖含量和多糖活性的变化,为提高铁皮石斛生物活性和研制功能性保健食品提供了理论基础。
1 材料与方法
1.1 材料与试剂
铁皮石斛:市售;面包酵母、酿酒酵母:购自安琪酵母股份有限公司;红曲霉、枯草芽孢杆菌、植物乳杆菌和保加利亚乳杆菌:由本实验室提供;MRS肉汤培养基、PDA培养基:购自北京奥博生物科技有限公司;α-葡萄糖苷酶、4-硝基苯酚-α-D-吡喃葡萄糖苷(PNPG)、α-淀粉酶、3,5-二硝基水杨酸、Sephadex G-200、1,1-二苯基-2-苦苯肼自由基(DPPH)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、Dextran系列葡聚糖标准品(T-10、T-40、T-70、T-200、T-500):购自上海源叶生物科技有限公司;无水乙醇、石油醚、硫酸、正丁醇、三氯甲烷、硫酸亚铁、水杨酸、过氧化氢、过硫酸钾等:购自成都市科龙化工试剂厂;所有试剂均为分析纯。
1.2 仪器与设备
SF-130C万能粉碎机 吉首中诚制药机械厂;BZF-50真空干燥箱 上海博讯实业有限公司; SGSP-02电热恒温隔水式培养箱 湖北省黄石市恒丰医疗器械有限公司;UV2400紫外可见分光光度计 上海舜宇恒平科学仪器有限公司;GI54DWS全自动高压灭菌锅 致微(厦门)仪器有限公司;HNY-2012C制冷恒温摇床 天津市欧诺仪器有限公司。
1.3 实验方法
1.3.1 菌种活化
1.3.1.1 酵母的活化
参考说明书,将酵母用5倍以上的35~38 ℃ 2%糖水活化15~30 min。
1.3.1.2 乳酸菌的活化
将菌种接种于MRS培养基中,于37 ℃恒温培养,连续传代,使菌种充分活化至活菌数在1.0×108CFU/mL以上。
1.3.1.3 霉菌的活化
将菌种接种于马铃薯葡萄糖琼脂(PDA)斜面培养基,30 ℃恒温培养箱培养6 d,使菌种充分活化。
1.3.2 铁皮石斛发酵原液的制备
铁皮石斛发酵原液的制备:参考文献[11],将铁皮石斛粉末与蒸馏水以1∶30的比例进行混合,搅拌均匀后置于恒温水浴锅中,90 ℃提取2 h,离心得到上清液。
铁皮石斛发酵工艺:取150 mL水提液倒入250 mL锥形瓶中,用棉花塞密闭,115 ℃灭菌20 min后接种发酵,接种量为2%,发酵转速为170 r/min,发酵条件见表1。

表1 不同菌种发酵条件Table 1 Fermentation conditions of different strains
1.4 基本指标的测定
还原糖含量的测定参考GB 5009.7-2016《食品中还原糖的测定》;多糖含量的测定采用苯酚-硫酸法。
1.5 多糖分子量的测定[12]
样品制备:将粗多糖水提液和发酵液经过醇沉、脱蛋白[13]、脱色素和透析除杂得到高纯度的多糖,冷冻干燥保存备用。
采用凝胶过滤色谱法测定铁皮石斛多糖分子量。将Dextran T-500、T-200、T-70、T-40、T-10系列葡聚糖标准品配制成2 mg/mL的标准溶液,上样体积2 mL,不同浓度NaCl溶液梯度洗脱,流速0.8 mL/min,4 mL/管,苯酚-硫酸法追踪检测,以Ve/V0为纵坐标,lgMr为横坐标,绘制标准曲线。曲线方程为:Y=0.4077X+3.3606,相关系数R2=0.9963。同样条件下测定发酵前后样品的洗脱体积,计算分子量。平均分子量的计算参考文献[14]。
1.6 自由基清除能力的测定
1.6.1 羟基自由基(OH)清除能力的测定
参考文献[15]并加以改进,向试管中依次加入2 mL 0.15 mmol/L FeSO4、0.8 mL 2 mmol/L水杨酸、0.4 mL样液、2 mL 6 mmol/L H2O2和0.8 mL去离子水作为样品组,37 ℃恒温水浴 10 min,冷却至室温,去离子水作为调零管,510 nm 处测定吸光度。以去离子水代替样液作为空白组,去离子水代替水杨酸作为对照组,计算公式如下:
OH自由基清除率(%)=[1-(A样品-A对照)/A空白]×100。
1.6.2 DPPH自由基清除能力的测定
参考文献[16]并加以改进,向试管中依次加入2 mL样液和等体积的0.1 mmol/L DPPH溶液作为样品组,常温避光反应30 min,以去离子水与95%乙醇等比例混合作为调零管,在517 nm处测定吸光度。以去离子水代替样液作为空白组,95%乙醇代替DPPH溶液作为对照组,计算公式如下:
DPPH自由基清除率(%)=[1-(A样品-A对照)/A空白]×100。
1.6.3 ABTS自由基清除能力的测定
参考文献[17],精密移取5 mL 7 mmol/L ABTS和88 μL 140 mmol/L过硫酸钾进行混合,常温避光静置过夜,形成ABTS自由基储备液,适当稀释至734 nm处吸光值在0.7±0.02区间。向试管中加入0.4 mL样液和6 mL ABTS溶液作为样品组,用去离子水作为调零管,在734 nm处测定其吸光度。以去离子水代替样液作为空白组,去离子水代替 ABTS 溶液作为对照组,计算公式如下:
ABTS自由基清除率(%)=[1-(A样品-A对照]/A空白)×100。
1.7 体外降血糖活性的测定
1.7.1 α-葡萄糖苷酶抑制活性的测定[18]
取1 U/mL α-葡萄糖苷酶50 μL、0.1 mol/L磷酸盐缓冲液(pH 6.8)280 μL、样液20 μL,37 ℃水浴10 min,再加入24 mmol/L PNPG 50 μL,37 ℃反应15 min,最后加入0.2 mol/L Na2CO3终止液200 μL,于405 nm处测定吸光度,记为样品实验组。以去离子水代替样液作空白对照组,去离子水代替α-葡萄糖苷酶作样品对照,其他步骤同上,测定样品空白与样品对照。利用下式计算发酵液对α-葡萄糖苷酶的抑制率。
α-葡萄糖苷酶抑制率(%)=[1-(A样品实验-A样品对照)/A样品空白]×100。
1.7.2 α-淀粉酶抑制活性的测定[19]
采用DNS法测定样品对α-淀粉酶的抑制率。依次向试管中加入1 mL 1.0%可溶性淀粉、0.5 mL样液和1 mL 1.0% α-淀粉酶,于37 ℃反应30 min,再加入2 mL 1 mol/L NaOH和2 mL DNS试剂,在540 nm处测定吸光度,记为样品实验组。用去离子水代替样液作为空白对照,去离子水代替α-淀粉酶作样品对照,其他步骤同上,测定样品空白与样品对照。利用下列公式计算α-淀粉酶抑制率。
α-淀粉酶抑制率(%)=[1-(A样品实验-A样品对照)/A样品空白]×100。
2 结果
2.1 不同菌种发酵对铁皮石斛活性成分的影响
2.1.1 不同菌种发酵对铁皮石斛多糖含量的影响

表2 不同菌种发酵后铁皮石斛多糖含量的变化Table 2 Polysaccharide content of Dendrobium candidum fermented by different strains %
由表2可知,与未发酵样品相比,除米曲霉和红曲霉外,发酵后多糖含量普遍降低。植物乳杆菌和保加利亚乳杆菌发酵后多糖含量明显下降,分别下降了21.8%和17.3%,面包酵母和酿酒酵母减少量相对较少,可能是由于乳酸菌活力更强,消耗糖的能力更高。米曲霉发酵后多糖含量基本无变化,红曲霉发酵后多糖含量增高,是因为红曲霉中酶系比较丰富,在发酵过程中将淀粉等其他物质转换为可溶性糖。
2.1.2 不同菌种发酵对铁皮石斛还原糖含量的影响
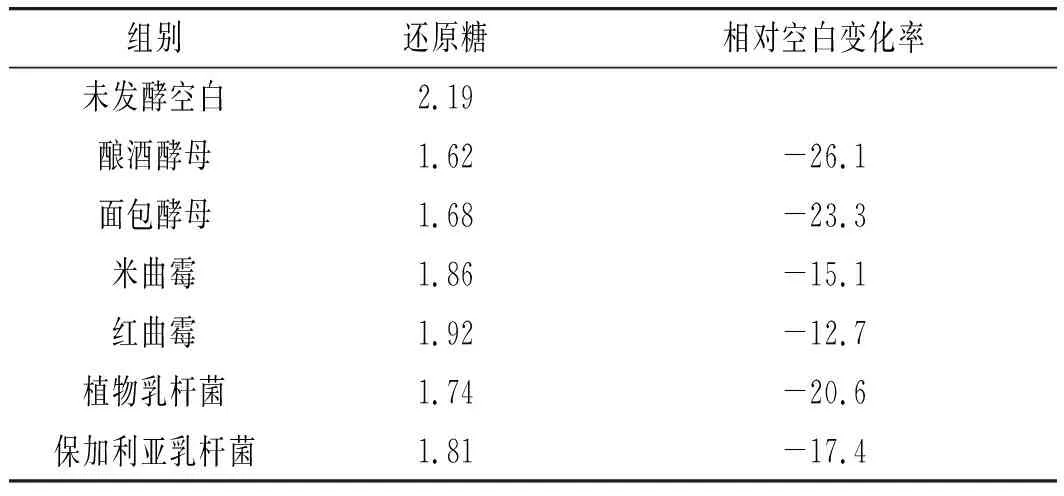
表3 不同菌种发酵后铁皮石斛还原糖含量的变化Table 3 Reducing sugar content of Dendrobium candidum fermented by different strains %
由表3可知,与未发酵空白相比,发酵后还原糖含量都有所降低,其中酵母发酵后还原糖含量减少最多,其次为乳酸菌,最后为曲霉,可能是由于酵母体内无淀粉酶系,酵母的生长直接消耗还原糖,且发酵过程中生长代谢活动旺盛,糖的消耗速度快。
2.1.3 不同菌种对铁皮石斛多糖分子量的影响
由表4可知,采用6种不同菌种发酵后,多糖分子量均有一定程度的变化。其中酵母和乳酸菌发酵后多糖分子量显著降低,曲霉发酵后多糖分子量小幅度增长,可能是由于在发酵过程中酵母和乳酸菌产生的酶系使得大分子多糖降解,分子量降低。

表4 不同菌种发酵后铁皮石斛多糖分子量的变化Table 4 Molecular weight of polysaccharide from Dendrobium candidum fermented by different strains
2.2 不同菌种发酵对抗氧化性的影响
2.2.1 不同菌种发酵对DPPH自由基清除率的影响

图1 不同菌种发酵过程中DPPH·清除能力的变化Fig.1 Changes of DPPH· scavenging capacity during fermentation by different strains
由图1可知,发酵后铁皮石斛对DPPH自由基的清除能力有所提高,不同菌种在发酵0~6 d的过程中发酵液对DPPH自由基的清除率总体呈现先升高后降低的趋势。不同菌种由于发酵特性的差异使得其最佳发酵时间和DPPH自由基清除能力存在一定差异。相对而言,酵母和乳酸菌发酵到DPPH清除率最高时所需时间较短,可能是由于其延缓期较短。面包酵母发酵后其发酵液对DPPH自由基的清除能力最强,可能是由于酵母发酵后多糖得到水解,裸露的羟基较多,使其抗氧化活性比发酵前多。
2.2.2 不同菌种发酵对OH 自由基清除率的影响
由图2可知,发酵有助于增强铁皮石斛对OH自由基的清除能力,不同菌种发酵后发酵液对OH自由基的清除能力高于其对DPPH自由基的清除能力,但总体变化趋势与图1近似相同,除个别菌种OH自由基清除率最高处所对应的发酵时间有所不同。面包酵母发酵3天时发酵液对OH自由基的清除能力最强,达到38.2%。
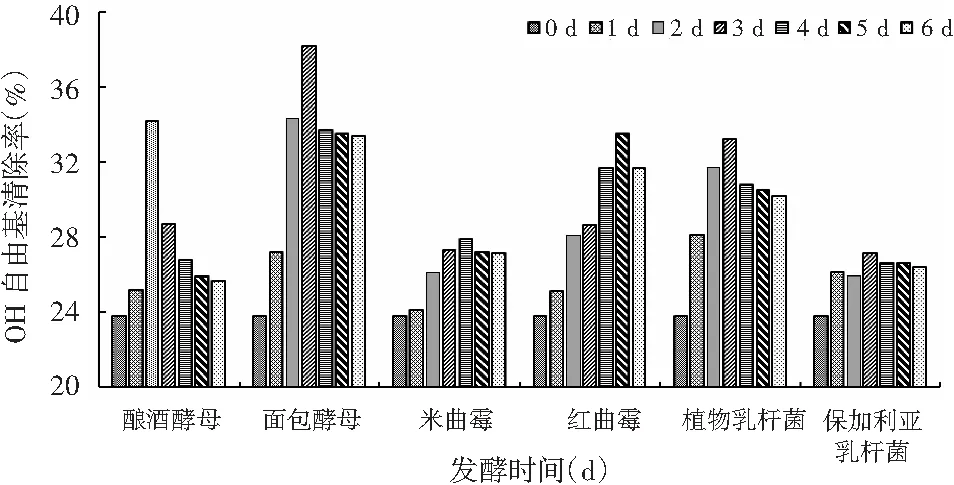
图2 不同菌种发酵过程中·OH清除能力的变化Fig.2 Changes of ·OH scavenging capacity during fermentation by different strains
2.2.3 不同菌种发酵对ABTS自由基清除率的影响
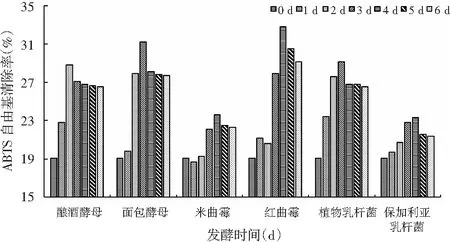
图3 不同菌种发酵过程中ABTS自由基清除能力的变化Fig.3 Changes of ABTS free radical scavenging capacity during fermentation by different strains
由图3可知,发酵后铁皮石斛对ABTS自由基的清除率高于未发酵空白,菌种发酵过程中发酵液对ABTS自由基清除能力的变化规律与DPPH和OH的变化趋势近似相同,但是清除率最高点所对应的发酵时间有所差异。发酵液对ABTS自由基的清除率高于OH自由基低于DPPH自由基。红曲霉发酵后发酵液对ABTS自由基的清除率最高,为32.8%,其次为面包酵母(31.2%)。由图1~图3可知,发酵可以提高铁皮石斛的体外抗氧化能力,这可能是因为发酵后铁皮石斛多糖分子量下降,鲍素华等[20]研究表明抗氧化活性与分子量大小有关,分子量最低的DSP1对 DPPH的清除作用、总抗氧化能力、抑制H2O2诱导红细胞氧化溶血和抑制Fe2+-VC诱导的小鼠肝匀浆脂质过氧化作用效果最佳,同时发酵可以使活性位点暴露并通过发酵产生黄酮等抗氧化物质。
2.3 不同菌种发酵对体外降血糖活性的影响
2.3.1 不同菌种发酵对α-淀粉酶抑制率的影响
由图4可知,发酵液在0~6 d范围内对α-淀粉酶的抑制率随着发酵时间的增加呈现先上升后下降的趋势。相比而言,红曲霉发酵后对α-淀粉酶的抑制活性最强,在发酵第5天时,其对α-淀粉酶的抑制率最高,为22.6%,比未发酵空白提高了86.7%,可能是由于红曲霉在发酵过程中代谢产生的多酚、黄酮等次生代谢物具有较好的降血糖作用。

图4 不同菌种发酵发酵过程中α-淀粉酶抑制率的变化Fig.4 Changes of α-amylase inhibition rate during fermentation by different strains
2.3.2 不同菌种对α-葡萄糖苷酶抑制率的影响

图5 不同菌种发酵过程中α-葡萄糖苷酶抑制率的变化Fig.5 Changes of α-glucosidase inhibition rate during fermentation by different strains
由图5可知,不同菌种发酵过程中α-葡萄糖苷酶抑制率的变化趋势与3种自由基清除能力的变化规律十分相似,均先增加后降低且活性均高于发酵原点。与图4相比,发酵液对α-葡萄糖苷酶的抑制能力更强。铁皮石斛可以通过抑制α-葡萄糖苷酶活性来抑制糖类分解成葡萄糖,同时阻止葡萄糖在肠道内的吸收,最终达到降低血糖的目的,因此将天然绿色的铁皮石斛多糖研制为降糖保健品具有可行性和市场需求性。发酵后的米曲霉和红曲霉对α-葡萄糖苷酶的抑制率最大值分别为26.9%和27.7%。
3 结论
采用6种不同菌种发酵后,铁皮石斛多糖含量和活性都有一定程度的变化。因为微生物在生长过程中需要消耗糖,所以发酵后除曲霉外,其余菌种的多糖和还原糖均有所下降,且多糖分子量降低。发酵后,铁皮石斛对自由基的清除能力和体外降血糖能力明显提高,说明发酵可以作为增强铁皮石斛功能和开发铁皮石斛保健品的重要手段之一。其中面包酵母发酵后发酵液对自由基的清除能力最高,红曲霉发酵后发酵液对α-葡萄糖苷酶和α-淀粉酶的抑制活性最强。综合考虑,红曲和面包酵母可以明显改善铁皮石斛活性,且在调味品中应用较为广泛。因此,可在后续研究中考虑将铁皮石斛加入发酵型调味品中,既可以为微生物生长繁殖提供碳水化合物,也可以提高调味品的营养价值。

