新辅助化疗联合微创手术治疗局部晚期食管癌的疗效观察
祝函函
(广东省东莞市常平医院,东莞市 523560)
在我国,食管癌是临床上较为常见的恶性肿瘤,根据世界卫生组织报告,世界范围内约有50%的食管癌患者出现在我国境内[1]。目前临床上治疗食管癌的主要方式为手术,但由于40%~50%的患者在就诊时癌症已经发生远处转移,单纯依靠外科手术治疗的成功率较低。因此综合疗法已经成为临床研究的重点,其中新辅助化疗可以降低肿瘤活性,提高手术可切除率,进而提高患者的总生存率,整体治疗效果较佳。现以局部晚期食管癌患者50例作为研究对象,旨在探讨手术联合新辅助化疗的临床疗效。报告如下。
1 资料与方法
1.1 一般资料 选取2014年6月至2018年6月在我院治疗的局部晚期食管癌患者共50例作为研究对象。所有患者均经纤维胃镜、彩色超声及CT检查确诊;均未发现锁骨上淋巴结以及其他重要脏器有癌细胞转移。其中实施常规食管癌根治术的25例患者为对照组,应用新辅助化疗联合微创手术治疗的25例患者为观察组。对照组男11例,女14例;年龄39~70(55.95±5.61)岁;TNM分期 Ⅱ期15例,Ⅲ期10例。观察组男9例,女16例;年龄40~71(55.83±5.17)岁;TNM分期 Ⅱ期17例,Ⅲ期8例。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究通过我院医学伦理委员会审核批准,患者均知情同意。
1.2 方法
1.2.1 对照组 实施常规的食管癌根治术,根据肿瘤位置进行开胸手术,开胸后实施区域淋巴结的清扫。术后4周开始进行放射治疗,治疗区域为双锁骨上淋巴引流区和全纵隔区。先进行单前野放疗,再进行两侧水平野放疗,根据患者情况,适当调整剂量。
1.2.2 观察组 采取新辅助化疗联合微创手术治疗,具体方法如下。(1)新辅助化疗:紫杉醇175 mg/m2配合奈达铂80 mg/m2,连续化疗3周为1个疗程,共化疗2个疗程。化疗前先对患者进行血常规和肝肾功能的检测,指标基本正常时方可开始化疗。完成2个疗程的化疗之后,患者休息3周,再进行手术治疗[2]。(2)微创手术:采取侧俯卧体位或接近90°的侧卧体位,进行双腔气管插管。在患者的左颈部、右胸部、上腹部做3个切口进行手术。首先切断奇静脉弓,沿着右侧的迷走神经,切开食管床上纵隔胸膜,对纵隔淋巴结和喉返神经旁的淋巴结进行清扫,使用电凝钩、超声刀等手术器械,交替进行锐性和钝性分离;再沿着食管系膜,对食管及其周围的淋巴结进行整体切除。如果肿瘤体积较大,可以先对肿瘤上下缘进行分离,如果肿瘤分期为T3以上,则选择在腹腔镜下使用直线切割缝合器切除肿瘤,同时离断食管[3]。分离食管的范围,从胸廓入口处至膈水平处,同时对纵隔淋巴结进行系统清扫。腹部使用腹腔镜进行手术操作,先沿胃网膜右动脉弓外侧对胃大弯进行游离,离断胃段血管、胃网膜左动脉、胃结肠韧带、脾胃韧带,在小弯侧切断肝胃韧带,对胃左动脉进行游离和离断,对胃部进行游离,上到膈肌食管裂孔,下到幽门远端,对腹腔内的各组淋巴结进行清扫,最后对膈肌裂孔进行游离,并扩张至5 cm左右。在左侧胸锁乳突肌前缘约6 cm处做切口,游离颈段食管,操作时注意保护喉返神经,清扫颈部淋巴结[4-5]。将制作好的管状胃,经过裂孔,沿着食管床提升至颈部,然后与颈部的食管进行吻合。
1.3 观察指标 观察并记录两组患者的手术时间、术中出血量、住院时间、淋巴结清扫数目、并发症情况、术后生存率及生存质量[4]。
1.4 统计学方法 选用SPSS 17.0统计学软件对数据进行分析,计量资料用均数±标准差(x±s)表示,组间比较用t检验;计数资料用例数(n)或百分率(%)表示,组间比较用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 手术情况 观察组术中出血量、住院时间少于对照组,淋巴结清扫数目多于对照组,差异均有统计学意义(P<0.05)。两组患者手术时间比较,差异无统计学意义(P>0.05)。见表1。
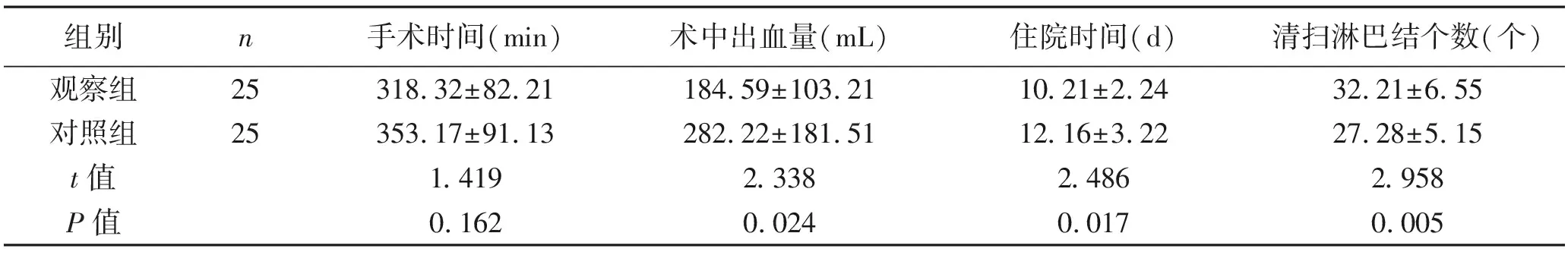
表1 两组患者的手术情况比较 (x±s)
2.2 并发症情况 观察组共出现4例并发症,并发症发生率为16.0%;对照组共出现11例并发症,并发症发生率为44.0%。观察组并发症发生率明显低于对照组,差异有统计学意义(P<0.05)。见表2。
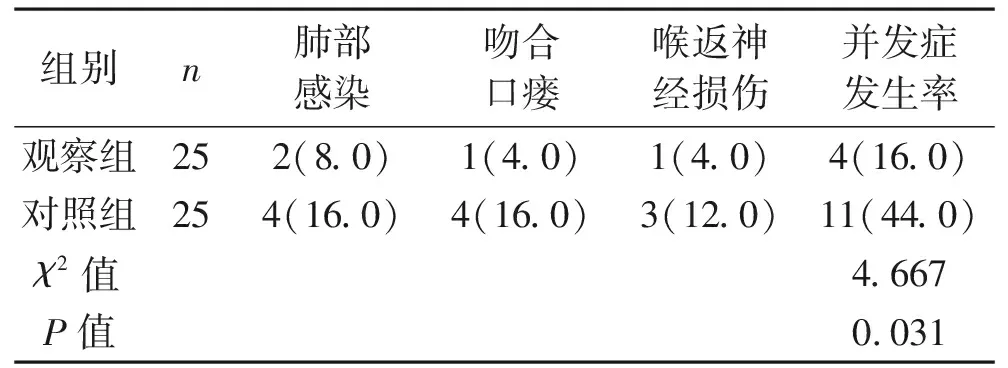
表2 两组患者的并发症情况 [n(%)]
2.3 短期生存率 观察组患者术后6个月的生存率为96.0%,术后1年生存率为84.0%;对照组术后6个月的生存率为76.0%,术后1年生存率为56.0%。观察组术后6个月、术后1年生存率均明显高于对照组,差异有统计学意义(P<0.05)。见表3。
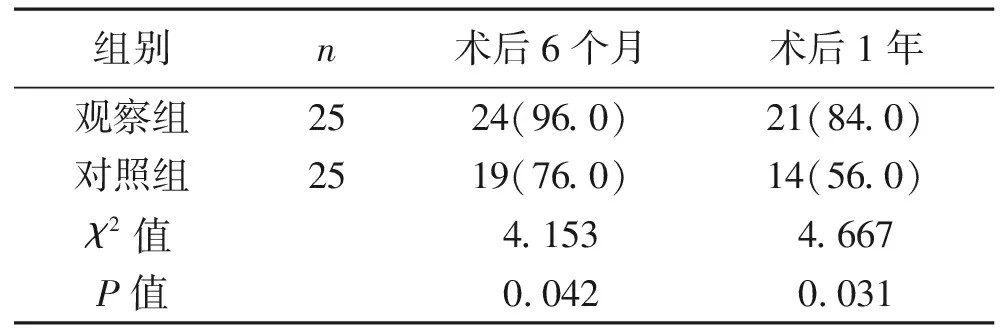
表3 两组患者的术后短期生存情况比较 [n(%)]
2.4 生存质量 术前两组患者生存质量评分比较,差异无统计学意义(P>0.05);术后两组患者生存质量评分均明显提高,与术前相比,差异有统计学意义(P<0.05);且术后6个月、术后1年观察组生存质量评分均高于对照组,差异均有统计学意义(P<0.05)。见表4。
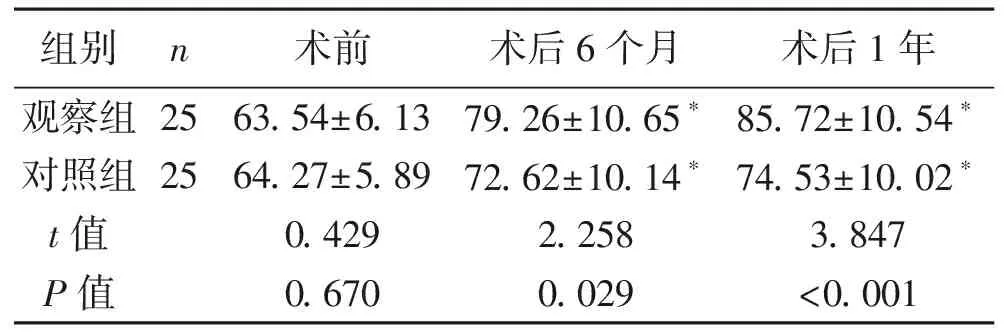
表4 两组患者的生存质量评分比较 (x±s,分)
注:与术前相比,*P<0.05。
3 讨 论
食管癌是临床上较常见的一种恶性肿瘤,具有较高的死亡率。单纯应用手术治疗的5年生存率相对较低,仅为20%左右,因此针对局部晚期食管癌的综合治疗手段成为临床研究的重点[6]。新辅助化疗可以有效降低肿瘤分期,缩小肿瘤,同时在抑制术中癌细胞扩散及消灭亚临床转移灶等方面也发挥着重要的作用。和术后进行常规化疗的患者相比,新辅助化疗患者对化疗的接受能力更强,利于化疗效果的评估以及手术相关事宜的协调,从而提高治疗有效率。但新辅助化疗对手术的风险以及术后并发症的影响还需要进一步研究。在进行新辅助化疗后再进行手术有可能增加手术风险,同时若化疗效果较差,甚至无效果,可能会造成手术的延迟,从而增加了病变扩散的概率[7]。
对于T3、T4a、N1-2的局部晚期食管癌患者,若不存在化疗禁忌证,应优先考虑新辅助化疗手段。但对于高龄患者,由于其可能存在多种脏器疾病,且行为表现量表(KPS)评分较低,应慎重选用新辅助化疗。目前国内外报道中均未明确说明新辅助化疗后手术的最佳时机[8]。在新辅助化疗之后,患者免疫力会出现明显下降,同时机体也会受到一定程度的损伤,因此本院选择在化疗后3周再进行手术。
临床上通常选用丝裂霉素、氟尿嘧啶、博来霉素以及甲氨蝶呤作为食管癌的化疗药物,其效率较高,单药有效率在15%~30%。近几年来,紫杉醇、伊立替康以及西紫杉醇等抗肿瘤药物的应用越来越广泛,多与铂类联合应用于局部晚期食管癌患者的治疗,其有效率高达50%,且安全性较高,不会增加并发症的发生率[9]。
新辅助化疗可以降低肿瘤活性,提高手术可切除性,进而提高患者的总生存率,整体治疗效果较佳。而微创手术可以减少对患者身体的损伤,更适用于耐受度较差的患者,有助于帮助患者缩短手术时间,减少术中出血量,改善预后。本研究结果显示,观察组患者术中出血量、住院时间、淋巴结清扫个数等方面均优于对照组;并发症发生率明显低于对照组(P<0.05)。观察组患者术后6个月、1年的生存率均明显高于对照组,生存质量评分明显高于对照组(均P<0.05)。
综上所述,新辅助化疗联合微创手术治疗局部晚期食管癌的效果理想,可以显著提高手术疗效,明显改善预后,提高患者的近期生存率,值得临床推广应用。

