HA-His/PEI-His/DNA纳米复合载体的制备及基因转染研究
田慧慧, 吴 婧, 伍亚玲, 徐 政, 陈荆晓, 陈敬华
(江南大学 药学院,江苏 无锡 214122)
随着人类基因组计划的开展,基因与多种重大疾病之间的关系受到人们的关注。基因疗法作为一种将外源性基因导入靶细胞,用于治疗因基因缺陷或异常所引起疾病的方法,对治疗癌症、心血管疾病、遗传病等多种重大疾病具有较高的潜力[1-2]。大量研究表明,载体是影响基因治疗效果的关键因素之一。利用安全、稳定的载体不仅能有效保护目的基因不被体内的酶降解[3],还有助于提高基因的传递和转染效率。
目前,临床研究中更倾向于使用以聚乙烯亚胺(polyethylenimine,PEI)为代表的非病毒载体。这主要是因为非病毒载体不仅易制造、易修饰、价格低廉,还能够避免病毒载体诱发的生物安全性方面的缺陷[4-5]。病毒载体可能在染色体上随机插入激活原癌基因,诱导强烈的免疫反应而造成其他病症[6]。PEI这种阳离子高分子材料,可以有效压缩DNA并将其传递至细胞内,进而通过“质子海绵”效应释放目的基因进入细胞核,实现高效转染[7]。不过,PEI高正电荷密度的性质也导致其容易破坏细胞膜结构,从而表现出较高的细胞毒性。PEI还易与带负电荷的血浆蛋白结合,在血液循环过程中被机体清除[8]。此外,PEI缺乏对肿瘤细胞的识别能力,在治疗过程中不具有选择性。为解决上述问题,研究人员尝试用可断裂的化学键交联低相对分子质量PEI,或对其表面进行修饰,以降低其电荷密度,提高靶向性[9]。另一策略是利用电荷相互作用,将PEI与负电性材料结合,得到纳米聚电解质复合物作为载体[10-11]。有报道用带弱负电的透明质酸 (hyaluronic acid,HA)与PEI制备聚电解质复合物,不仅能够避免与血浆蛋白吸附,还可以利用HA与肿瘤细胞表面过度表达的CD44受体之间的识别作用,提高对肿瘤细胞的靶向性[12]。除此之外,HA作为一种天然多糖还具有生物相容性好、可生物降解的优点[13]。然而,聚电解质复合物依赖于聚阳离子和聚阴离子化合物之间的电荷相互作用[14],这会造成聚阴离子与DNA之间竞争,导致DNA包裹不够紧密而泄漏,降低转染效率。因此,如何提高载体稳定性,防止DNA泄漏失活,是这类材料实现高效基因传递的关键。
组氨酸(Histidine,His)是一种广泛用于 pH敏感性材料制备的氨基酸。由于His分子结构中含有咪唑基团(pKa~6.0),其在生理pH 7.4条件下表现为疏水性,在pH<6时又吸收质子表现出亲水性[15]。利用His的这一特性,本研究中用His分别修饰PEI和 HA,制备 PEI-His(PH)和 HA-His(HH),之后通过正负电荷吸附,两步包载得到HH/PH/DNA(HPD)复合物。PEI经His修饰能降低表面电荷密度,从而降低其细胞毒性;同时保持对DNA的包裹能力。HA经His修饰,可减少其与DNA间对电荷的竞争,利用His在生理pH下的疏水性,还能使复合物结构更加紧密。另外,利用HA对肿瘤细胞的识别作用,还可以提高材料传递基因时对肿瘤细胞的靶向性。
1 材料与方法
1.1 药品与试剂
HA(Mw:6.2×103),山东福瑞达生物化工有限公司产品;透明质酸酶 (HAase)、脱氧核糖核酸酶I(DNase I),上海生工生物工程股份有限公司产品;L-组氨酸(L-His)、1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐(EDC·HCl)、N-羟基丁二酰亚胺(NHS)、枝化 PEI(Mw:25 kDa)、噻唑蓝(MTT)、胰酶、上海阿拉丁试剂有限公司产品;RPMI 1640细胞培养基、DMEM 细胞培养基、胎牛血清(FBS),美国Gibco Invitrogen公司产品;pEGFP-N1 pDNA,美国Promega公司产品。
1.2 仪器
FreeZone 2.5 L型冷冻干燥机,美国Labconco公司产品;Avance III型核磁共振波谱仪(400 MHz),德国Bruker公司产品;JEM-2100型透射电子显微镜,日本JEOL公司产品;Zetasizer Nano ZS型激光粒度仪,英国Malvern公司产品;Multiskan GO型酶标仪,美国Thermo公司产品;DMIL/LED型荧光显微镜,德国Leica公司产品;FACSCalibur型流式细胞仪,美国BD公司产品。
1.3 细胞株
小鼠黑色素瘤细胞(B16)和非洲绿猴肾成纤维细胞(COS7),购自中国科学院上海生命科学研究院细胞保藏中心。
1.4PH和HH的制备
将200 mg和400 mg的His分别溶解于50 mL去离子水中,加入0.93 g EDC·HCl和0.70 g NHS,调节溶液pH至4~5,于室温搅拌1 h,之后分别加入8 mL的PEI溶液(25 mg/mL),调节pH至 7.4,继续反应24 h,反应结束后将溶液装入透析袋,对去离子水透析除去未反应的His及杂质,冻干得PH1和PH2,用1H NMR验证其结构。
将100 mg的HA溶于50 mL去离子水中,加入 72.8 mg EDC·HCl和 43.7 mg NHS,反应 1 h 后,向溶液中加入78.5 mg His。室温搅拌24 h后,将溶液装入透析袋,对去离子水透析除去未反应的His及杂质,冻干得HH,用1H NMR验证其结构。
1.5 PD和HPD复合物的制备
将 1 mL pDNA 溶液(100 μg/mL)加入到 1 mL不同质量浓度的 PH1 和 PH2 溶液(20、50、100、200、500 μg/mL)中,涡旋振荡,室温静置 30 min,得到具有不同 PH/DNA 质量比(分别为 1∶5,1∶2,1∶1,2∶1,5∶1)的复合物,分别标记为 PD1 和 PD2。
将 1 mL pDNA 溶液(100 μg/mL)滴加到 1 mL PH1 溶液(200 μg/mL)中,涡旋振荡,室温静置 30 min,之后将所得PD复合物溶液滴加到不同质量浓度的 2 mL HH 溶液(150、200、250、300、350 μg/mL)中,涡旋振荡,室温静置30 min,得到具有不同HH/PH1/DNA 质量比(分别为 3∶2∶1,4∶2∶1,5∶2∶1,6∶2∶1,7∶2∶1)的 HPD 复合物。
1.6 PD和HPD的表征
取18 μL上述制备的PD和HPD复合物,加入2 μL Loading Buffer(10×),通过琼脂糖凝胶电泳检测复合物对DNA的包载能力,用凝胶成像系统记录实验结果;取1 mL上述制备的PD和HPD复合物用粒径仪测定复合物的平均粒径及ζ-电位,通过TEM观测HPD复合物的微观形貌。
1.7 复合物酶稳定性实验
参照1.5中方法制备HPD复合物,取15 μL溶液,在不同样品中分别加入 1 μL HAase(3 U/μL)和1 μL DNase I(10 U/μL),另取 3 μL 裸 pDNA 溶液直接加入 1 μL DNase I(10 U/μL),样品于 37 ℃孵育30 min,再于65℃加热20 min终止反应,所有样品用超纯水补齐体积至 18 μL,加 2 μL Loading Buffer(10×),之后进行琼脂糖电泳实验,用凝胶成像系统记录实验结果。
1.8 细胞毒性实验
材料的细胞毒性用B16和COS7细胞进行测试。将细胞分别以8000个/孔的密度接种于96孔板,B16细胞用含体积分数为10%FBS的1640培养基培养过夜,COS7细胞用含体积分数10%FBS的DMEM培养基培养过夜。之后小心移去培养基,加入 100 μL 含不同质 量浓度 (1、10、20、50、100、200、300、500 μg/mL)PEI、PH 和 HH 的培养基溶液,其中PEI溶液质量浓度与PH1、PH2溶液中对应的PEI质量浓度一致,继续在37℃培养箱中培养24 h。吸去培养基,每孔加入100 μL MTT溶液,37℃下继续培养 4 h后吸除MTT,每孔再加入 100 μL DMSO混合均匀,用酶标仪测定其在570 nm下的光密度值(OD570),计算细胞存活率,如下式(1)。

以不加样品作为空白对照,每组3个平行样。
1.9 细胞转染实验
以pEGFP-N1 pDNA为报告基因进行转染实验。首先将细胞以2×105个/孔的密度接种到6孔板中,吸出培养基后,加入1 mL含复合物的培养基溶液,其中pDNA的质量为4 μg,于37℃的培养箱中培养4 h后,吸出含药培养基,加入1 mL含体积分数为10%FBS的新鲜培养基,于37℃的培养箱继续培养20 h,用无菌PBS缓慢冲洗3次,用倒置荧光显微镜观察并拍照。细胞用胰酶消化,用PBS制成细胞悬液,用流式细胞仪对细胞转染情况进行定量检测,以空白细胞作为阴性对照,以PEI/DNA(N/P=10)复合物为阳性对照,每组3个平行样。其中,PD 复合物的质量比分别为 1∶2、1∶1、2∶1,HPD 复合物的质量比为 7∶2∶1。
2 结果与讨论
2.1PH以及HH的1H NMR谱图分析
PH和HH分别用1H NMR表征其化学结构。见图 1(a),在 2.9~3.20(m,4H,-CH2CH2-)处为 PEI分子中亚甲基的氢,7.25(s,1H,-N=CH-)为 His咪唑环上的 H-2,8.02(s,1H,-N=CH-)为 His咪唑环上的H-1,表明His已成功连接到PEI分子。通过峰面积计算His在PH1中取代度为3.2%,在PH2中取代度为 7.3%。 见 1(b),1.98(s,3H,CH3-CO-)处为HA 上 N-乙酰甲基的氢,7.22(s,H,-N=CH-)为 His咪唑环上的 H-b,8.49(s,1H,-N=CH-)为 His咪唑环上的H-a,表明His已成功连接至HA分子,通过峰面积比计算得到His在HH上的取代度为6.2%。

图1 PH1、PH2与HH的化学结构及核磁共振谱图Fig.1 Chemical structures and1H NMR spectra of PH1,PH2 and HH
2.2 PD的琼脂糖凝胶电泳
材料对DNA的有效包载是实现转染的首要条件,因此先通过琼脂糖凝胶电泳测试2种PH对DNA的包载能力。从图2中可以看出,当PEI/pDNA的质量比为1∶5时,PEI即可完全包载pDNA,而当PD1的质量比大于 1∶5,PD2的质量比大于 1∶2时,可在孔中观察到pDNA条带,说明此时载体可包载pDNA并形成复合物,pDNA不会随电场在凝胶中移动。与PEI相比,PH包裹DNA的能力有所减弱,这是因为经His修饰,PH1和PH2与PEI相比,其表面的正电荷密度有所降低所致,但其对DNA的复合能力得以保持。由于His在PH1上的取代度(3.2%)低于在PH2上的取代度(7.3%),因而PH1携带更多的正电荷,其对DNA的包载能力更强。


图2 PEI/pDNA、PD1与PD2复合物的琼脂糖凝胶电泳阻滞图Fig.2 Agarose gel electrophoresis of PEI/pDNA,PH1/pDNA and PH2/pDNA complexes
2.3 PD的平均粒径和电位
PD复合物的平均粒径和ζ-电位如图3所示。2种PH都可以有效压缩pDNA形成纳米尺度的复合物。随着质量比逐渐增加至5∶1,PD1和PD2复合物的平均粒径分别减小至103 nm和112 nm,而ζ-电位则逐渐增加至53 mV和40 mV。对于2种PD而言,当质量比大于1∶2时,载体表面携带正电荷,这表明PH已经完全包载pDNA,该结果与琼脂糖凝胶电泳试验结果一致。同质量比条件下,由于PH1比PH2的正电荷密度更高,因此PD1的ζ-电位更高,其在溶液中稳定性也更好。根据粒径和ζ-电位的值,选用质量比为 1∶2、1∶1 和 2∶1 进行 2 种复合物的转染试验,以找出其最佳转染条件。

图3 PD1、PD2复合物的平均粒径及ζ-电位Fig.3 Average size and ζ-potential of PD1 and PD2 complexes
2.4 PD复合物转染性能评价
PD复合物介导的转染效率通过流式细胞仪进行定量检测,结果如图4所示。可以看出,在PD1和PD2的质量比为2∶1时,PH1能够更为有效地介导pDNA实现转染,效率明显高于PH2。由于复合物进入细胞介导DNA转染依赖于其粒子大小,以及粒子表面正电荷与细胞膜表面负电荷之间的相互作用。PD1较PD2而言,其ζ-电位更高,而其平均粒径更小,因而更利于其传递更多的pDNA进入细胞。当2种PD的质量比为1∶1和1∶2时,转染效率偏低,这可能是因为其表面电荷密度下降,且复合物粒径偏高导致其进入细胞的效率降低所致。因而选用PH1/pDNA的质量比为2∶1进行下一步实验。

图4 pDNA/PEI、PD1和PD2复合物对B16细胞诱导的基因转染的流式分析图Fig.4 Flow cytometric analysis of pDNA/PEI,PH1/pDNA and PH2/pDNA induced gene transfection with B16 cells
2.5HPD的DNA包载能力
从HPD复合物平均粒径及ζ-电位图 (图5)中可以看出,随着质量比的变化,复合物的粒径趋于稳定。质量比为4∶2∶1时,复合物表面ζ-电位接近于0 mV,复合物之间受到的表面电荷的排斥力减小,产生团聚,导致粒径增大。当质量比调节至5∶2∶1时,复合物的粒径减小至183 nm,ζ-电位减小至-8 mV。当质量比变为 7∶2∶1时,HPD 复合物粒径为109 nm,这一尺寸适合复合物粒子进入细胞,而其ζ-电位逐渐降低达到-15 mV,表明PD1已经完全被HH包裹。HPD粒子表面呈负电荷,可以减少与血清蛋白吸附,增加材料在体内的循环时间。后续选用HPD质量比为7∶2∶1进一步测试。
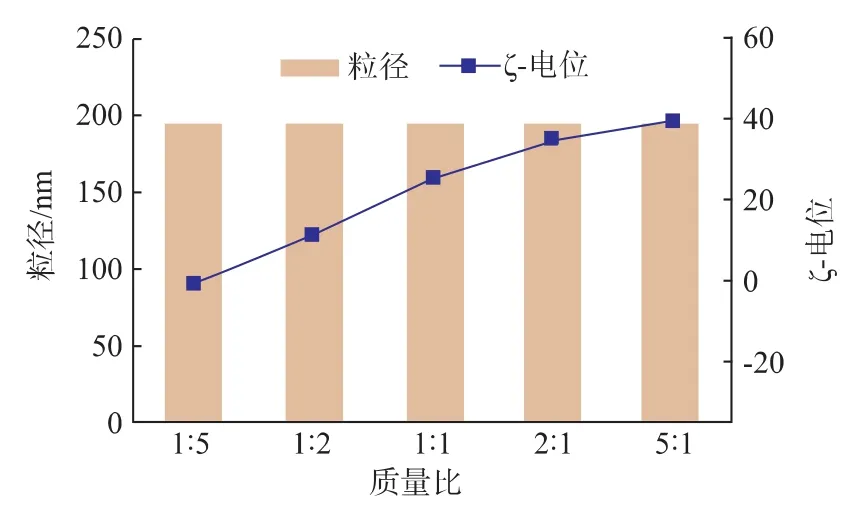
图5 HPD复合物的平均粒径及ζ-电位Fig.5 Average size and ζ-potential of HH/PH1/pDNA complexes
HPD复合物的琼脂糖凝胶电泳实验结果如图6。结果显示,HPD复合物在每个胶孔中均能观察到明亮的DNA条带,与裸DNA相比,复合物没有产生与其同一位置的条带,说明DNA并未随HH/PH/pDNA质量比的变化而从复合物内部泄漏。这也说明HH的加入并未影响内部PD复合物的稳定性。这是因为本研究设计中引入的His分子在pH 7.4环境下表现出疏水性,这使得HH表现出两亲性,当其包裹于PD表面时,His会因为疏水作用而进一步向内压缩PD,不仅能有效避免因电荷竞争而导致DNA泄漏,还能保持复合物的粒径大小不受影响。

图6 HPD复合物的琼脂糖凝胶电泳阻滞实验谱图Fig.6 Agarose gel electrophoresis of HPD complexes
2.6 HPD的形貌和血清稳定性
采用透射电镜观测HPD复合物的形貌 (图7(a))。从图中可以看出,复合物为规整球形,尺寸均一且分布均匀,其在干态下的平均粒径约为60 nm。采用DLS测得复合物在水相中的平均粒径 (图7(b))为109 nm。这与HPD表面亲水性的HH在水介质中处于水合伸展状态有关。通过加入体积分数为10%FBS验证HPD在含血清溶液中的稳定性,结果如图7(c)所示,100 nm以下为血清中的固有粒子峰,这说明HPD的粒径分布并未因加入FBS而发生变化。这是由于HPD复合物表面带负电,可拮抗同样带有负电的血清。因而HPD复合物具有良好的血清稳定性,不会与血清蛋白吸附团聚而被代谢清除。


图7 HPD复合物的透射电镜图,溶液中有或无体积分数为10%血清时HPD复合物粒径分布Fig.7 TEM image of HPD complexes;size distribution of HPD complexes with and without 10%serum
2.7 HPD的酶稳定性
HPD复合物在不同条件下对pDNA的保护能力通过琼脂糖凝胶电泳进行测试。如图8所示,与裸DNA相比,加入DNA酶后,质粒被降解产生多条条带。HPD复合物经DNase I处理后,DNA依然处于胶孔中,且未发现被降解的DNA条带,这说明HPD不仅能负载DNA,还可有效保护DNA免于被DNA酶降解。而在与HAase作用后,DNA亦保留于胶孔当中,并未在泳道中出现条带,这说明即使HPD复合物表面的HA被酶降解,PD复合物仍然可保持稳定,并包载DNA。综上,HPD复合物的多层结构稳定,可有效包载并且保护DNA。
2.8 细胞毒性

图8 不同条件下的HPD复合物稳定性Fig.8 Agarose gel electrophoresis of HPD complexes treated with various enzymes
通过细胞存活率实验对材料的细胞相容性进行评价,结果如图9所示。在图9(a)中,对于B16细胞,在质量浓度低于20 μg/mL时,PEI与PH1的细胞毒性相差不大,而在质量浓度高于50 μg/mL时,PH1组的细胞存活率则明显更高,即使质量浓度达到500 μg/mL,PH1组细胞存活率仍可达到46%。而对于COS7细胞,PEI与PH1的细胞毒性在低质量浓度条件下即表现出明显差异,在200 μg/mL时,PH1组细胞存活率仍可达到40%以上,而这一质量浓度已经远高于转染实验时所使用的材料质量浓度。PEI的细胞毒性主要因为高正电荷密度会破坏细胞膜结构,致使细胞破裂而产生。当PEI经His修饰后,表面部分正电荷被屏蔽,从而降低了细胞毒性。图9(b)中可以看出,HH对B16细胞及COS7细胞基本无毒。当HA质量浓度为500 μg/mL时,B16和COS7细胞的存活率依然可达到96%和103%。因此,PH和HH都具有较好的细胞相容性。
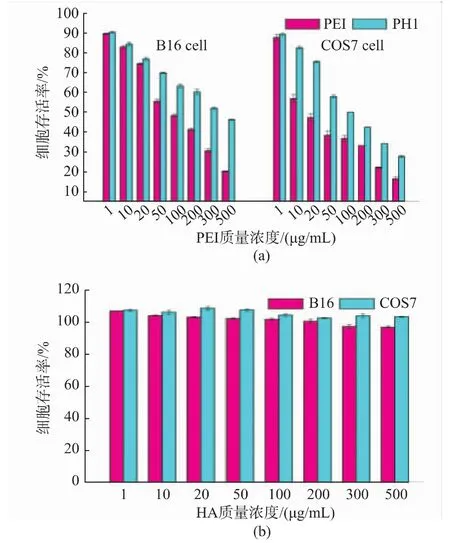
图9 PEI、PH1和HH对B16细胞、COS7细胞的体外细胞毒性Fig.9 In vitro cytotoxicity of PEI and PH1;HH against B16 and COS7 cells
2.9 HPD转染性能
以pEGFP-N1为报告基因测定HPD复合物的转染能力,转染后的荧光图以及流式细胞分析结果如图 10 所示。图 10(a)(I、III)中,PEI在 B16 细胞以及COS7细胞中介导的转染效率基本相同。从图10(a)(II、IV)中可以看出,在 B16 肿瘤细胞中出现了明显的绿色荧光,这说明HPD复合物已经成功介导基因转染,表达出绿色荧光蛋白。与COS7正常细胞相比,B16肿瘤细胞中表达产生的绿色荧光强度明显更高。此外,B16细胞中HPD介导的细胞转染与PEI/pDNA介导的细胞转染相比稍弱,COS7细胞中HPD介导的细胞转染与PEI介导的细胞转染则具有明显差距。该结果与图10(b)流式细胞仪结果一致,PEI在2种细胞中介导的基因转染产生的荧光强度基本相当,而HPD介导的在B16细胞中表达的平均荧光强度明显高于COS7细胞的荧光强度,可达到COS7细胞中荧光强度的2倍。这是由于B16细胞表面过度表达的CD44受体可以与HPD复合物表面的HH特异性识别,能够增加了肿瘤细胞对HPD复合物的摄取,从而提高转染效率。因此,HPD复合物对于肿瘤细胞的基因传递具有一定的选择性。
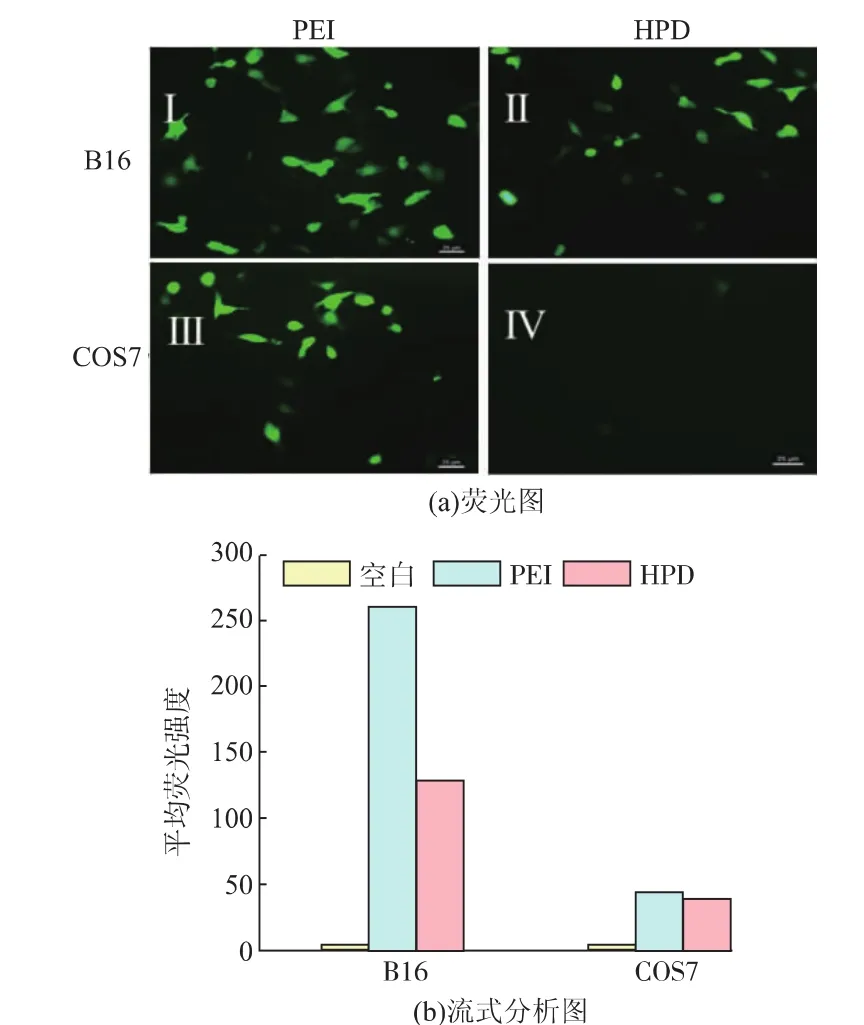
图10 PEI和HPD复合物对B16细胞、COS7细胞转染的荧光图和流式分析图Fig.10 Fluorescent images and flow cytometric analysis of gene transfection in B16 and COS7 cells
3 结语
通过His修饰获得了2种具有不同His取代度的PH以及一种HH。其中,His取代度为3.2%的PH1能够更为有效地包载DNA,形成尺度在103 mm的复合物,并介导高效的基因转染。之后通过二次复合,得到了HPD复合物,其在水溶液中尺寸均一,平均粒径为109 nm,ζ-电位为-15 mV,并且能够有效拮抗血清黏附,在DNase I和HAase存在条件下保持稳定,保护所包载的DNA不被酶降解。利用表面的HH与CD44受体的作用,HPD复合物可以对于肿瘤细胞介导高效的基因转染,对B16肿瘤细胞为COS7正常细胞中转染效率的2倍,体现出明显的选择性,并且材料经His修饰后,细胞毒性明显降低。综上所述,HPD复合物在基因转染研究具有较好的应用前景。

