川芎、冰片配伍对脑缺血大鼠海马和下丘脑神经元的保护作用
喻 斌,阮 鸣,许 立,刘圣金,许惠琴,沈祥春
(1. 南京中医药大学部省共建中药药理实验室,江苏省中药药效与安全性评价重点实验室,江苏 南京 210023;2. 南京晓庄学院食品科学学院,江苏 南京 211117;3. 贵州医科大学天然药物资源优效利用重点实验室,贵州 贵阳 550025)
根据国家心血管病中心发布的《中国心血管病报告2016》,我国居民的首要死因为脑血管疾病的省份有27个。此外,与1990年比较,缺血性脑卒中的死亡率上升了28.8%[1]。显然,脑血管疾病的防治目前仍然是医学研究的热点。神经元兴奋毒是脑缺血/再灌注后的后继反应,表现为兴奋性氨基酸触发以钙超载为代表的损伤反应,后者又反过来进一步加重神经损伤,形成恶性循环。
川芎和冰片配伍来自宋《圣济总录》卷十五“清神散”化裁而来。后者由川芎、莎草根、石膏、冰片4味药组成,主治脑中风、头痛等症。近年来临床研究表明,川芎-冰片配伍对脑缺血具有明显治疗作用[2]。我们前期研究发现,川芎的活性成分川芎嗪和冰片配伍后,对全脑缺血/再灌注(global cerebral ischemia reperfusion, GCIR)损伤大鼠的皮层、海马、下丘脑和纹状体均表现较好的改善作用[3],并且这一改善作用伴随着冰片剂量的差异,还表现出一定的脑区特异性[4]。在进一步的机制研究中,我们发现川芎嗪和冰片配伍抗脑缺血的作用机制与减少神经元凋亡和促进自噬形成有关[5-6]。考虑到川芎嗪为川芎的活性成分之一,川芎和冰片的配伍又涉及哪些机制呢?目前还未见研究报道。基于以上背景,我们开展本次研究。
1 材料与方法
1.1 药物与试剂川芎提取物的制备:川芎药材购于江苏省中医院,粉碎,过40目筛,加入20倍体积的50%乙醇,回流提取2 h,滤过,旋转蒸发回收溶剂,残渣用生理盐水(normal saline,NS)溶解,浓度为2.0 kg(生药量)·L-1。冰片购于北京同仁堂药店,北京三和药业有限公司生产,批号77820501。以上药材经本校中药鉴定教研室刘圣金副教授鉴定为正品。冰片溶液的配制方法为:取3.2 g,磨碎,加丙二醇溶解,加聚乙二醇400和吐温-80,再加水至100 mL,终浓度为32 g(生药量)·L-1。人工脑脊液(artificial cerebrospinal fluid,ACSF),配方为(mmol·L-1):KCl 2.5、NaCl 125、MgCl2·6 H2O 1.18、CaCl2·2 H2O 1.26、NaH2PO4·H2O 0.5、Na2HPO4·2 H2O 5。甘氨酸(glycine,Gly)、谷氨酸(glutamate,Glu)和γ-氨基丁酸(γ-aminobutyric acid,GABA)标准品,中国药品生物制品鉴定研究院,批号分别为20160817、20160115、20141211;Fluo-3/AM 探针(批号10F0402),美国Biotium公司;TUNEL凋亡测试盒(批号10768100),美国罗氏公司。
1.2 实验动物SPF级SD大鼠,♂,体质量(200±20)g,购于上海杰思捷实验动物有限公司,许可证号:SYXK(沪)2013-0006。
1.3 仪器微透析系统:RWD302型双通道微透析注射泵(深圳瑞沃德),配备A-Z-X-Y安全性脑用探针(内径/外径200/220 μm,截留分子量50 ku,日本Eicom公司);Agilent 7890A/5975C气-质联用仪(美国安捷伦),配有Agilent G4513A自动进样器、Agilent HP-5MS毛细管柱、Agilent色谱工作站和NIST2008质谱数据库;TCS-SP5型激光共聚焦显微系统(德国莱卡);IX71荧光显微镜(日本奥林巴斯)。
1.4 方法
1.4.1GCIR模型的复制及分组 按照文献方法进行4-动脉阻断法复制GCIR模型。麻醉大鼠,颈正中切口并分离双侧颈总动脉。颈背部正中切口,分离肌层,暴露第1颈椎横突翼孔,直视下电凝其下通过的椎动脉,使双侧椎动脉永久闭塞。术后大鼠缝皮回笼。24 h后用无创小动脉夹夹闭双侧颈总动脉,造成全脑缺血。缺血20 min,松开动脉夹再灌注。按照Pulsinelli等[7]报道确定模型成功标准,将造模成功的大鼠分为4组:模型组、川芎组(1.0 g·kg-1)、冰片组(0.16 g·kg-1)、川冰组(1.0 g·kg-1川芎+0.16 g·kg-1冰片),另制备假手术组。模型组和假手术组给予NS。连续灌胃给药7 d后进行后续检测。
1.4.2Glu、Gly和GABA的测定
1.4.2.1脑微透析液的收集 大鼠麻醉后,用脑立体定位仪固定,剔除大鼠脑部的毛发,剪开皮肤,剥离皮下组织至脑壳,按照海马和下丘脑的脑区坐标(海马AP -3.8 mm, ML +2.0 mm, DV -3.0 mm,下丘脑AP -2.0 mm, ML +0.4 mm, DV -8.2 mm),用牙科钻打穿脑顶位置的投射点,植入微透析探针。探针灌注ACSF,在整个实验期间保持2.0 μL/min的流速。整个系统稳定1.5 h后,两个脑区同时进行微透析,透析30 min后,透析液于-80 ℃存储。微透析完毕后,取脑于福尔马林固定,组织学检查以确定探针位置是否正确,如不正确,则该样本不计。
1.4.2.2样本预处理 取样本50 μL于1.5 mL离心管中,加入350 μL(1 ∶50)稀盐酸,涡旋振荡30 s,上清液用真空离心浓缩仪浓缩。加入60 μL甲氧基溶液(15 g·L-1,溶于吡啶)涡旋振荡30 s,在37 ℃条件下反应2.5 h,最后加入60 μL BSTFA试剂(含1%三甲基氯硅烷),37 ℃条件下反应3 h。经过以上的反应,用GC-MS联用仪进行检测。根据Glu、Gly和GABA的标准曲线进行定量。
1.4.2.3色谱条件 色谱柱HP-5MS毛细管柱(30 m×0.25 mm×0.25 μm);分流进样,进样量1 μL,分流比20 ∶1。进样口温度280 ℃,离子源温度250 ℃,接口温度150 ℃。程序升温起始温度70 ℃;保持2 min,以10 ℃·min-1升至300 ℃,保持5 min。总运行时间为30 min, 载气为氦气,载气流速1 mL·min-1。MS条件:倍增电压1 787 V,电子轰击离子(EI)源,电子能量70 eV,扫描方式:全扫描,检测质荷比范围50~300 m/z。
1.4.3脑内钙离子浓度的测定 参照文献方法,大鼠断头,迅速取脑,浸入0 ℃预先饱和混合氧气(95% O2+5% CO2)的ACSF。分离出海马和下丘脑组织后,经振动切片机制成400 μm厚的脑片,移入ACSF中,室温下恢复孵育60 min后,在37 ℃含Fluo-3/AM(10 μmol·L-1)的ACSF中再孵育30 min,选择在3~5 min保持荧光值稳定的神经元进行监测,检测时使用双激发单发射的方式进行扫描,双激发波长分别为340 nm和380 nm,发射波长为505 nm,细胞内游离Ca2+浓度由2种波长荧光强度的比值(F340/F380)反映。
1.4.4凋亡率的测定 取脑组织,分离出海马和下丘脑后,于4%多聚甲醛溶液固定,包埋、切片,按照试剂说明书方法进行染色,封片、干燥后,在光学显微镜下观察。凋亡细胞以细胞核呈棕黄色着色为阳性细胞。在高倍镜下计数200个细胞中阳性细胞所占百分率。
1.4.5电镜检测 取海马和下丘脑组织,于2.5%戊二醛固定后,经0.1 mol·L-1磷酸漂洗、1%锇酸固定,脱水、包埋、固化、超薄切片后,3%醋酸铀-枸橼酸铅双染色,透射电镜观察、摄片。
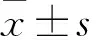
2 结果
2.1 川芎和冰片配伍对GCIR大鼠海马和下丘脑组织中Glu、Gly和GABA含量的影响GC-MS检测的代表性总离子流图见Fig 1,可见各成分之间分离完全,无干扰。各氨基酸成分的线性回归方程见Tab 1。结果表明,与假手术组比较,模型组大鼠海马和下丘脑两个脑区兴奋性氨基酸Glu水平均明显升高,同时抑制性氨基酸Gly和GABA均明显降低(P<0.01),提示兴奋性毒的发生。与模型组比较,川芎可明显升高这两个脑区的GABA水平(P<0.05,P<0.01),但对Gly和Glu未见明显影响。而冰片仅降低这两个脑区组织的Glu,对GABA和Gly无明显改善。当它们配伍应用后,除了可改善海马和下丘脑的Glu和GABA含量,还可进一步升高下丘脑Gly含量(P<0.05,P<0.01),显示较好的协同效应(Tab 2)。
Fig 1 Representative total ion chromatogram of Glu, Gly and GABA in hippocampus(A) and hypothalamus(B) by GC-MS

Tab 1 Linear equation and range of Gly, GABA and Glu
2.2 川芎和冰片配伍对GCIR大鼠海马和下丘脑区域神经元内钙离子浓度的影响如Fig 2所示,与假手术组比较,GCIR处理后可见大鼠海马和下丘脑脑片细胞中钙离子浓度明显升高(P<0.01),提示钙超载已发生。与模型组比较,川芎和冰片单一用药治疗均可明显降低两个脑区神经细胞内钙离子浓度(P<0.05),而它们联合治疗效果更佳(P<0.01),进一步体现了它们配伍应用的优势。
2.3 川芎和冰片配伍对GCIR大鼠海马和下丘脑神经元凋亡率的影响如Fig 3所示,凋亡阳性细胞可见细胞核的棕黄色染色。GCIR处理后可见大量的凋亡神经细胞在大鼠海马和下丘脑组织出现(P<0.01)。川芎单一用药治疗或联合冰片治疗可明显降低两个脑区的神经元凋亡指数(P<0.01),但单一冰片治疗却未见明显改善(P>0.05)。
2.4 川芎和冰片配伍对GCIR大鼠海马和下丘脑区域神经元超微结构的影响Fig 4的透射电镜结果显示,假手术组大鼠海马和下丘脑区的神经细胞的细胞膜和核膜完整,线粒体无肿胀,内嵴结构可见,内质网完整光滑。模型组大鼠已出现线粒体肿胀,内嵴结构消失,甚至空泡化,胞质内其他细胞器溶解消失,核膜和胞膜的连续性被破坏,核膜溶解。给予川芎和冰片治疗后,可见以上结构有所改善,细胞器溶解减少,尤其是线粒体结构空泡化减少,两者的合用改善效果更加明显。
3 讨论
自1969年Olney提出兴奋毒性概念以来,至今一系列研究已证明,兴奋性氨基酸(excitative amino acid,EAA)作为后继级联反应的触发事件,在脑缺血/再灌注引起的神经元死亡中起到重要的作用。大脑的EAA以谷氨酸为代表,含量也最高,占游离氨基酸的40%,其与脑缺血的关系也最为明确。抑制性氨基酸以GABA和Gly为代表。这两种神经氨基酸的比例在调节神经元兴奋/抑制平衡中具有重要作用。缺血性脑损伤首先引起脑组织能量耗竭,导致Na+-K+-ATP酶活性降低,引起胞内Na+浓度增加,后者除了可引起神经细胞水肿外,还可抑制Glu的再摄取,导致胞外Glu浓度大幅增加,然后通过激活NMDA受体门控Ca2+通道,增加胞内Ca2+浓度,后者又进一步激动内质网Ryanodine受体2,促进胞内Ca2+释放,导致细胞内游离Ca2+超载。而Ca2+超载除了引发基于NO、磷脂酶C、磷脂酶A2、氧自由基等途径的神经元损伤外,还可通过上调p53基因及其下游基因Bax,下调Bcl-2基因和激活caspase-3通路,触发凋亡通路,最终造成神经元的进一步损伤。
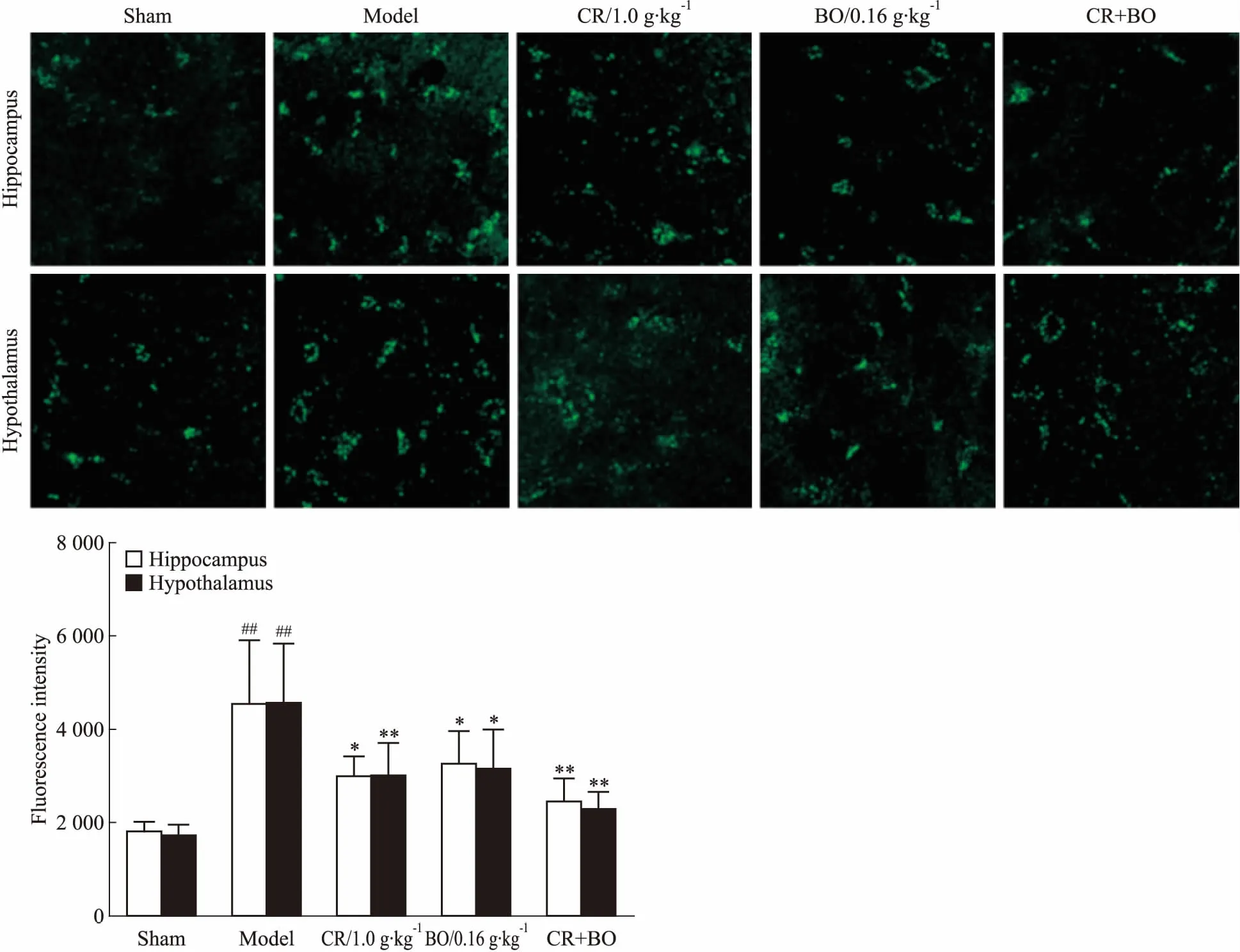
Fig 2 Synergic effect of CR and BO on improving intracellular[Ca2+]i in hippocampus and hypothalamus of GCIR vs sham;*P<0.05,**P<0.01 vs model
##P<0.01vssham;*P<0.05,**P<0.01vsmodel
传统医学认为,脑缺血属于脑卒中的范畴,瘀血闭阻脑脉是其基本病机,活血、化瘀、开窍、醒神作为第一治则。川芎及其活性成分川芎嗪对缺血性脑损伤的保护作用已被大家所普遍认可,并在临床广泛应用。近年研究发现这一保护作用与它们抑制NF-κB,激活IκB,减少神经元氧化损伤及凋亡密切相关[8]。我们前期研究发现,冰片的“引药上行”功效与促进血脑屏障生理性开放,促进药物入脑有关[9-11]。但大量研究证实,冰片自身作为“醒脑开窍”药对脑缺血/再灌注机体也具有改善行为学异常,减少脑梗死面积,增强学习记忆能力的效应,其机制可能与抑制脑内诱导型一氧化氮合酶、环氧酶和脂氧酶活性,减少NF-κB表达,抑制TNF-α、IL-1等炎症介质形成有关[12-13]。黄萍等[14]发现,冰片与川芎配伍后,对脑缺血动物具有保护血管内皮细胞功能、基膜的完整性,改善微循环,减轻脑水肿程度的作用,并且作用明显优于单用川芎或冰片,其作用机制可能与减少缺血脑组织中NO的生成,减轻NO介导的神经毒性作用,提高自由基清除酶的活性,抑制脂质过氧化反应有关。我们在前期研究中,针对皮层、海马、纹状体和下丘脑4个脑区分别进行了川芎、冰片的配伍研究,发现川芎与不同剂量的冰片配伍,在脑循环、组织学评分、炎症因子、氧化应激等指标的改善中具有明显的脑区特异性,并发现当冰片剂量为0.16 g·kg-1时,对海马和下丘脑改善作用最为明显[15]。

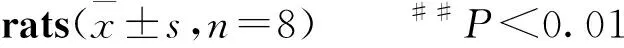

Fig 4 Synergic effect of CR and BO on ultrastructures in hippocampus and hypothalamus of GCIR rats(×10 000)
本实验观察川芎和冰片配伍对GCIR大鼠海马和下丘脑的保护作用,发现川芎仅升高这两个脑区的GABA,冰片仅降低这两个脑区组织的Glu。而配伍应用还可进一步升高下丘脑Gly含量,表现较好的协同关系。川芎和冰片单用均可降低两个脑区神经细胞内钙离子浓度,缓解超微结构的损伤性改变,而它们的联合治疗作用更加明显。这些结果提示,川芎和冰片配伍可在缓解神经元毒性、钙超载和超微结构异常方面表现较好的协同效应。但在抗凋亡方面,川芎单用即可减少这两个脑区的神经元凋亡指数,与冰片配伍未见改善作用的进一步增强。

