电离辐照损伤对小鼠脾脏组织核糖体信号通路的影响
何 清,李 敏,唐文诚,易辉燕,王 蕾,王继生,
[1. 西南医科大学药学院,四川 泸州 646000;2. 绵阳市第三人民医院(四川省精神卫生中心),四川 绵阳 621000]
随着科学技术和社会的发展,电离辐射损伤受到人们的广泛关注,如工业辐射、医疗辐射、人工辐射以及天然来源的辐射,包括太阳、宇宙射线、地壳中存在的放射性核素等[1]。电离辐射主要是一种由高速带电的粒子(α、β、质子)和不带电的粒子(X射线、γ射线、中子)产生[2]。电离辐射可引起放射性疾病,其中以消化系统、免疫系统、神经系统和造血器官的反应最为明显[3]。电离辐射损伤的主要靶点是DNA。辐射可使自由基电产生增加、重要功能基团破坏、蛋白质和膜的脂质结构功能发生变化,辐射可激活细胞的凋亡程序导致细胞凋亡[4]。此外,过量的辐射还会造成基因突变、致癌、致畸等[5]。
脾脏是机体免疫系统中最大的免疫器官,具有大量的B淋巴细胞和巨噬细胞,脾脏可产生免疫球蛋白和补体蛋白等免疫物质,从而发挥免疫功能[6]。脾脏对电离辐射敏感,是辐射损伤最常见的器官之一。电离辐照可致免疫系统的细胞、组织、器官受损。2 Gy X射线全身照射小鼠后,可诱导小鼠脾脏出现典型的淋巴细胞凋亡,使脾脏白髓及红髓的细胞凋亡均增加[7]。电离辐照破坏DNA双链,间接产生活性氧,使小鼠B淋巴细胞凋亡,可能是导致脾脏组织受损的重要原因[8]。因此,研究电离辐射对小鼠脾脏组织损伤具有重要意义。比较蛋白质组学是蛋白质组学中的重要研究策略,通过对整体蛋白质表达变化的分析,从而发现蛋白质组间的差异蛋白[9]。ITRAQ联合LC-MS/MS技术可对多达8种样品进行定量研究,可同时分离和筛选成百上千的差异蛋白,最大化的获得蛋白质的生物学功能[10]。
1 材料
1.1 实验动物清洁级昆明种♂小鼠20只,体质量(20±2)g,购自第三军医大学实验动物中心,动物生产许可证号为:SCXK(军)2012-0011。实验室环境为温度(22~26) ℃,湿度44%~65%,光照与黑暗交替出现,光照12 h,黑暗12 h。所有小鼠均给予正常的饮食、饮水饲养,以适应环境1周。该实验已通过绵阳市第三人民医院伦理委员会审核通过,均遵守实验动物管理规范照料和使用原则。
1.2 试剂与仪器ITRAQ标记试剂盒(美国ABSCIEX公司);BCA试剂盒(碧云天公司);蛋白裂解液(美国Bio-Rad公司)。LC-6AD型高效液相色谱仪(日本岛津);TRIPLE TOF5600质谱仪配套软件(美国ABSCIEX公司);WFZUV-2100型可见紫外分光光度计(尤尼柯);RVT4104型低温冷冻干燥器(美国Thermo Fisher)。
2 方法
2.1 动物分组将实验小鼠按照随机分组的原则分为正常组和辐射组,每组10只。电离辐照之前,所有小鼠均给予正常的饮食、饮水。
2.2 电离辐照损伤小鼠模型辐射组小鼠常规环境下饲养1周后,将小鼠放置于自制的纸盒内,给予5 Gy60Co γ射线全身辐照小鼠1次,辐照率为1.73 Gy·min-1[11]。辐照完成后,继续给予正常组和辐射组小鼠正常的饮食、饮水。
2.3 组织取材辐照完成7 d后,用3.5%的水合氯醛麻醉小鼠,在无菌隔离环境下解剖小鼠,取出脾脏组织,用0.9%的灭菌生理盐水反复灌注清洗脾脏组织后,迅速置于液氮中速冻,-80 ℃冰箱保存。
2.4 脾脏组织蛋白质的提取将1 μL蛋白酶抑制剂、5 μL磷酸酶抑制剂和10 μL PMSF加入裂解缓冲液中混合均匀,分装于2支玻璃匀浆器中并置于冰上预冷。将冻存的小鼠脾脏组织从液氮中取出,每组3只,PBS清洗后,按组别放入玻璃匀浆器中,加适量液氮研磨,再加入预冷的裂解缓冲液,手动充分研磨脾脏组织至均质匀浆。冰上超声破碎脾脏组织,功率80 W,超声0.8 s,关闭0.8 s,共计3 min。加入5倍体积预冷的丙酮溶液混匀后,静置于-20 ℃环境中沉淀4 h,再4 ℃、8 000 r·min-1离心5 min,弃上清,取沉淀,反复操作,直至沉淀变为白色,-80 ℃冻存。
2.5 ITRAQ标记① 蛋白质的溶解、定量:取冻存的2组样品各20 μL,并稀释至可检测的浓度范围。采用Bradford法测定蛋白质含量,调整蛋白质的浓度。② 蛋白还原烷基化及酶切:利用二硫苏糖打开二硫键及碘代乙酰胺烷基化二硫键使蛋白质充分变性。③ 蛋白标记:平衡ITRAQ试剂至室温后,离心至管底,并加入150 μL异丙醇溶解。取上述酶解产物50 μL至新的离心管中,加入处理好的ITRAQ试剂,室温反应2 h,后加入水,让有机相降低至50%以下以终止反应,混合后、旋涡振荡、离心后真空冷冻干燥,将两组蛋白各进行标记,将正常组标记为113,辐射组标记为119。④ SCX分级:将上述标记好的多肽混合物用流动相A(150 μL)经复溶、旋涡振荡处理后,12 000 r·min-1离心20 min,吸取上清液上样,流速0.8 mL·min-1,按不同的参数梯度洗脱,据峰形和时间共收集到50个梯度,冷冻抽干后保存待用。
2.6 质谱鉴定各组蛋白质样品用Q-TOF(质谱TOF;MS参数m/z:350~1 500;time:0.25 s)进行iTRAQ标记样品的质谱信息检测,获得ITRAQ标记肽段的序列,再根据肽指纹图谱鉴定出相应的蛋白质。两ITRAQ离子的峰面积比值可以反映样品中多肽和蛋白质的相对含量。
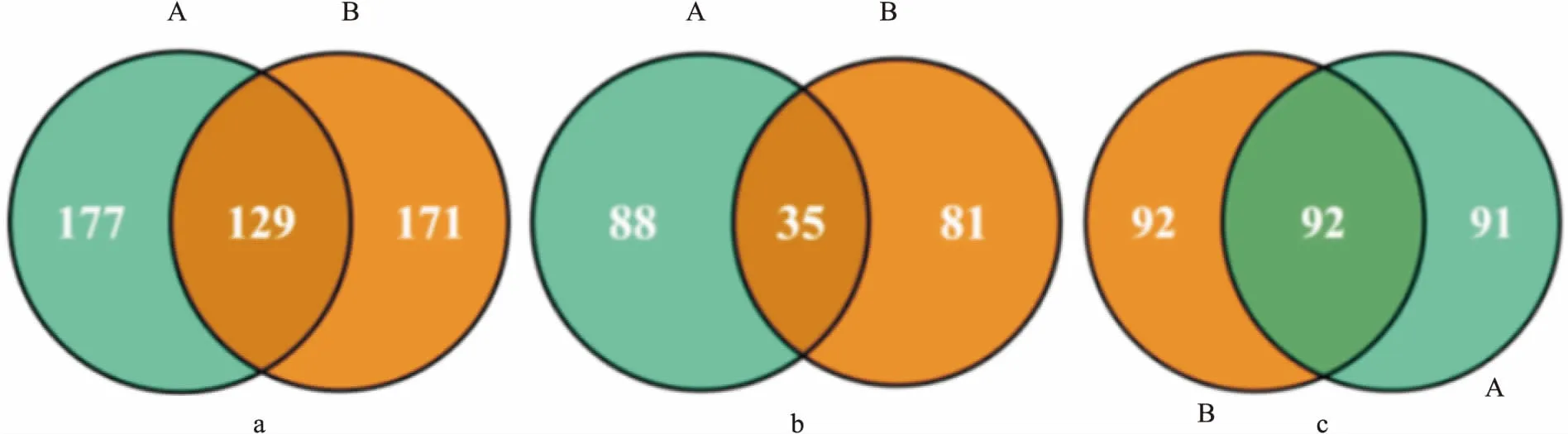
Fig 1 Differential protein Venn diagram between normal group and ionizing radiation group
A represents proteins identified in the first assay; B represents proteins identified in the second assay. a: Differential proteins between normal group and ionizing radiation group; b: 35 up-regulated differential expressed proteins in the ionizing radiation group compared with the normal group; c: 92 down-regulated differential expressed proteins in the ionizing radiation group compared with the normal group.
2.7 生物信息学鉴定① 采用Perseus1.5.5.3的Significance A方法进行差异蛋白筛选,以P<0.05且FC>1.5或FC<0.667进行差异蛋白筛选。对筛选到共同上调和共同下调的差异蛋白,作为最终候选的差异蛋白并进行功能分析。② 利用uniprot数据库分析差异蛋白的分子功能及生物学过程,利用分析软件DAVID 6.8对差异蛋白进行生物过程、分子功能注释和细胞成分分析。③ 利用KEGG Pathway数据库对差异蛋白所涉及的通路进行注释,寻找差异蛋白中显著性富集的通路(P<0.05),确定差异蛋白参与最主要的生物学途径和通路。
3 结果
3.1 蛋白质鉴定结果经重庆医科大学生命科学院ITRAQ技术平台进行蛋白质组学测定,2次技术重复所鉴定到的差异蛋白质维恩分析结果见Fig 1。本实验在正常组与辐射组中共鉴定到129个差异蛋白,与正常组比较,辐射组有35个蛋白质表达上调,92个蛋白质表达下调。差异蛋白的网络分析图见Fig 2。其中,红色代表上调的差异蛋白,绿色代表下调的差异蛋白,线越粗代表两蛋白质之间的相互作用越强。
3.2 生物学功能分析通过DAVID富集分析系统对实验获得的129个差异蛋白进行GO富集分析,研究这些差异蛋白的功能,结果见Fig 3。BP分析发现,这些差异蛋白大多参与翻译、细胞质翻译、核小体组装、核小体定位和肌动蛋白丝覆盖。MF分析得出这些差异蛋白主要与核糖体的结构组成、RNA结合、染色质DNA结合、rRNA大核糖体亚基结合有关。CC分析揭示,这些差异蛋白分布在细胞核、核糖体、细胞内核糖体蛋白复合体、细胞质大核糖体亚基、细胞质小核糖体亚基、核糖体亚基上。
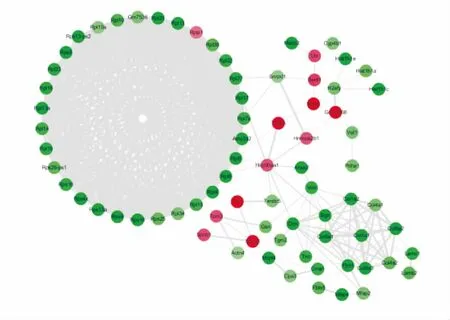
Fig 2 Network analysis of differentially expressedproteins in spleen tissues of mice in normalgroup and ionizing radiation group
3.3 KEGG通路注释结果将正常组与电离辐射组小鼠的脾脏组织鉴定到的差异蛋白,运用DAVID 6.8分析软件进行KGEE Pathway富集分析,发现有57个差异蛋白,参与了17条生物信号通路(P<0.05),其中有50个差异蛋白表达上调,7个差异蛋白表达下调。差异蛋白富集最明显的10条通路见Fig 4。从图中发现,差异蛋白主要富集在核糖体、细胞外基质受体的相互作用、蛋白质消化与吸收、黏着斑、PI3K-Akt信号通路、阿米巴病、小细胞肺癌、系统性红斑狼疮、癌症途径、抗原处理和呈现的信号通路中。
本实验发现,富集在核糖体信号通路中的差异蛋白质有37个,信号通路图见Fig 5。有36个差异蛋白质表达下调,分别是60S核糖体蛋白L34(Rpl34)、60S核糖体蛋白L27(Rpl27)、60S核糖体蛋白L21(Rpl21)、60S核糖体蛋白L14(Rpl14)、60S核糖体蛋白L23(Rpl23)、60S核糖体蛋白L6(Rpl6)、60S核糖体蛋白L10(Rpl10)、60S核糖体蛋白L13(Rpl13)、60S核糖体蛋白L7(Rpl7)、60S核糖体蛋白L27a(Rpl27a)、60S核糖体蛋白L8(Rpl8)、60S核糖体蛋白L31(Rpl31)、40S核糖体蛋白S8(Rps8)、40S核糖体蛋白S9(Rps9)、40S核糖体蛋白S4(Rps4x)、40S核糖体蛋白S26(Rps26)、40S核糖体蛋白S3a(Rps3a1)、核糖体蛋白L4(Rpl4)、核糖体蛋白S15A(Rps15a)、核糖体蛋白L15(Rpl15)、核糖体蛋白L19(Rpl19)、核糖体蛋白L28(Rpl28)、核糖体蛋白(Rpl10a)、核糖体蛋白16(Rps16)、MCG10725, 异构体CRA a(Rps25)、MCG13615, 异构体CRA a(Rpl3)、MCG23000, 异构体CRA b(Rps18)、MCG23455, 异构体CRA e(Rpl13a)、MCG132477, 异构体 CRA a(Rpl18)、无特征性蛋白(Rps2)、无特征性蛋白(Rpl3)、无特征性蛋白(Rps23)、蛋白MCG12304(Rpl22)、蛋白MCG10205(Rps13)、Rpl17蛋白(Rpl17)、Rpl7a蛋白(Rpl7a),有1个差异蛋白的表达上调,是MCG10168蛋白(Rplp1)。进一步利用String10.5和Cytoscape 3.6.1制作差异蛋白相互作用网络图,见Fig 6,发现这些差异蛋白之间是相互联系的,且相互作用关系复杂。
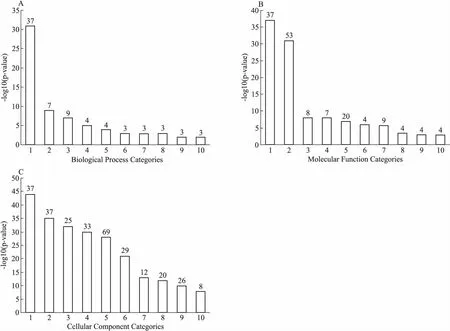
Fig3GOfunctionenrichmentanalysisofdifferentiallyexpressedproteinsinspleentissuesofmiceinnormalgroupandionizingradiationgroup
A: Biological process categories. 1: translation; 2: cytoplasmic translation; 3: nucleosome assembly; 4: porphyrin-containing compound biosynthetic process; 5: protein heterotrimerization; 6: collagen-activated tyrosine kinase receptor signaling pathway; 7: histone H3-K27 trimethylation; 8: nucleosome positioning; 9: histone H3-K4 trimethylation; 10: action filament capping. B: Molecular function categories. 1: structural constituent of ribosome; 2: poly(A) RNA binding; 3: chromatin DNA binding; 4: extracellular matrix structural constituent; 5: RNA binding; 6: 5.8SrRNA binding; 7: mRNA binding; 8: 5SrRNA binding; 9: platelet-derived growth factor binding; 10: large ribosomal subunit rRNA binding. C: Cellular component categories. 1: ribosome; 2: intracellular ribonucleoprotein complex; 3: cytosolic large ribosomal subunit; 4: extracellular matrix; 5: extracellular exosome; 6: focal adhesion; 7: cytosolic small ribosomal subunit; 8: proteinaceous extracellular matrix; 9: nucleolus; 10: small ribosomal subunit.
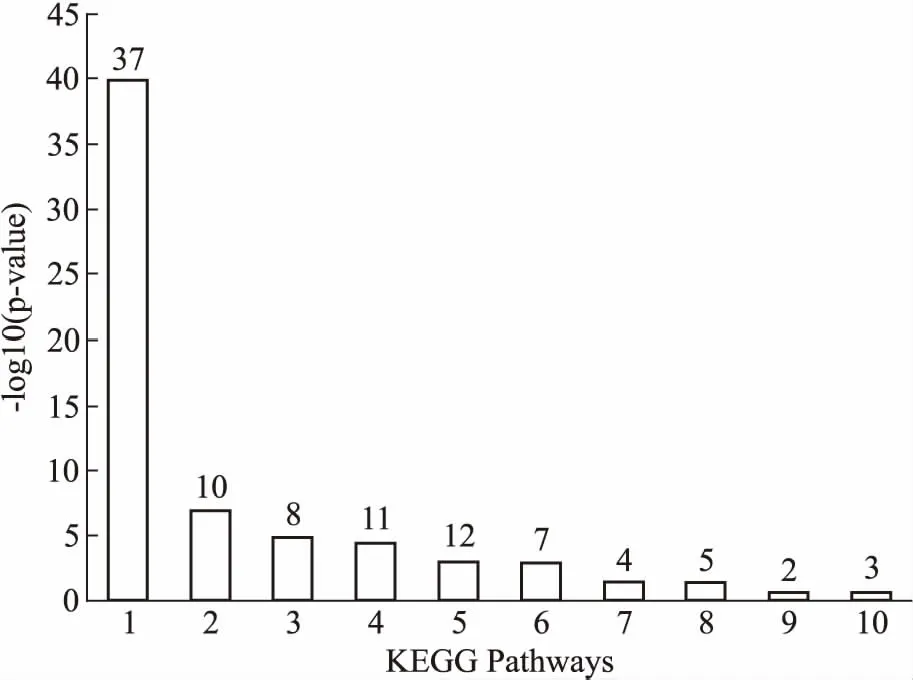
Fig 4 Distribution of top ten sites in enriched KEGGsignaling pathway of differential expressed proteins in spleentissues of mice in normal group and ionizing radiation group
1: ribosome; 2: EMC-receptor interaction; 3: protein digestion and absorption; 4: focal adhesion; 5: PI3K-Akt signaling pathway; 6: amoebiasis; 7: small cell lung cancer; 8: systemic lupus erythematosus; 9: proximal tubule bicarbonate reclamation; 10: antigen processing and presentation.
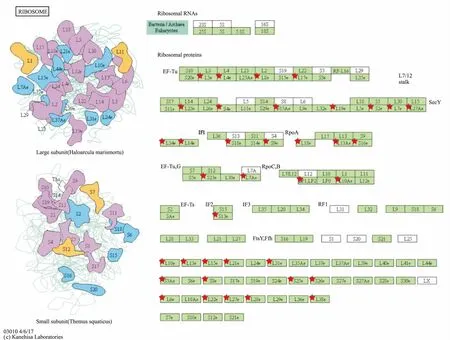
Fig 5 Enrichment of differentially expressed proteins in spleen tissues of micein ribosome signaling pathway in normal group and ionizing radiation group
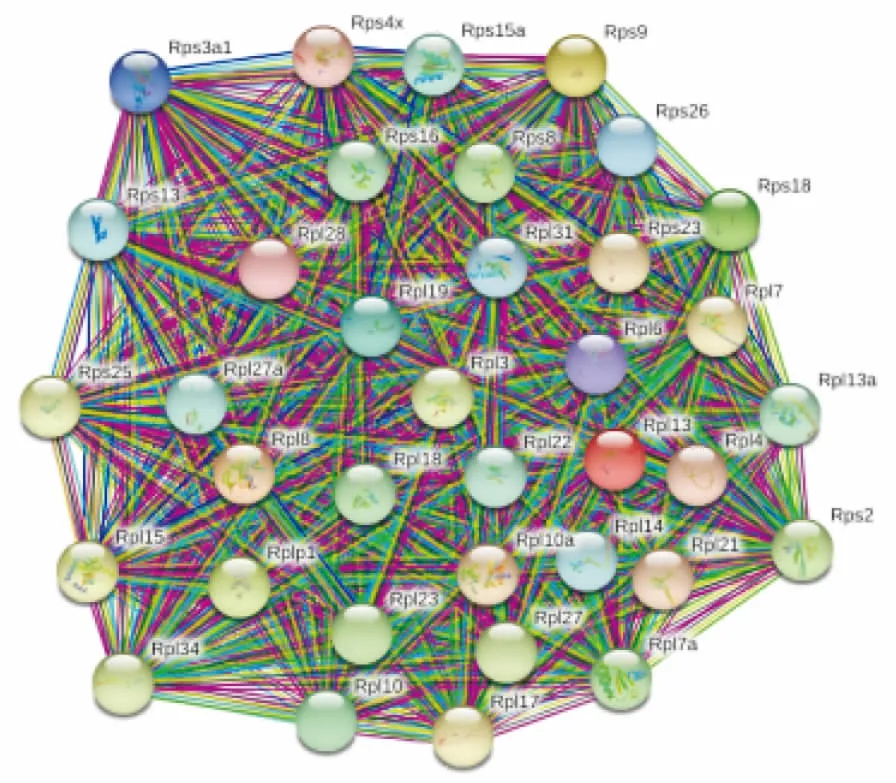
Fig 6 Diagrams of 37 differential protein interactionnetwork in ribosome signaling pathway betweennormal group and ionizing radiation group
4 讨论
蛋白质是生命活动的承担者,是构成生物体细胞和组织的重要物质,生物体的一切生命活动都离不开蛋白质的参与。蛋白质的生物合成受外界环境因素的影响,如温度、pH、离子强度、超声波、紫外线、X射线、辐射等。已有研究表明,电离辐射可导致小鼠的造血细胞、免疫细胞、生殖细胞凋亡,其机制与细胞周期异常、基因表达异常、蛋白质的合成异常有关[12],此外,电离辐射可致机体分子水平发生变化,如损伤DNA分子(碱基发生变化及DNA双链发生断裂)、蛋白质的结构发生破坏、酶的分解代谢速度加快等;细胞水平上可致细胞发生凋亡、染色体发生突变等[13],这对目前研究电离辐射对机体的损伤作用机制具有重要的意义。
核糖体是蛋白质合成的重要场所,是机体细胞中重要的细胞器。核糖体的主要成分是蛋白质和RNA。真核生物的核糖体由60S大亚基和40S小亚基共同构成,其中,60S大亚基约有49种蛋白质和3种rRNA(28S rRNA、5.8S rRNA、5S rRNA),40S小亚基约有33种蛋白质和1种rRNA(18S rRNA)。在蛋白质翻译前,40S核糖体小亚基与mRNA结合后,再与60S核糖体大亚基结合,共同构成完整的核糖体,从而发挥核糖体的正常功能。蛋白质生物合成这一过程主要由核糖体蛋白、酶、蛋白质因子、tRNA和mRNA等的共同参与。
核糖体蛋白(ribosomal protein,RP)是核糖体最主要的成分,广泛分布于各种组织中,在核糖体的翻译过程中发挥着重要的作用。它促使核糖体RNA的折叠,从而执行蛋白质的翻译功能,在蛋白质的合成中发挥重要作用。除此之外,核糖体蛋白还具有调控基因转录、参与核糖体的结构组成、调控mRNA翻译、影响细胞分化、增殖和凋亡等作用[14]。本实验研究发现,核糖体信号通路中所涉及的差异蛋白,有7个差异蛋白都属于核糖体蛋白类,分别是Rpl4、Rps15a、Rpl15、Rpl19、Rpl28、Rpl10a、Rps16,这些差异蛋白共同参与了核糖体的结构组成,在蛋白质的翻译过程中发挥着重要的作用,其中,Rps15a还参与了细胞周期的正向调控,Rpl10a与细胞质的翻译有关,Rpl19、Rpl10a还与mRNA结合有关。在电离辐照小鼠脾脏组织中,这些差异蛋白质表达下调,将影响脾脏组织蛋白质的生物合成,从而影响脾脏的正常生理功能。
此外,核糖体信号通路所涉及的差异蛋白中,有12个蛋白属于60S核糖体大亚基蛋白,分别是Rpl34、Rpl27、Rpl21、Rpl14、Rpl23、Rpl6、Rpl10、Rpl13、Rpl7、Rpl27a、Rpl8、Rpl31。其中,Rpl34、Rpl27、Rpl10、Rpl13、Rpl27a、Rpl31参与了核糖体的结构组成和蛋白质的翻译过程,Rpl27参与蛋白的翻译及rRNA的翻译过程,Rpl8参与细胞对神经生长因子刺激反应、细胞质翻译过程,Rpl14参与RNA加工和结合、核糖体大亚基的生物形成,Rpl23参与细胞周期阻滞的负调控、RNA聚合酶Ⅱ对转录的负调控、细胞增殖的正向调控、基因表达的正向调控、p53类介质对信号转导的正向调控、参与核糖体的结构组成,这些差异蛋白表达下调,蛋白质在核糖体上的翻译受阻,从而影响脾脏细胞的正常生理功能。
在核糖体信号通路有5个差异蛋白属于40S核糖体小亚基蛋白,分别是Rps8、Rps9、Rps4x、Rps4x、Rps3a1,这些差异蛋白都参与了核糖体的结构组成及蛋白质的翻译过程。其中,Rps9参与细胞周期的正向调控、细胞质翻译的正向调控,Rps3a1还与细胞的分化有关,它们表达下调影响核糖体的正常功能,影响细胞周期的正常调控。
在核糖体信号通路中,Rps25、Rpl3、Rps18、Rpl18、Rpl13a、Rpl18、Rps2、Rps23、Rpl22、Rps13、Rpl17、Rpl7a差异蛋白表达下调,其中Rps18、Rpl13a、Rpl18、Rps2、Rps23、Rpl3、Rpl17、Rpl7a参与了核糖体的结构组成及翻译过程,在电离辐射中这些差异蛋白表达下调,影响核糖体的正常功能及蛋白质的翻译过程;Rps25、Rpl3、Rpl22、Rps13、Rplp1在核糖体信号通路中的功能尚不明确,这些差异蛋白会不会影响核糖体的正常功能及蛋白质的生物合成,影响小鼠脾脏组织细胞的正常生理功能,值得我们进一步研究。
本实验发现,在电离辐照小鼠脾脏组织核糖体信号通路中,核糖体蛋白、60S核糖体大亚基蛋白以及40S核糖体小亚基蛋白及其它蛋白在电离辐照后的小鼠脾脏组织中出现低表达,影响了核糖体的正常生理功能,从而影响蛋白质的生物合成。表明电离辐照可能导致核糖体的功能异常,使蛋白质的合成受阻,继而影响脾脏细胞的正常生理功能。本实验研究表明,核糖体对机体蛋白质的合成至关重要,通过对核糖体信号通路的研究,将有助于我们深入了解电离辐照后小鼠脾脏组织蛋白质合成障碍的机制,为电离辐照损伤寻找新靶点提供参考依据。
(致谢:感谢中国工程物理研究院核物理与化学研究所对动物造模提供帮助,感谢绵阳市第三人民医院病理科的宋大萍老师给予病理技术支持与指导,感谢徐敬文、王小红、吴思霖在动物实验中给予支持与帮助。)

