CEA、CA153、CA199与乳腺癌病理分型的相关性
张 伟,徐春玲,张 蕾,4*
(石河子大学医学院第一附属医院1.普外二科;2.检验科,新疆 石河子 832008;第五师医院3.骨科;4.急诊科,新疆 石河子 832008)
乳腺癌是女性常见的恶性肿瘤[1],患者临床特征不明显,疾病隐匿性强,发现时往往延误最佳治疗时间,乳腺癌具有易扩散的特点,早期诊断,及时手术,为患者争取治疗时间尤为重要,是提高乳腺癌患者生存率的关键[2]。血清肿瘤标志物的水平可以在乳腺癌早期诊断中起到至关重要的作用。本文对乳腺癌患者血清肿瘤标志物水平和病理分型的相关性进行分析,为诊断乳腺癌提供理论依据,现报道如下。
1 资料与方法
1.1 一般资料
选取2017年1月~2018年12月新疆石河子大学医学院第一附属医院住院病理诊断为乳腺癌的患者200例作为乳腺癌组,其中,年龄38~71岁,平均(57.39±13.24)岁,浸润性粘液癌(IMC)8例,浸润性小叶癌(IIC)10例,导管内原位癌(DCIS)59例,浸润性导管癌(IDC)123例,患者未进行任何抗肿瘤治疗。另选取同期健康体检者200例作为对照组,其中,年龄35~73岁,平均(55.21±12.75)岁。
1.2 方法
1.2.1 标本采集及检测
两组人群空腹静脉采血3 mL,2500 r/min离心分离血清,采用罗氏E170电化学发光免疫分析仪检测CEA、CA153、CA199,操作严格按试剂盒说明书进行。
1.2.2 检测指标及结果判断
参考范围:CEA:<5.6 IU/mL,CA15-3:<25 U/mL,CA19-9:<27 U/mL。
1.3 统计学方法
采用SPSS 17.0统计学软件对数据进行处理,计量资料以“±s”表示,采用t检验;计数资料以例数(n)、百分数(%)表示,采用x2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组CEA、CA153、CA199、检测平均值比较
乳腺癌组CEA、CA153、CA199含量高于对照组,两组比较,差异有统计学意义(P<0.05)。见表1。
表1 两组CEA、CA153、CA199检测平均值比较(±s)

表1 两组CEA、CA153、CA199检测平均值比较(±s)
组别 CEA CA15-3 CA19-9乳腺癌组 33.52±9.06 109.43±17.92 39.17±6.85对照组 1.92±3.21 8.16±5.37 3.29±1.08
2.2 不同类型乳腺癌CEA、CA153、CA199分布情况
CEA水平在IMC中最高,CA153在IIC中最高,CA199在IMC、IIC中最高。见表2。
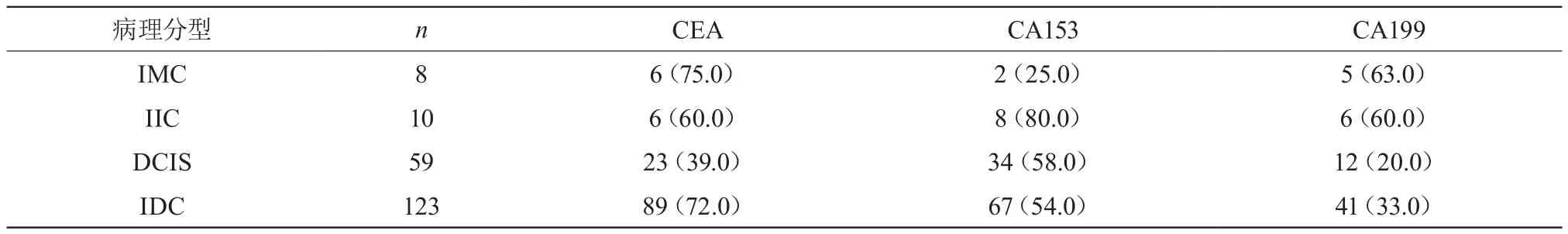
表2 不同类型乳腺癌CEA、CA153、CA199分布情况例[n(%)]
3 讨 论
乳腺癌诊断常用钼靶、乳腺彩色多普勒、核磁共振、病理学诊断等技术,随着分子生物学的逐渐开展,已有多项研究表明,乳腺癌患者的病理分型能对肿瘤的生物学行为进行精确的反映,并且乳腺癌患者基因表型的不同有可能对化疗药物的敏感性造成很大影响[3-4]。血清肿瘤标志物水平检测已逐渐成为传统检测技术之后临床最常用的诊断指标。血清肿瘤标志物临床应用中,根据患者病情可以单个肿瘤标志物进行检测,也可以多个检测指标联合检测,在乳腺癌早期诊断、复发、转移中具有重要应用价值。
CEA是非特异性肿瘤标志物,可以用于乳腺癌、胰腺癌等多种疾病的辅助性诊断。本次研究表明,CEA、CA153、CA199含量高于对照组,两组对照有显著性差异,P<0.05差异有统计学意义。本次研究发现,CEA水平在IMC中阳性率最高,IIC中也较高。CA153为临床最为认可的诊断乳腺癌较为特异的一种肿瘤标志物[5]。CA153在临床应用中作为监测浸润性或转移性乳腺癌标志物。CA15-3对乳腺癌早期诊断的灵敏性和特异性效果欠佳,部分乳腺癌患者表达结果为阴性。本次研究发现,CA153在IIC中阳性率最高,在IMC中最低。CA19-9在1989年发现,是类粘蛋白的糖蛋白成分,在胰腺癌、乳腺癌、肝癌等多种恶性肿瘤均可出现异常增高。本次研究发现,CA199在IMC、IIC中阳性率最高。
研究表明,CEA、CA153、CA199在同病理分型的乳腺癌中表达不同,为临床依据血清学初步诊断乳腺癌提供理论依据。

