核壳型量子点-纳米金颗粒组装体高效检测神经性毒剂模拟剂
李盛菘, 郑永超,2, 孟澍临, 吴骊珠, 钟近艺,2, 赵冲林,2
核壳型量子点-纳米金颗粒组装体高效检测神经性毒剂模拟剂
李盛菘1, 郑永超1,2, 孟澍临3, 吴骊珠3, 钟近艺1,2, 赵冲林1,2
(1. 中国人民解放军军事科学院 防化研究院, 北京 102205; 2. 国民核生化防护国家重点实验室, 北京 102205;3. 中国科学院 理化技术研究所, 北京 100190)
实验设计制备了一种由12层硫化锌包覆硒化镉的核壳型量子点(CdSe/12ZnS QDs)和纳米金颗粒(Au NPs)自组装形成的CdSe/12ZnS QDs/Au NPs复合结构, 并将其应用于神经性毒剂模拟剂氰基磷酸二乙酯(Diethyl Cyanophosphonate, DCNP)的高效检测。QDs由于与Au NPs存在荧光共振能量转移作用(Fluorescence Resonance Energy Transfer, FRET)而发生荧光猝灭, 乙酰胆碱酯酶(AChE)水解氯化硫代乙酰胆碱(ATC)生成的硫胆碱能够将量子点取代而使量子点荧光恢复。当QDs与Au NPs的摩尔浓度比为20 : 1时, QDs荧光猝灭效果最佳, AChE浓度为1.0×10–3U/L时, QDs荧光恢复效果最好。DCNP的存在会抑制AChE的活性, 减少硫胆碱的生成并降低QDs的荧光恢复效率, 通过对QDs荧光恢复效率测定能够检测DCNP。在最优条件下对DCNP的检测结果表明, 量子点的荧光恢复效率与DCNP浓度的对数在5.0×10–9~5.0×10–4mol/L的范围内存在良好的线性关系, 检出限达5.0×10–9mol/L。
量子点; 纳米金颗粒; 神经性毒剂模拟剂; 荧光共振能量转移
神经性毒剂是一类高毒性有机磷酸酯, 主要包括塔崩(GA)、沙林(GB)、梭曼(GD)和VX[1]。这类毒剂能够通过呼吸或皮肤接触进入人体, 抑制乙酰胆碱酯酶的活性, 从而造成神经系统的严重损害[2]。在防化和反恐领域, 研究重点是对神经性毒剂建立高效、简单、快捷的检测方法。利用神经性毒剂对乙酰胆碱酯酶(AChE)的抑制作用, 对其进行光学检测的方法由于具有灵敏度高、环境友好和操作简单等特点而受到广泛关注[3-5]。其中, 纳米金颗粒(Au NPs)能够与其配体通过相互作用形成复合结构, 使其表面电荷相互排斥并均匀分散, 而AChE水解硫代乙酰胆碱(ATC)产生的带正电硫胆碱能够取代配体, 使Au NPs表面电位由负变为中性并导致其团聚, 表面等离子吸收红移, 颜色由酒红色变为黑色[3]。神经性毒剂能够抑制AChE活性, 进而阻碍配体被取代。通过观察体系颜色及光谱测定, 可对神经性毒剂或模拟剂进行检测。该方法具有响应速度快、裸眼可见和操作简单等优点。
近年来, 半导体量子点(QDs)因具有生物相容性好[6]、合成简单[7]以及优异的光谱性质[8]等特点而备受关注。通过尺寸调控实现QDs的发射与Au NPs的吸收重叠, 发生荧光共振能量转移作用(Fluorescence Resonance Energy Transfer, FRET), 从而导致QDs的荧光猝灭。AChE水解ATC产生的硫胆碱能够抑制QDs与Au NPs的FRET作用, 促使荧光恢复。加入AChE抑制剂能够减缓硫胆碱的生成, 最终降低荧光恢复效率。基于上述原理, 利用QDs/Au NPs复合物检测有机磷农药等AChE抑制剂的研究被相继报道[9-11]。相比于有机磷农药, 化学毒剂毒性更强, 需要更高的检测灵敏度。因此, Au NPs/QDs 复合物结构的优化尤为重要。已报道的体系大多基于单核量子点, 化学稳定性和发光量子效率较低。另外, Au NPs与QDs主要通过静电作用相结合, 硫胆碱本身所带的正电荷会干扰两者的结合, 降低体系的荧光稳定性, 从而影响检测效果[11]。
相比于单核量子点, 核壳量子点能够将光生载流子限域在核内, 从而提高QDs的发光效率和稳定性[12]。此外, 相比于静电相互作用, 配体介导的纳米颗粒组装体能够增强QDs与Au NPs相互作用, 进一步提高FRET效率[13]。基于上述考虑, 实验设计合成了不同硫化锌壳层数(0~18层)的核壳型量子点(CdSe/nZnS)[14], 与AuNPs组装后, 使用巯基乙胺作为模拟物对量子点的荧光恢复效果进行了研究,最终选择荧光恢复效率最高的12层硫化锌包覆硒化镉的核壳量子点(CdSe/12ZnS QDs)与Au NPs的组装体作为研究对象, 优化QDs/AuNPs浓度配比和AChE浓度后, 利用QDs/Au NPs-AChE-ATC体系对神经性毒剂模拟剂氰基磷酸二乙酯(Diethyl Cyanophosphonate, DCNP)进行检测。
1 实验方法
1.1 材料与仪器
柠檬酸三钠(分析纯, Adamas公司); 四水合氯金酸(HAuCl4×4H2O, 分析纯, Aladdin公司); 乙酰胆碱酯酶(AChE, 200 U/g, 北京索莱宝公司); 氯化硫代乙酰胆碱(ATC, 分析纯, Sigma-Aldrich公司); 磷酸缓冲液(1×PBS, pH 7.4, 北京雷根公司); 氧化镉(CdO)、氧化锌(ZnO)、硒粉、硫粉和氢氧化钠(NaOH)均来自Aladdin公司, 分析纯; 氰基磷酸二乙酯(DCNP)、十八烯(ODE)、十八胺(ODA)、十八烯酸(OA)和3-巯基丙酸(3-MPA)均来自梯希爱(上海)公司, 分析纯; 丙酮、正己烷来自北京化工厂, 分析纯; QDs、Au NPs粒径大小和浓度通过紫外可见吸收光谱仪(U-3900, 日本日立公司)测量得到。荧光光谱仪(F-4500, 日本日立公司)测定量子点及体系荧光光谱。
1.2 样品制备
1.2.1 还原法制备Au NPs
参考文献[15]将8.22 g HAuCl4×4H2O (0.02 mmol)溶解到20 mL水中, 加热至沸腾, 加入2.0 mL溶解了22.82 mg柠檬酸三钠的水溶液, 当溶液颜色由黄色变为酒红色, 继续回流10 min。自然冷却, 用23 μm滤膜去掉不溶物, 得到Au NPs溶胶备用。
1.2.2 连续离子层吸附反应法制备核壳型量子点CdSe/12ZnS QDs
参考文献[14]将56 mg CdO加热溶解于24 mL ODE和380 μL OA混合溶液中, 溶液澄清后冷却至160 ℃; 加入1.4 g ODA, 重新加热至240 ℃。随后, 快速注入2 mL硒的ODE悬浊液(0.2 mol/L)。反应60 s, 冷却至室温, 加入丙酮离心, 超声溶于正己烷中。将ZnO和硫粉在氮气保护下分别加热至310和120 ℃溶于ODE, 得到浓度均为0.06 mol/L的前驱体溶液。将0.5 μmol CdSe量子点加入到2.25 mL ODA和8 mL ODE的混合溶液中, 在惰性气氛下加热至210 ℃, 交替注入硫和锌前驱体。快速冷却至室温, 加入丙酮离心, 超声溶于正己烷备用。
1.2.3 制备QDs/Au NPs复合物组装体
取一定量上述制备的CdSe/12ZnS QDs, 加入少量NaOH固体和3-MPA, 离心, 依次用正己烷、比例为1 : 5的水和丙酮、pH为2.0的HCl水溶液、丙酮超声清洗, 除去量子点表面的长链有机配体。离心取量子点沉淀, 然后加入一定量制备的Au NPs溶胶, 搅拌、超声30 min, 得到澄清QDs/Au NPs复合物组装体水溶液。
1.3 检测溶液中DCNP
向250 μL水中依次加入100 μL PBS缓冲液、100 μL浓度为10–2U/L的AChE和50 μL不同浓度的DCNP溶液, 25 ℃下孵育20 min。随后加入10 μL浓度为5 mmol/L的ATC溶液, 25 ℃下孵育20 min。最后再加入500 μL制备的QDs/Au NPs复合结构溶液。其中, AChE、ATC、CdSe/12ZnS QDs和Au NPs的最终浓度分别为1.0×10–3U/L、0.05 mmol/L、70 mmol/L和3.5 mmol/L, 在400 nm光激发下测定体系的发射光谱。
2 结果与讨论
2.1 组装体的形成及FRET作用机理
图1为QDs/Au NPs组装体形成过程示意图, Au NPs表面的稳定剂柠檬酸末端的带负电荷的羧基(–COO–)阴离子会与量子点表面裸露的金属原子(如Zn或Cd)配位(络合常数~106M–1)[16], 形成组装体。通过调节溶液中量子点与纳米金颗粒的浓度, 可以轻松地调控组装在单个纳米金颗粒周围的量子点数目。形成组装体之后, 量子点与纳米金颗粒间的距离被拉近, FRET作用显著增强, 导致量子点发光猝灭。在QDs/Au NPs组装体体系中引入AChE和ATC后, 硫胆碱上的巯基(–SH)与量子点表面金属原子的配位作用(络合常数~109M–1)比羧基更强[17], 破坏组装体结构, 量子点与纳米金颗粒分开, 两者间的FRET作用减弱, 量子点发光一定程度上恢复, 从而实现目标分子的检测。图2为CdSe/12ZnS QDs、Au NPs及其复合物的TEM照片。从图2(a)中可以看出, Au NPs为表面光滑的球形颗粒, 分散效果较好, 直径约为13 nm。通过连续离子层吸附反应法得到的QDs呈球形, 分布均一(约3 nm)、分散良好(图2(b))。QDs和Au NPs混合装配后, Au NPs较组装前分散性提高(图2(c))。HRTEM照片显示Au NPs表面被QDs紧密包裹, 说明Au NPs与QDs能够在混合后自发形成图1所示的组装体结构。
2.2 组装体荧光性能研究
图 3(a)为Au NPs 的吸收光谱和CdSe/12ZnS QDs的发射光谱(ex=400 nm), 可以发现, Au NPs的吸收峰在523 nm左右, 而CdSe/12ZnS QDs的发射峰在540 nm左右, Au NPs的吸收与QDs的发光在470~680 nm波长范围内明显重叠, 两者之间能够有效发生FRET作用, 淬灭量子点发光。图3(b)为不同体系的荧光发射光谱, 从图中可看出, 与Au NPs组装后, CdSe/12ZnS QDs发光强度急剧下降。当加入AChE和ATC时, 体系荧光强度恢复至猝灭后强度的近4倍, 比文献报道结果提高近一倍[10]。相同条件下, CdSe QDs与Au NPs的复合结构在加入AChE和ATC后, 荧光强度不增反降(图3(a)内插图), 这主要是因为硫胆碱上的巯基(–SH)与CdSe QDs配位而形成表面缺陷, 促进光生载流子的非辐射跃迁, 导致荧光猝灭。而对于核壳型CdSe/12ZnS QDs, 宽带隙ZnS层的引入能够钝化并消除缺陷位点, 将载流子限域在核内, 增强荧光稳定性。同时, 硫胆碱的结合可以促进QDs与Au NPs分离, 降低两者间的相互作用, 从而抑制荧光共振能量转移, 进一步提高荧光恢复的程度。结果表明核壳结构以及组装体形貌是高灵敏检测的前提。
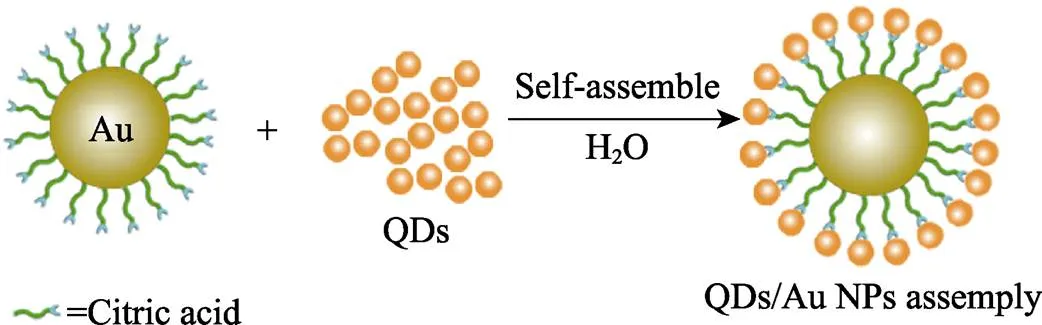
图1 QDs/Au NPs组装体形成过程示意图

图2 (a) Au NPs、(b) QDs和(c)Au NP/QDs复合物的TEM照片; (d) Au NP/QDs组装体的HRTEM照片
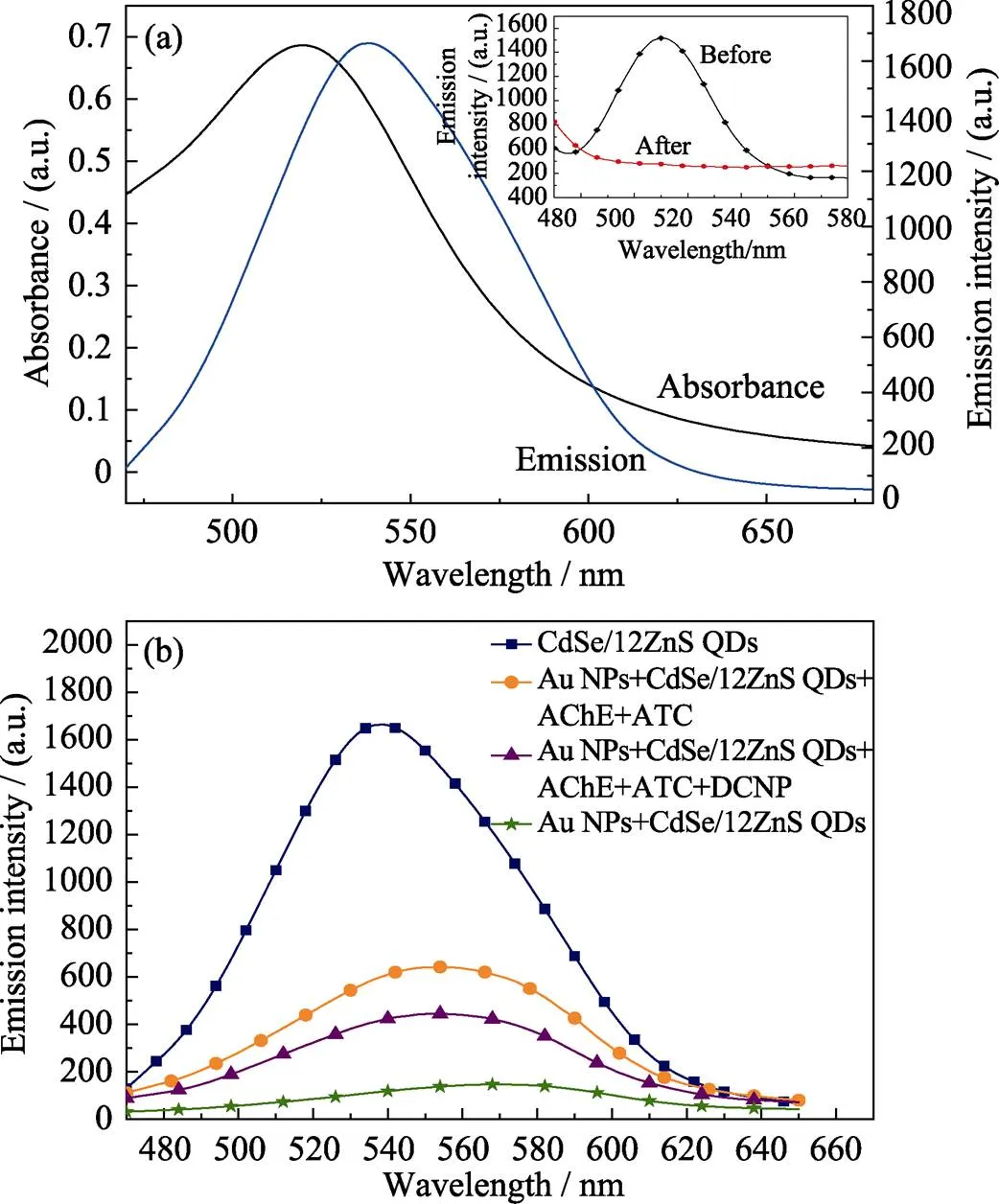
图3 (a) Au NPs 的吸收光谱和CdSe/12ZnS QDs的发射光谱(λex = 400 nm), 内插图为CdSe QDs与Au NPs复合结构在加入AChE和ATC前(黑线)后(红线)荧光强度对比; (b)不同体系的发射光谱, QDs、Au NPs、ATC、AChE和DCNP浓度分别为70 nmol/L、3.5 nmol/L、0.05 mmol/L、1.0×10–3 U/L、5.0×10–6 mol/L
2.3 组装体中QDs与Au NPs配比的优化
图4(a)为不同CdSe/12ZnS QDs与AuNPs浓度配比下组装前后的荧光发射强度对比, 可以看出与Au NPs组装后, QDs荧光强度急剧下降。图4(b)为相应的猝灭效率, 可用Q/Q0表示, 其中Q和Q0分别是与Au NPs组装前后QDs的荧光发射强度。随着QDs浓度增大,Q/Q0呈现先减小后增大的趋势, 并在QDs与Au NPs浓度比为20 : 1处出现最小值。这是因为当QDs配比较小时, 体系的荧光强度较低, 信噪比差; 当QDs与Au NPs浓度比继续增大时, QDs不能与Au NPs充分结合, 溶液中依然有大量游离的QDs, 从而导致Au NPs对量子点的发光猝灭效率降低。当QDs/Au NPs浓度比为20 : 1时, 荧光猝灭效率最高, 可高达97%, 相比文献通过静电作用结合的复合结构分别提高7%和17%[10-11], 说明组装体能够有效提高荧光共振能量转移的效率。
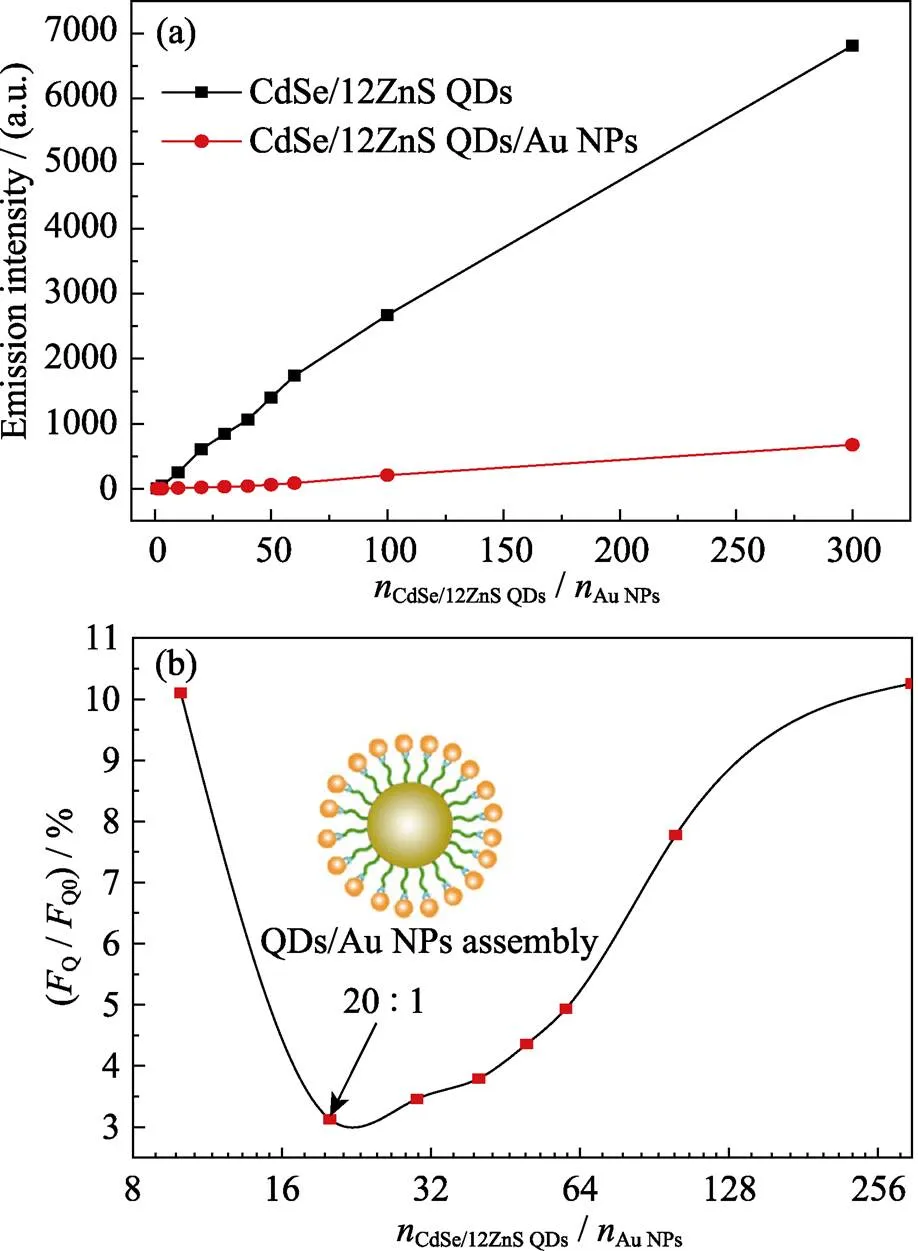
图4 (a)不同Au NPs (7 nmol/L)与QDs配比组装前后荧光对比; (b)不同Au NPs与QDs配比荧光猝灭效率(FQ/FQ0)
2.4 AChE浓度对组装体荧光恢复效果的影响
图5是不同AChE浓度下复合结构的荧光恢复情况,I0和I分别为加入AChE和ATC前后体系的荧光强度。如图所示,I/I0最初随着AChE的浓度(10–7~10–1U/L)增加而增加, 在10–3U/L时达到平衡, 此时水解ATC产生的硫胆碱恰好使QDs的荧光恢复达到最佳效果。若AChE浓度较低, 体系荧光强度变化范围窄, 检测的灵敏度低; 若AChE浓度太高, 则起抑制作用的DCNP浓度也需要增大, 导致检测限升高。因此, 在25 ℃、pH 7.4、Au NPs浓度为3.5 nmol/L且CdSe/12ZnS QDs与Au NPs浓度比为20 : 1的条件下, 体系中AChE的最佳浓度为1.0×10–3U/L。
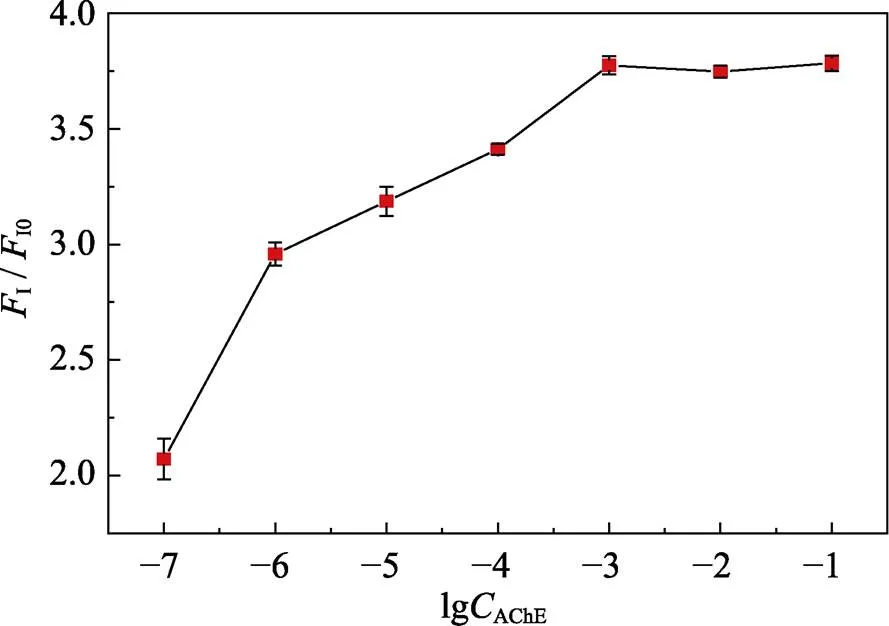
图5 不同AChE浓度下体系的荧光恢复效果
2.5 QDs/Au NPs-AChE-ATC体系检测DCNP
在上述最优条件下, 测试体系对神经毒剂模拟剂DCNP的检测性能。图6(a)是QDs/Au NPs-AChE- ATC体系在不同DCNP浓度下的荧光光谱图。图6(b)为DCNP浓度与R/R0的关系图,R0和R分别为CdSe/12ZnS QDs/Au NPs-AChE-ATC体系加入DCNP前后的荧光强度。从图6(a)中可以明显发现, 随着DCNP浓度的增大(5.0×10–9~5.0×10–4mol/L), 体系的荧光强度逐渐减弱, 恢复效率降低。从图6(b) 的内插图可以看出,R/R0与DCNP浓度的对数呈现良好的线性相关, 相关系数(2)为 0.994, 检测限达5.0×10–9mol/L。
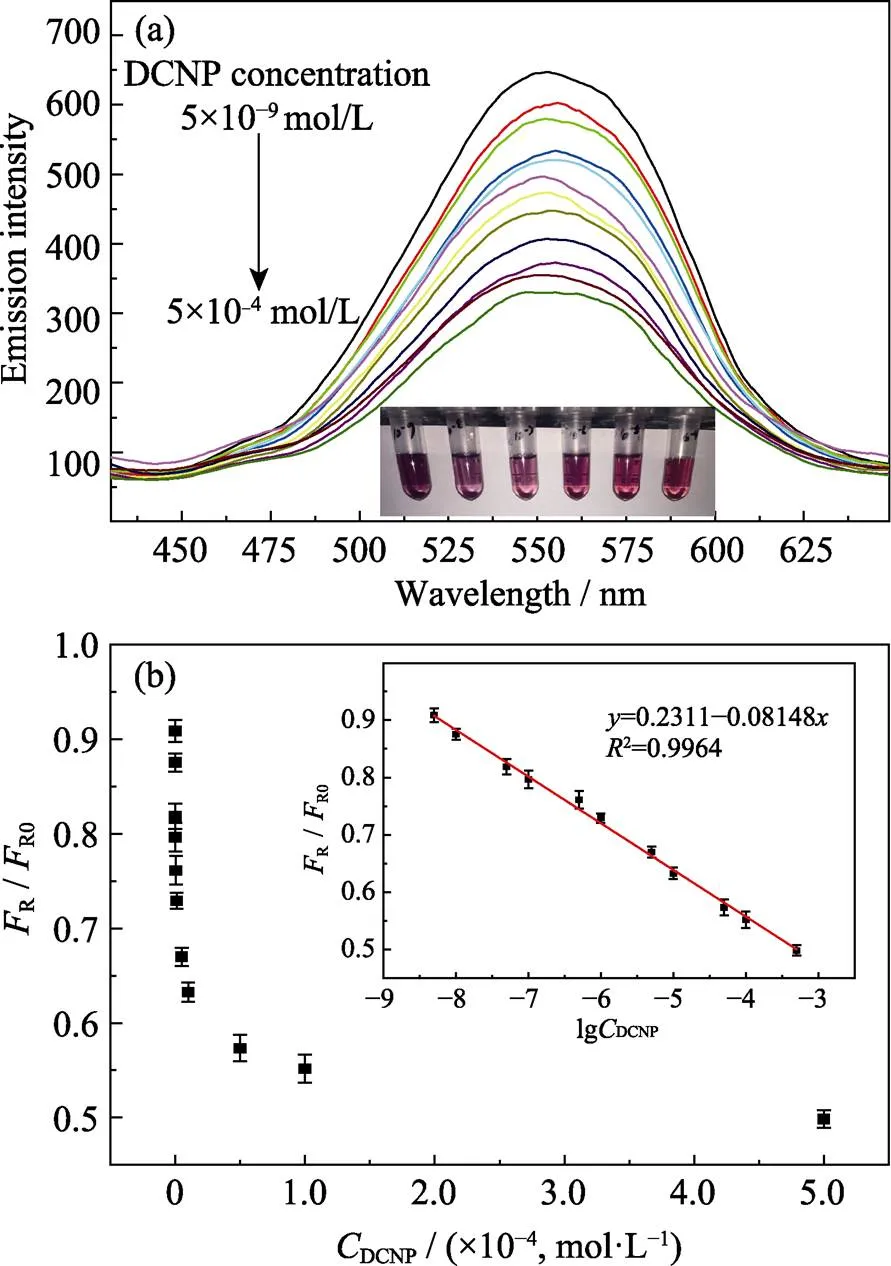
图6 (a)不同DCNP浓度下(5.0×10–9~5.0×10–4 mol/L)体系荧光发射光谱(λex=400 nm), 内插图为相应的溶液照片; (b)不同DCNP浓度下的体系FR/FR0值, 内插图为FR/FR0与DCNP浓度对数的线性关系
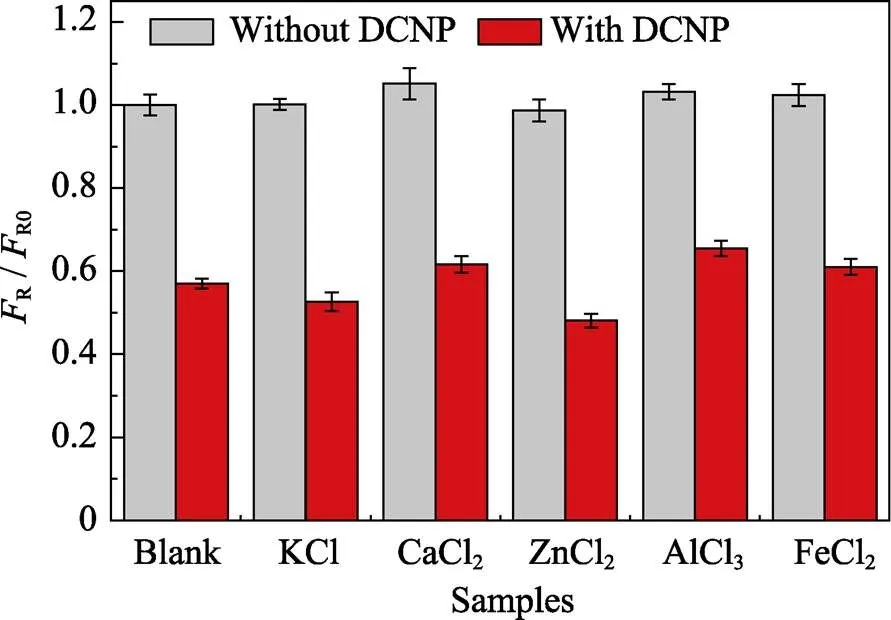
图7 不同干扰物对体系检测DCNP的影响, 其中DCNP和干扰物浓度均为5×10–4 mol/L
此外, 硫胆碱取代表面量子点与Au NPs结合后, 会改变Au NPs表面的电位正负性, 并导致其聚集, 从而引起表面等离子共振吸收红移[18]。在实验过程中, 当引入不同浓度的DCNP时, 随着其浓度升高, 硫胆碱生成速率减慢, Au NPs聚集程度也逐渐降低, 体系颜色也随之发生相应的变化。如图6(a)内插图所示, 随着DCNP浓度的增加, 体系颜色黑色变浅, 酒红色加深。这一现象说明该体系有望实现对DCNP的比色–荧光双通道识别。
2.6 干扰物对DCNP检测性能的影响
为了检验复合物体系在实际应用中对DCNP的检测能力, 分别研究了环境中常见干扰物KCl、CaCl2、ZnCl2、AlCl3和FeCl2等对DCNP检测效果的影响, 图7为不同干扰物下含有和不含DCNP的体系荧光恢复情况, 其中,R为各干扰物(含空白)加入DCNP前后体系的荧光强度,0均为空白条件下加入DCNP前的体系荧光强度。结果显示, 在两种情况下, 相对于无干扰物, 添加不同的干扰物荧光恢复效率无显著变化, 表明以上常见干扰物对FRET过程和DCNP的检测无明显影响, 体系具有较好的抗干扰性和在实际应用中检测DCNP的能力。
3 结论
研究利用Au NPs表面配体末端羧基与量子点裸露金属原子的配位成功制备了核壳型量子点CdSe/12ZnS QDs/Au NPs组装体, 并利用DCNP对AChE的抑制作用对DCNP进行高效检测。光谱分析表明QDs与Au NPs能够发生有效的FRET作用, 量子点的核壳结构将载流子限域在核内, 增强荧光稳定性, 提高荧光恢复倍率; 配位作用能够拉近量子点与纳米金颗粒之间距离, 显著提高FRET荧光猝灭效率。基于组装体的上述优势, 通过条件优化, 测定不同DCNP浓度下体系的荧光恢复强度, 将其应用于DCNP的检测。加入DCNP后量子点的荧光恢复效率R/R0与DCNP浓度的对数在5.0×10–9~ 5.0×10–4mol/L的浓度范围内存在良好的线性相关, 检测限达5.0×10–9mol/L。此外, 检测过程中不同DCNP浓度下金颗粒聚集程度不同, 溶液颜色表现出黑色到酒红色的差异, 也为DCNP的裸眼可见检测提供了可能。
参考文献:
[1] SZINICZ L. History of chemical and biological warfare agents., 2005, 214(3): 167–181.
[2] GUPTA R C. Handbook of Toxicology of Chemical Warfare Agents. Elsevier/AP, Academic Press is an Imprint of Elsevier, 2015: 90.
[3] SUN J F, GUO L, BAO Y,. A simple, label-free AuNPs-based colorimetric ultrasensitive detection of nerve agents and highly toxic organophosphate pesticide., 2011, 28(1): 152–157.
[4] SIMONIAN A L, GOOD T A, WANG S S,. Nanoparticle- based optical biosensors for the direct detection of organophosphate chemical warfare agents and pesticides., 2005, 534(1): 69–77.
[5] POHANKA M, KARASOVA J Z, KUCA K,. Colorimetric dipstick for assay of organophosphate pesticides and nerve agents represented by paraoxon, sarin and VX., 2010, 81(1/2): 621–624.
[6] AUBERT T, SOENEN S J, WASSMUTH D,. Bright and stable CdSe/CdS@SiO2nanoparticles suitable for long-term cell labeling.2014, 6(14): 11714– 11723.
[7] YU W W, PENG X G. Formation of high-quality CdS and other II-VI semiconductor nanocrystals in noncoordinating solvents: tunable reactivity of monomers., 2002, 41(13): 2368–2371.
[8] ZHOU J, YANG Y, ZHANG C Y. Toward biocompatible semiconductor quantum dots: from biosynthesis and bioconjugation to biomedical application., 2015, 115(21): 11669– 11717.
[9] LIU D B, CHEN W W, WEI J H,. A highly sensitive, dual- readout assay based on gold nanoparticles for organophosphorus and carbamate pesticides., 2012, 84(9): 4185–4191.
[10] WU X L, SONG Y, YAN X,. Carbon quantum dots as fluorescence resonance energy transfer sensors for organophosphate pesticides determination., 2017, 94: 292–297.
[11] GONG N C, LI Y L, JIANG X,. Fluorescence resonance energy transfer-based biosensor composed of nitrogen-doped carbon dots and gold nanoparticles for the highly sensitive detection of organophosphorus pesticides., 2016, 32(9): 951–956.
[12] TANG AI W, TENG F, GAO Y H,. Preparation and luminescent properties of CdSe and Core-Shell CdSe/CdS quantum dots in aqueous solution., 2006, 21(2): 322–328.
[13] CLAPP A R, MEDINTZ I L, UYEDA H T,. Quantum dot-based multiplexed fluorescence resonance energy transfer., 2005, 127(51): 18212– 18221.
[14] ZHU H M, SONG N H, LIAN T Q. Controlling charge separation and recombination rates in CdSe/ZnS type I core-shell quantum dots by shell thicknesses., 2010, 132(42): 15038–15045.
[15] GRABAR K C, FREEMAN R G, HOMMER M B,. Preparation and characterization of Au colloid monolayers., 1995, 67(4): 735–743.
[16] LI X B, GAO Y J, WANG Y,. Self-assembled framework enhances electronic communication of ultra-small sized nanoparticles for exceptional solar hydrogen evolution., 2017, 139(13): 4789–4796.
[17] HINES D A, KAMAT P V. Recent advances in quantum dot surface chemistry., 2014, 6(5): 3041–3057.
[18] ZHOU W, GAO X, LIU D,. Gold nanoparticles fordiagnostics., 2015, 115(19): 10575–10636.
Core/Shell Quantum Dots and Au Nanoparticles Assembly for Effective Detection of Nerve Agent Mimic
LI Sheng-Song1, ZHENG Yong-Chao1,2, MENG Shu-Lin3, WU Li-Zhu3, ZHONG Jin- Yi1,2, ZHAO Chong-Lin1,2
(1. Research Institute of Chemical Defense, Academy of Military Science, Beijing 102205, China; 2. State Key Laboratory of NBC Protection for Civilian, Beijing 102205, China; 3. Technical Institute of Physics and Chemistry, Chinese Academy of Sciences, Beijing 100190, China)
A novel assembly of CdSe/12ZnS core/shell quantum dots (CdSe/12ZnS QDs) and gold nanoparticles (Au NPs) was constructed for highly sensitive detection of nerve agent mimicdiethyl cyanophosphonate (DCNP). Due to fluorescence resonance energy transfer (FRET) from CdSe/12ZnS QDs to Au NPs, the emission intensity of QDs was quenched. Thiocholine generatedfrom acetylcholinesterase (AChE) and acetylthiocholine (ATC) would destroy the assembly structure to recover the emission of QDs. However, diethyl cyanophosphonate (DCNP) could inhibit the activity of AChE, thus leading to the suppressed fluorescence recovery. Therefore, the detection of DCNP was achieved by evaluating fluorescence recovery efficiency of QDs. Optimally, a linear relationship between fluorescence recovery efficiency of QDs and logarithmic concentration of DCNP was observed in a range of 5.0×10–9mol/L to 5.0×10–4mol/L. As a result, the limit of detection (LOD) was deternimed to be as low as 5.0×10–9mol/L.
quantum dots; gold nanoparticles; nerve agents mimic; fluorescence resonance energy transfer
TN304
A
1000-324X(2019)08-0893-06
10.15541/jim20180486
2018-10-15;
2018-12-16
国家自然科学基金(21603248) National Natural Science Foundation of China (21603248)
李盛菘(1994–),男,硕士研究生. E-mail: dotasongge@163.com
赵冲林,副研究员. E-mail: Zhaochonglin@126.com

