高粱碱溶蛋白ACE抑制肽的制备及其稳定性研究
周剑敏 尹方平 于 晨 汤晓智
(南京财经大学食品科学与工程学院;江苏省现代粮食流通与安全协同创新中心;江苏高校粮油质量安全控制及深加工重点实验室,南京 210023)
血管紧张素转化酶抑制肽(ACEIP)与血管紧张素Ⅰ(AngI)的结构相似,都是ACE的竞争性底物,在体内与ACE结合阻止了血管紧张素ⅠAngII 的生成,从而缓解和抑制血压的升高,所以ACEIP又被称为降血压肽[1]。1965年Ferreira等首次从蛇的毒液里分离出天然血管紧张素转化酶(ACE)抑制肽,从此科学界开始了对天然来源ACE抑制肽的研究[2]。1979年,Oshima等首次由利用细菌胶原酶水解明胶获得食源性ACE抑制肽,并且有较强抑制活性[3]。由于食源性ACE抑制肽与合成的ACE抑制肽相比,具备食用安全性高、低毒副作用、降压效果温和专一以及对血压正常者无任何不良影响等优势,而受到研究者的广泛关注,成为控制和治疗高血压研究的热点。目前,国内外对ACE抑制肽研究成果丰富,多种动植物蛋白如鱼皮明胶[4]、猪血红蛋白[5]、毛虾[6]、燕麦[7]、荞麦[8]、芝麻[9]、花生[10]等中均分离纯化得到ACE抑制肽。
中国是高粱主产国之一,有丰富的高粱种质资源,因此有可靠的高粱蛋白来源。但目前国内外关于高粱蛋白以及高粱蛋白肽的研究报道相对较少。Kamath 等用胰凝乳蛋白酶水解高粱醇溶蛋白后,从水解液中分离得到四种具有ACE抑制活性的组分[11];Filho 等从高粱蛋白中分离纯化出一种分子量为2 000Da的抗病毒肽[12]。本研究以高粱为原料,通过碱法提取高粱碱溶蛋白,研究不同蛋白酶以及酶解工艺对于ACE抑制肽的制备及ACE抑制率的影响,同时对ACE抑制肽在不同环境中的稳定性进行研究,明确以高粱蛋白来源的ACE抑制肽的最佳提取工艺及其稳定性,为高效合理利用高粱蛋白和开发ACE药物提供参考。
1 材料与方法
1.1 材料与试剂
实验材料:高粱:安徽燕之坊食品有限公司;血管紧张素转化酶(ACE)、N-[3-(2-呋喃基)丙烯酰]-L-苯丙氨酰-甘氨酰-甘氨酸(FAPGG)、胃蛋白酶、胰蛋白酶:Sigma-Aldrich公司;Alcase碱性蛋白酶、木瓜蛋白酶、风味蛋白酶、复合蛋白酶:诺维信公司;L-酪氨酸:索莱宝公司。
主要试剂:盐酸、磷酸氢二钠、磷酸二氢钠、氢氧化钠、酪氨酸、碳酸钠、福林酚试剂、三氯乙酸:国药集团化学试剂有限公司。
1.2 仪器与设备
上海嘉定粮油锤式旋风磨;Molecular酶标仪;D-3紫外检测仪;pHS-3C精密数显pH计;予华恒温加热磁力搅拌器;湘仪高速冷冻离心机。
1.3 方法
1.3.1 高粱碱溶蛋白的制备
脱壳高粱米经粉碎过60目筛得到微细高粱粉。称取高粱粉置于石油醚中(1 ∶7)在室温条件下振荡8 h后40 ℃低温烘干。取脱脂后高粱粉于烧杯中,加入浓度为0.15% NaOH溶液使得料液比为(1 ∶14),于40 ℃下反应1.5 h,5 000 r/min离心20 min,使用试剂盒测定上清液的蛋白含量。上清液冷却后调节pH为5.0,静置1.5 h,离心取沉淀,继续将沉淀水洗并离心3次,弃去上清液,冷冻干燥后即得高粱碱溶蛋白质。
1.3.2 蛋白酶活力测定
酶活力单位是指在一定温度和pH条件下,每分钟水解酪蛋白产生1 μg酪氨酸的酶量。本实验采用福林酚法测定蛋白酶活力[13],通过绘制酪氨酸标准曲线对照测定酶活力。
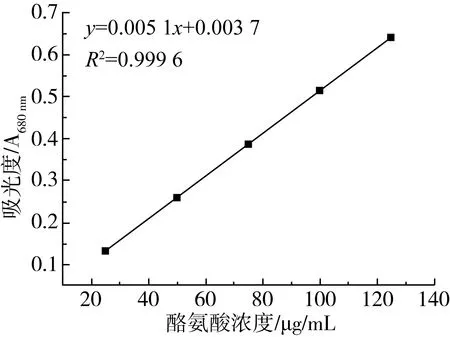
图1 酪氨酸标准曲线
1.3.3 酶解工艺流程
配制5 mg/mL的高粱蛋白溶液分散于各蛋白酶(胰蛋白酶、木瓜蛋白酶、风味蛋白酶、复合蛋白酶和Alcase碱性蛋白酶)的最适pH缓冲液中。置于恒温加热磁力搅拌器上,反应温度为各蛋白酶的最适温度(各蛋白酶的最适pH和温度见表1),加入蛋白酶后低速搅拌反应2 h,沸水浴灭酶15 min。待溶液冷却后于5 000 r/min,4 ℃条件下离心20 min,上清液即酶解液。
1.3.4 水解度的测定
取完全水解液0.1~1.0 mL于25 mL 比色管中,蒸馏水稀释至4.0 mL,加pH 8 缓冲溶液1.0 mL,茚三酮溶液1.0 mL,混匀,沸水浴加热15 min,冷却,蒸馏水稀释至25 mL。570 nm测吸光度(以水作参比)。另取100 mg蛋白加水100 mL,过滤,取相应体积的滤液,按上述方法测光密度值。相同体积样品的光密度之差与蛋白质量做工作曲线,取线性部分做标准曲线。
取1.0 mL酶解液稀释至100 mL,取稀释后水解液4.0 mL,测吸光度。另取相同浓度未水解蛋白溶液3.0 mL,按上述方法测吸光度,以二者光密度之差从标准曲线上查蛋白质含量。按公式计算水解度[14]:
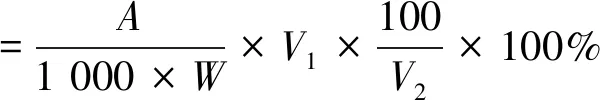
(1)
式中:A为由标准曲线得蛋白质量/mg,W为高粱蛋白粉质量/g,V1为水解液总体积/mL,V2为显色时所用稀释液体积/mL。
1.3.5 ACE抑制肽体外活性测定(FAPGG法)
参考Shalaby等[15]的方法,使用FAPGG为反应底物,通过酶标仪测定并计算ACE抑制率。将1.0 mmol/L FAPGG 溶解于pH为7.5、包含0.3 mol/L NaCl的50 mmol/L的Tris-HCl中配制底物溶液,置于37 ℃水浴锅中保温。取10 μL酶解液加入96孔酶标板中,然后加入 150 μL的底物溶液后,迅速放入酶标仪中,于340 nm下的测定吸光值,每30 s记录一次,共30 min。空白组以10 μL的缓冲液代替酶解液,对照组以10 μL的0.25 U/mL的ACE溶液代替酶解液。以吸光值变化(ΔA) 对时间作出曲线,计算斜率。计算公式为:
(2)
1.3.6 不同蛋白酶水解高粱蛋白酶解液ACE抑制活性的比较
选取胰蛋白酶、木瓜蛋白酶、风味蛋白酶、复合蛋白酶和Alcase碱性蛋白酶对高粱蛋白进行酶解反应。通过水解度、ACE抑制活性的测定,比较不同蛋白酶的水解效果,选择制备高粱蛋白ACE抑制肽的最佳用酶。
1.3.7 高粱蛋白酶解工艺条件优化
1.3.7.1 单因素实验
固定其他反应条件,分别改变酶量(800~4 800 U/g蛋白质)、反应温度(25~75 ℃)、pH(6.0~9.0)和酶解时间(0.5~5 h),以酶解产物的ACE抑制率为指标,分析各因素对酶解产物ACE抑制活性的影响,确定各单因素的最佳条件。
1.3.7.2 响应面法优化高粱蛋白酶解工艺条件
基于单因素实验结果,采用Design-Expert8.0软件与根据Box-Behnken中心组合设计原理,进行四因素三水平响应面实验(RSM),优化工艺参数,确定制备ACE抑制肽的最佳工艺。
1.3.8 高粱蛋白ACE抑制肽的稳定性测定
依据最佳条件制备高粱蛋白ACE抑制肽粗肽粉,配制5 mg/mL的高粱ACE抑制肽溶液,置于不同的环境中,以蛋白质水解液的ACE抑制率为考察指标,分别考察温度、pH和体外模拟胃肠道酶系对ACE抑制稳定性的影响。具体条件:将高粱蛋白溶液分别置于 20、40、 60、80、100 ℃水浴中保温2 h,冰水浴冷却,测定 ACE 抑制率;将高粱蛋白溶液的pH分别调至2.0、4.0、6.0、8.0和10.0,在4 ℃条件下冷藏保存 24 h 后,调节 pH 为 7.0,测定 ACE 抑制率;将高粱 ACE 抑制肽溶解于0.1 mol/L的HCl缓冲液(pH 2.0)中,配制成5%(m/V)溶液并加入适量的胃蛋白酶。在37 ℃水浴条件下水解3 h后,沸水浴灭酶10 min,冷却后用2 mol/L NaOH调pH值至7.0,5 000 r/min离心15 min,测定上清液的ACE 抑制率,取离心前pH值为7.0的溶液,加入适量胰蛋白酶,37 ℃水浴条件下继续水解3 h后,沸水浴灭酶 10 min,冷却后,5 000 r/min离心15 min,测定上清液的ACE抑制率。
1.3.9 数据处理和统计分析
采用Origin8.0和SPSS18.0数据处理软件对数据进行分析,并用Tukey法进行显著性分析(P<0.05),结果以XSD表示。
2 结果与分析
2.1 酶活力的测定结果
根据标准曲线结果,计算得到各蛋白酶活力如表1。
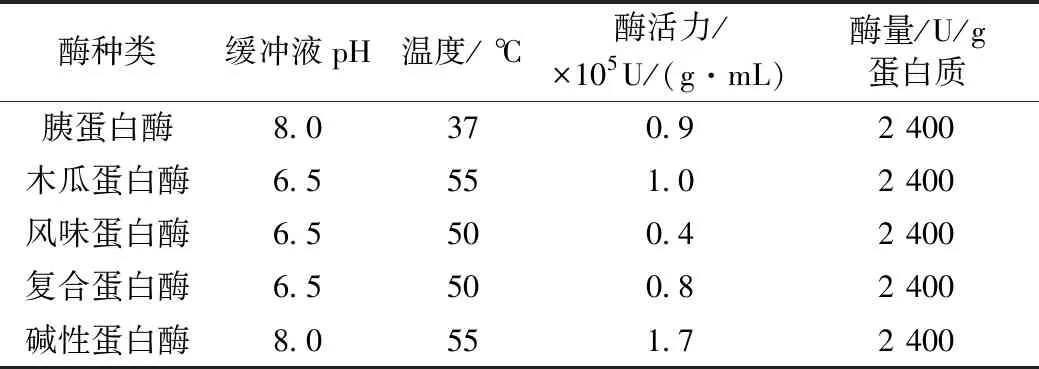
表1 酶活力的测定结果
2.2 不同蛋白酶水解高粱蛋白产物的水解度以及ACE抑制活性
由表2可知选择不同的蛋白酶酶解高粱蛋白的水解物都有一定的ACE抑制活性,说明以高粱蛋白为原料可以有效制备ACE抑制肽。
相对于其他蛋白酶,碱性蛋白酶水解高粱蛋白的产物具有最高水解度和最高ACE抑制率,分别为12.22%和72.13%。碱性蛋白酶具有高溶解性和高耐热性,其作用位点为羧基侧具有芳香族或疏水性氨基酸[16],这使得碱性蛋白酶能够针对性的作用于高粱蛋白,从而提升了水解度和ACE抑制率[17]。所以本研究选择碱性蛋白酶作水解高粱蛋白制备ACE活性肽,并以ACE抑制率作为评价指标设计单因素和响应面实验优化酶解工艺条件。
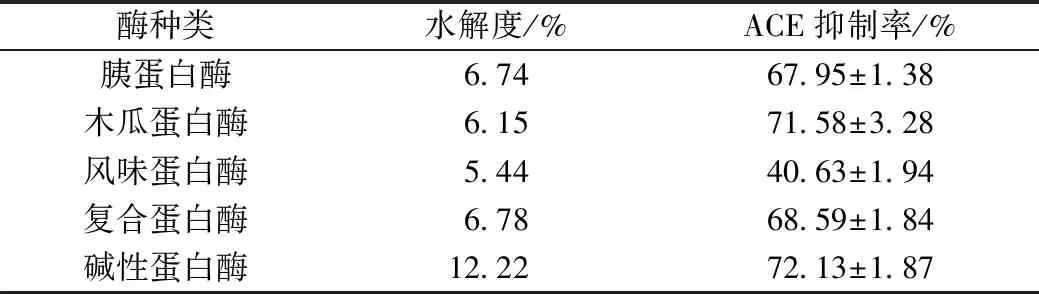
表2 不同蛋白酶水解高粱蛋白的水解度及ACE抑制活性
2.3 碱性蛋白酶酶解单因素实验
由图2可知,当碱性蛋白酶添加量在800~2 400 U/g范围内,随酶量的增加,水解产物的ACE抑制率显著上升。当酶量大于2 400 U/g时,继续增大酶量,水解产物的ACE抑制率之间无显著差异。高粱蛋白在碱性蛋白酶的作用下水解成为具有功能活性的短肽,当底物浓度不变,酶量处于800~2 400 U/g时,底物未能充分与碱性蛋白酶结合,生成的形成活性的水解产物少,ACE抑制率低;酶量增加时,更多的高粱蛋白被碱性蛋白催化水解,形成更多具有ACE抑制活性的短肽,使水解产物的ACE抑制率增加;当酶量大于2 400 U/g时,底物与碱性蛋白酶的结合达到饱和状态,此时继续加大酶量,水解产物的ACE抑制率变化不大。
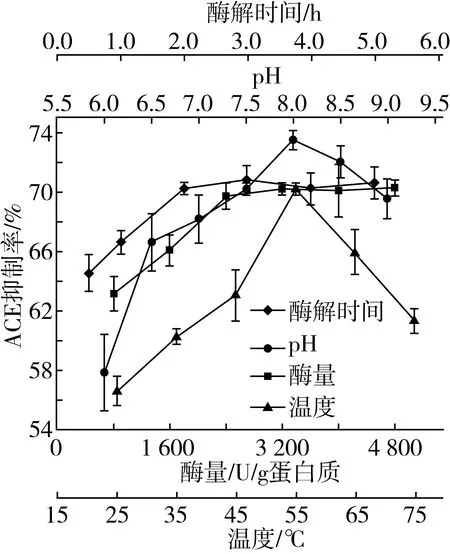
图2 酶量、pH、温度和酶解时间对ACE抑制率的影响
碱性蛋白酶活性反应体系对pH值的变化较敏感。如图2所示,pH值低于8.0时,水解产物的ACE抑制率随体系pH值的上升而显著增加,在pH值为8.0时有最大抑制率,为73.47%。当pH高于8.0时,水解产物的ACE抑制率开始降低。可能因为pH8.0是碱性蛋白酶进行酶促反应时的最适pH值,此时酶活性最强,水解效率最高,水解产物中含有更多的活性短肽,ACE抑制率高,但当pH低于或高于8.0时,碱性蛋白酶的活性下降,高粱蛋白被碱性蛋白催化水解效率下降,具有ACE抑制活性的短肽减少,ACE抑制率降低。
温度是影响酶促作用的关键因素。如图2所示,随着反应温度的升高,水解产物的ACE抑制率增加显著,当反应温度为55 ℃时,水解产物的ACE抑制率最大,为70.11%。随着温度的升高,碱性蛋白酶的活性增大,同时由于热运动与底物的接触几率增大,水解效率增加,ACE抑制活性也随之增加,但当温度超过最适温度55 ℃后继续升高,过高的反应温度导致碱性蛋白酶变性失活,底物不能被有效水解,进而降低了水解产物的ACE抑制率[18]。
由图2可知,当反应时间在0.5~2 h范围内,水解产物的ACE抑制率随着酶解时间的增加而显著增加,当反应时间超过2 h之后,水解产物的ACE抑制率变化不显著。因为酶解初始阶段,底物浓度较高,碱性蛋白酶未能与底物充分结合,水解产物的ACE抑制率低,随着反应时间的延长,更多的底物被碱性蛋白酶水解为具有ACE抑制活性的短肽,水解产物的ACE抑制率增加;当底物逐渐被转化完全后,反应饱和,水解产物的中ACE抑制肽含量不再增加,水解产物的ACE抑制率保持稳定。
2.4 酶解高粱蛋白制备ACE抑制肽的响应面优化
根据单因素实验结果,设计响应面实验因素水平表如表3所示。并以ACE抑制率作为响应值,进行响应面实验优化酶解工艺条件。
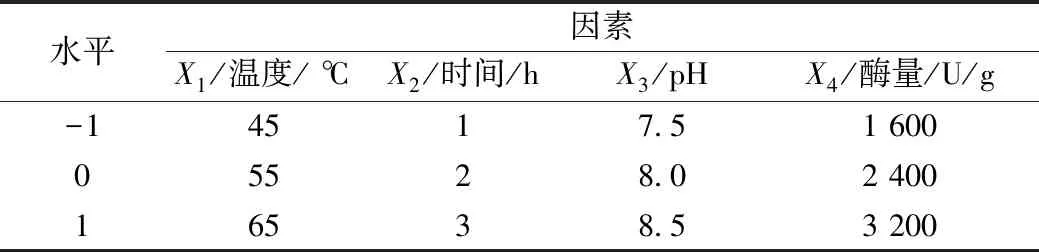
表3 响应面实验因素水平表
Box-Behnken实验设计结果如表4所示,并利用Design-Expert对响应面实验结果进行方差分析,结果见表5。各个因素经过二次多项回归拟合后,得到ACE抑制率(Y)与酶解温度、酶解时间、酶解pH、酶活力4个因素的二次多项回归方程为:
Y=69.68-0.917X1-4.633X2+0.960X3+3.139X4+0.230X1X2-0.754X1X3+0.246X1X4+0.197X2X3+4.015X2X4-1.5X3X4-2.093X12-3.684X22+2.193X32+0.529X42
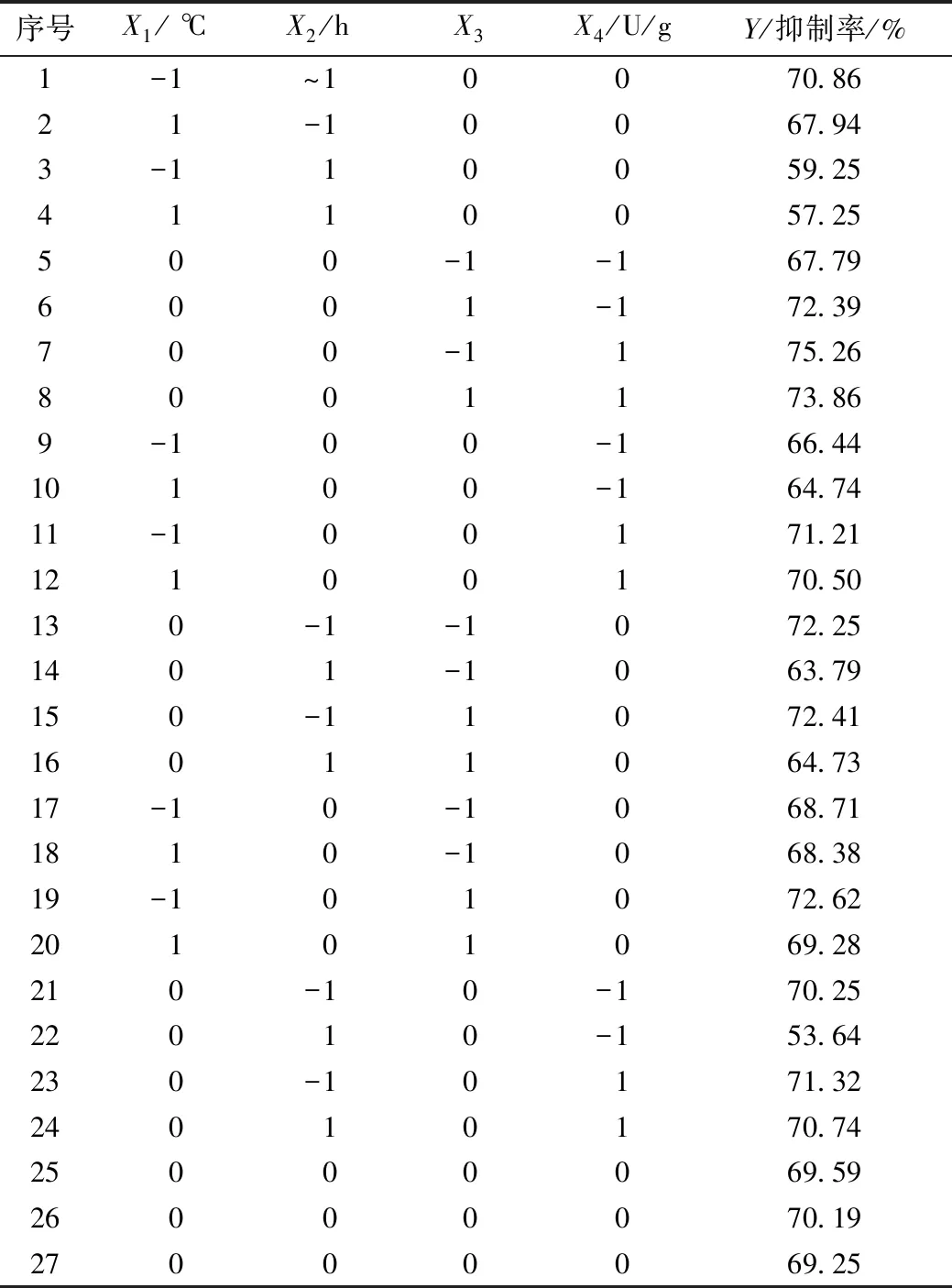
表4 响应面实验设计方案与结果
从表5的方差分析结果可知,模型极显著,失拟项不显著,说明回归模型理想,可以用来拟合反应温度(X1)、反应时间(X2)、pH(X3)和酶活力(X4)这4个因素对水解产物ACE抑制率的影响。R2=0.968 5;R2(Adj)=0.931 8证明回归方程与实际数据之间的拟合性良好。方程的一次项X2、X4对高粱蛋白水解产物的ACE抑制率影响极显著,X1影响显著,影响顺序依次为X2>X4>X1;二次项X12、X22、X32以及交互项X2X4、X3X4均有显著的影响。这说明响应值的变化十分复杂,这4个因素对水解产物ACE抑制率的影响并不是简单的线性相关关系,这4个因素之间存在交互作用。
通过分析计算得到碱性蛋白酶水解高粱蛋白制备ACE抑制肽的最优酶解条件为:反应温度55.5 ℃,酶解时间1.68 h,pH7.95,酶量2 360 U/g,水解产物的ACE抑制率预测值为76.84%。在该条件下重复3次,水解产物的ACE抑制率实测值为75.98%,与理论值误差在1%以内,说明该模型预测性能较好,对实际操作有一定的指导意义。
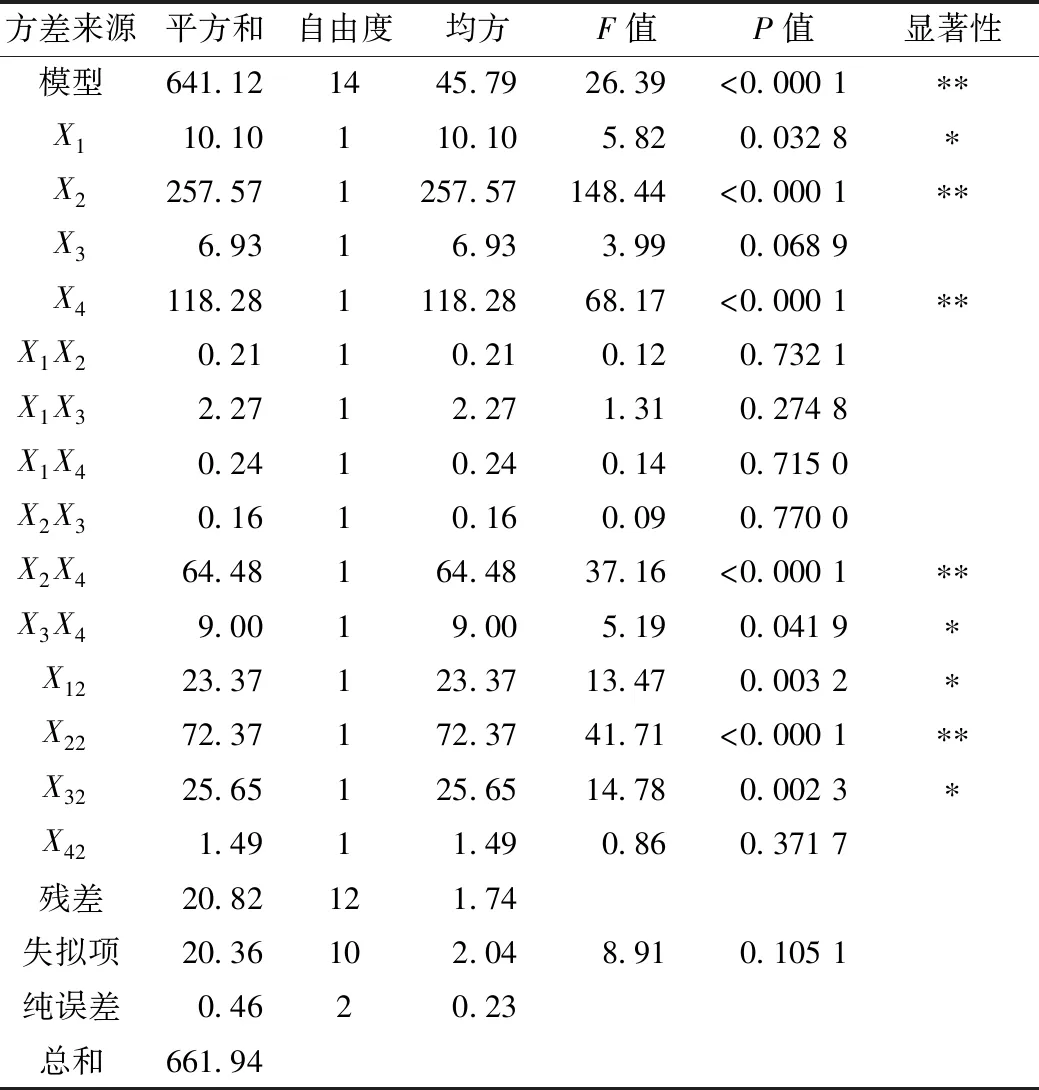
表5 方差分析结果
注:*表示显著(P<0.05);**表示极显著(P<0.01)。
2.5 高粱 ACE 抑制肽的温度稳定性、酸碱稳定性和体外消化稳定性
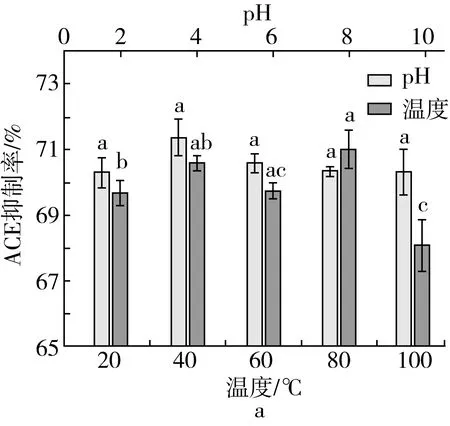
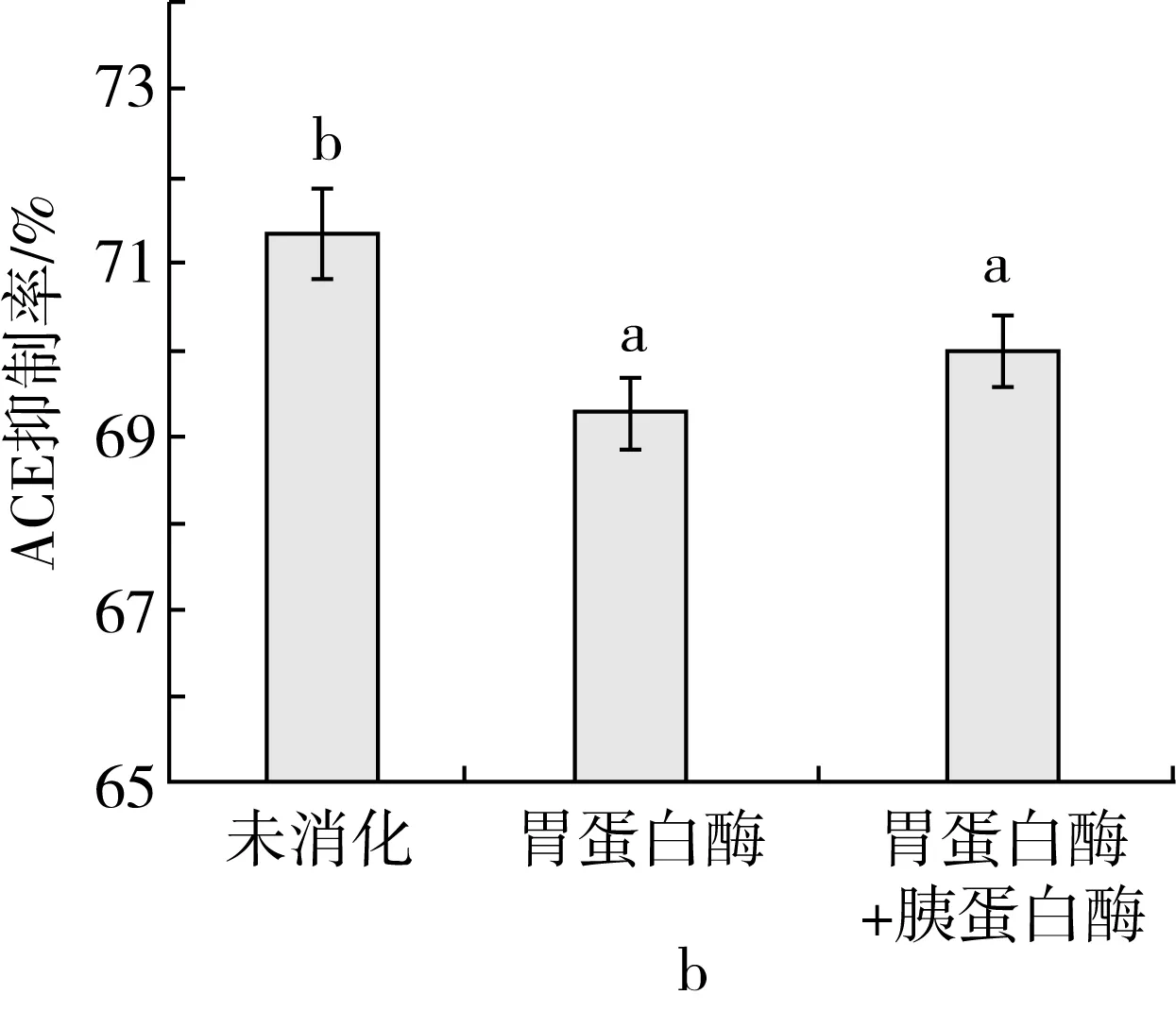
ACE抑制肽的稳定性是决定其能否长期保存以及有效作用的重要影响因素。通常ACE抑制肽体外稳定性的考察从温度、pH 值和模拟胃肠道稳定性等多方面进行考量,以作为判断 ACE 抑制肽能否投入生产应用的重要标准,如图3所示。
由图3A可知,储存温度在20~100 ℃之间变化时,ACE抑制肽的ACE抑制率在70.31%~71.37%内小范围波动,说明ACE抑制肽的抑制活性受温度影响不显著(P>0.05),ACE抑制肽在一定范围内具有良好的温度稳定性。
由图3A可知,在pH 2~10范围内,ACE抑制肽的ACE抑制率在68.08%~71.01%之间波动,当pH为10时,水解产物的ACE抑制率为68.08%,相对于pH 2~8时显著降低,这可能ACE抑制肽在碱性环境下发生了消旋作用,改变了肽链结构,降低了多肽的活性。总体看来,ACE 抑制肽在酸性和碱性条件下都能够保持良好的稳定性。
由图3B可知,相对于未消化的ACE抑制肽而言,经过胃蛋白酶消化后,ACE抑制肽的抑制率显著提升,再经胰蛋白酶消化后,ACE 抑制率基本无变化。这说明ACE抑制肽能在胃蛋白酶的水解作用下,进一步降解产生更多具有ACE抑制活性的多肽,ACE抑制率上升,所以ACE抑制肽有良好的体外消化稳定性。
注:不同的小写字母代表ACE抑制率对于处理方式的差异显著性差异(P<0.05)。图3 ACE抑制肽的温度稳定性、酸碱稳定性和体外消化稳定性
3 结论
通过碱法提取制备高粱碱溶蛋白,利用不同蛋白酶对其进行酶解,筛选出Alcalase碱性蛋白酶作为高粱蛋白制备ACE 抑制肽的水解用酶。结果表明,在一定范围内,水解产物的ACE抑制率随着酶量和反应时间的增加而增加,且水解产物的ACE抑制率在pH 8.0和温度55 ℃ 时有最大值。在此基础上进行响应面优化实验,确定高粱蛋白ACE 抑制肽的最佳制备条件:酶解温度55.5 ℃,酶解时间1.68 h,pH7.95,酶量2 360 U/g。在最佳条件下进行验证实验,实际值接近模型预测值,说明该模型可很好地用于高粱ACE抑制肽的制备。高粱ACE抑制肽具有良好的热稳定性、酸碱稳定性和体外消化稳定性。

