miR-92a对宫颈癌细胞增殖凋亡影响及其机制
王利娟 谷丽娟 孙颖川



[摘要]目的 探討miR-92a对宫颈癌细胞增殖凋亡的影响及其机制。方法应用逆转录-聚合酶链反应(RT-PCR)检测宫颈癌细胞系中miR-92a的表达情况。将细胞分为空白对照组(未转染)、miR-92a抑制物阴性对照组(转染miR-92a inhibitor NC)和miR-92a抑制物组(转染miR-92a inhibitor),并以RT-PCR检测转染效果,采用MTT法检测细胞增殖,流式细胞仪检测细胞凋亡,Western blot检测细胞中基质金属蛋白酶2(MMP-2)和生存素(Survivin)蛋白的表达。结果 与正常上皮293T细胞相比,miR-92a在宫颈癌Hela、C33A和Caski细胞中的表达水平均明显升高(t=6.446~14.544,P<0.001),其中以Hela细胞上升最为显著。与空白对照组比较,转染miR-92a inhibitor使Hela细胞中miR-92a的表达、A值、MMP-2和Survivin蛋白表达均显著下降,细胞凋亡率显著升高(t=3.479~22.18,P<0.05);而转染miR-92a inhibitor NC后差异无显著性(P>0.05)。结论 miR-92a在宫颈癌细胞中高表达,干扰其表达可以抑制细胞生长,其作用机制可能与下调MMP-2和Survivin蛋白表达有关。
[关键词]宫颈肿瘤;微RNAs;细胞增殖;细胞凋亡;基质金属蛋白酶2;凋亡调节蛋白质类
[中图分类号]R737.33;R342.2[文献标志码]A[文章编号] 2096-5532(2019)04-0406-05
[ABSTRACT]ObjectiveTo investigate the effect of miR-92a on the proliferation and apoptosis of cervical cancer cells and its mechanism. MethodsReverse transcription-polymerase chain reaction (RT-PCR) was used to measure the expression of miR-92a in cervical cancer cell line. Cells untransfected, transfected with miR-92a inhibitor negative control, and transfected with miR-92a inhibitor were assigned to blank control group, miR-92a inhibitor negative control group, and miR-92a inhibitor group, respectively, and the transfection effect was evaluated by RT-PCR. MTT assay was used to evaluate cell proliferation, and flow cytometry was used to detect cell apoptosis. Western blot was used to measure the protein expression of matrix metalloproteinase (MMP)-2 and survivin in the cells. ResultsCompared with normal epithelial 293T cells, the Hela, C33A, and Caski cells of cervical cancer had significant increases in the expression level of miR-92a (t=6.446-14.544,P<0.001), and the Hela cells had the greatest increase. Compared with the blank control group, the miR-92a inhibitor group had significant reductions in the expression of miR-92a, A value, MMP-2, and survivin protein in Hela cells, and a significant increase in cell apoptosis rate (t=3.479-22.18,P<0.05); however, there were no significant differences in the above indices between the miR-92a inhibitor negative control group and the blank control group (P>0.05). ConclusionmiR-92a is highly expressed in cervical cancer cells, and interfering with its expression can inhibit cell growth, possibly by down-regulating the expression of MMP-2 and survivin protein.
[KEY WORDS]uterine cervical neoplasms; microRNAs; cell proliferation; apoptosis; matrix metalloproteinase 2; apoptosis regulatory proteins
2015年数据显示,全球宫颈癌的新发病例和死亡数分别为52.76万和26.57万,而发展中国家是其高发区,且近年来有年轻化的趋势[1]。MiR-92a作为微小核糖核酸(miRNAs)中的一员,与血管内皮细胞的形成密切相关[2],且在胃癌、结直肠癌和肝细胞癌等多种肿瘤中高表达,与肿瘤细胞增殖和凋亡等生理过程密切相关[3-5]。有研究指出miR-92a在宫颈癌病人血清中的表达明显升高,且参与宫颈癌的增殖和侵袭[6-7],但其在宫颈癌中的作用及其机制尚不完全明确。故本研究采用RNA干扰其表达,旨在进一步阐明miR-92a对宫颈癌细胞增殖凋亡的影响及可能的分子机制。
1材料与方法
1.1细胞和试剂
正常上皮293T细胞和宫颈癌Hela、C33A、Caski细胞均来自中国科学院生物化学与细胞生物学研究所细胞库。引物、miR-92a inhibitor和miR-92a inhibitor NC购于上海吉玛制药技术有限公司,生存素(Survivin)抗体、β肌动蛋白(β-actin)抗体、基质金属蛋白酶-2(MMP-2)和辣根过氧化物酶标记的IgG(HRP-IgG)二抗均购自美国Santa Cruz公司;蛋白提取试剂盒、反转录试剂盒、二喹啉甲酸(BCA)蛋白检测试剂盒、膜联蛋白V-FITC(Anne-xin V-FITC)/碘化丙啶(PI)凋亡试剂盒和ECL发光试剂盒均购自上海碧云天公司,Trizol试剂和噻唑蓝(MTT)试剂购自大连Takara公司,胎牛血清、DMEM培养基、胰蛋白酶和Lipofectamine 2000均购自美国Sigma公司。
1.2实验方法
1.2.1细胞培养取出保存的293T、Hela、C33A和Caski细胞株,于37 ℃的水浴锅中解冻。解冻后,将其转移至含有2 mL DMEM完全培养液的4个离心管中,离心弃培养液,加入DMEM培养液悬浮细胞。将4种细胞分别转移至4个培养瓶中,补充培养液后置于含体积分数0.05 CO2、37 ℃、饱和湿度为95%的培养箱中培养。将4种细胞以适当的密度分别接种到含有体积分数0.10胎牛血清的DMEM培养液中,于培养箱内常规培养,待细胞融合度为70%时,加2.5 g/L胰蛋白酶消化,以1∶2比例进行传代。
1.2.2miR-92a表达检测收集上述4种细胞,用Trizol法提取总RNA,并以紫外线分光光度计检测其濃度,逆转录获取cDNA。逆转录-聚合酶链反应(RT-PCR)反应条件:94 ℃预变性4 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸45 s,共32个循环;反应体系为25 μL,其中正反引物各2 μL。以U6作内参,采用2-△△CT法计算miR-92a的表达水平。每个样品重复3次。所用引物及其序列见表1。
1.2.3细胞分组及转染取对数生长期的Hela细胞,以每孔2 mL(2×108/L)接种至96孔板上,将其分为空白对照组(A组)、miR-92a抑制物阴性对照组(B组)和miR-92a抑制物组(C组)。其中A组细胞不进行转染(只加入等量培养液稀释的Lipfectamine 2000),B和C组细胞分别转染miR-92a inhibitor NC和miR-92a inhibitor,按照Lipfecta-mine 2000脂质体转染试剂盒说明书操作。转染6 h后,更换培养液,继续培养48 h后收集细胞,以1.2.2中的方法检测转染效果。
1.2.4细胞增殖检测收集上述转染后48 h的各组Hela细胞,调整细胞密度后以每孔3×104个接种至培养板上,每组设5个复孔,在含体积分数0.05 CO2、37 ℃、饱和湿度为95%的培养箱中常规培养。48、72和96 h后收集细胞,加入5 g/L的MTT溶液20 μL,37 ℃下反应4 h后,弃上清,加200 μL二甲基亚砜,充分反应后,使用酶标仪(480 nm波长)检测各组细胞的吸光度(A)。重复3次。
1.2.5细胞凋亡检测分别取转染后48 h的各组Hela细胞,经胰酶消化及PBS洗涤后,以结合缓冲液重悬细胞,参照凋亡试剂盒说明书的步骤检测各组细胞的凋亡率。重复3次。
1.2.6MMP-2和Survivin蛋白表达检测取1.2.3中转染后48 h的各组Hela细胞,加入细胞裂解液提取总蛋白,BCA法检测其浓度。取50 μg蛋白样品上样到120 g/L的聚丙烯酰胺凝胶中电泳,结束后转至聚偏二氟乙烯膜上。以封闭液封闭2 h后,加入1∶800稀释的MMP-2抗体、Survivin抗体和β-actin抗体,于4 ℃下孵育过夜,再加入1∶1 000稀释的二抗,37 ℃下处理1 h后,ECL显色,以β-actin为内参,计算MMP-2和Survivin蛋白的相对表达量。重复3次。
1.3统计学分析
用SPSS 20.0软件进行统计学分析,计量资料数据以[AKx-D]±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。
2结果
2.1miR-92a在宫颈癌细胞中的表达
RT-PCR结果表明,与正常上皮293T细胞中miR-92a相对表达量(1.05±0.06)相比,miR-92a在宫颈癌Hela(3.78±0.35)、C33A(2.69±0.18)和Caski(2.26±0.23)细胞中的表达水平均明显升高(t=6.446~14.544,P<0.001),其中以Hela细胞上升最为显著(F=72.327,P<0.001)。
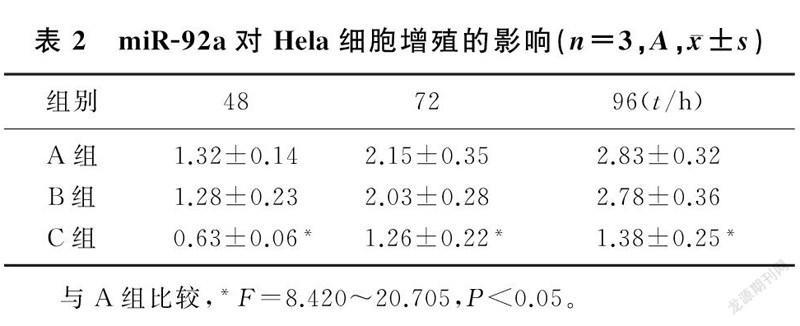
2.2miR-92a对Hela细胞增殖的影响
RT-PCR检测结果表明,转染miR-92a inhibitor使miR-92a的表达水平(0.18±0.02)较对照组(0.99±0.06)下降了18.18%,差异有统计学意义(t=22.18,P<0.001);而miR-92a抑制物阴性对照组(0.95±0.05)与空白对照组间miR-92a的表达差异无统计学意义(P>0.05)。提示抑制Hela细胞中miR-92a的表达是有效的。MTT法检测各组细胞的A值表明,与空白对照组相比,miR-92a抑制物组细胞的A值随时间的延长均显著降低(t=3.781~5.668,P<0.05),但miR-92a抑制物阴性对照组的A值变化不显著(t=0.191~0.510,P>0.05)。提示抑制miR-92a表达可明显抑制Hela细胞的增殖(F=8.420~20.705,P<0.05)。见表2。
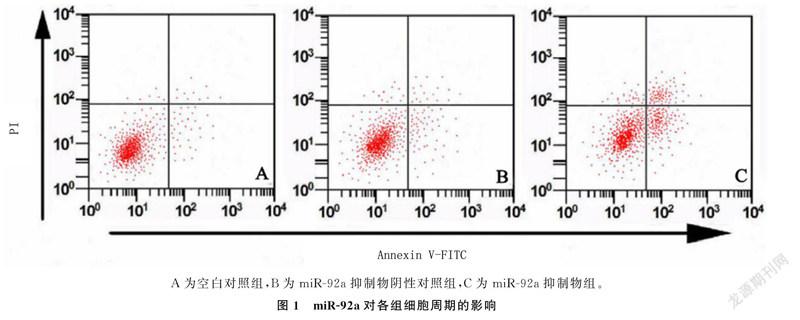
2.3miR-92a对Hela细胞凋亡的影响
流式细胞仪检测结果表明,与空白对照组的细胞凋亡率(6.22±1.03)%相比,转染miR-92a inhibitor的细胞凋亡率(16.35±2.42)%显著升高(t=7.766,P<0.05),而转染miR-92a inhibitor NC的细胞凋亡率(7.11±0.86)%上升不明显(t=0.682,P>0.05)。提示抑制miR-92a表达可诱导Hela细胞凋亡。见图1。
2.4miR-92a对MMP-2和Survivin蛋白表达影响
Western blot检测结果表明,MMP-2和Survivin在miR-92a抑制物组细胞中的表达较空白对照组均显著降低,差异具有统计学意义(t=3.479~4.877,P<0.05),而MMP-2和Survivin在miR-92a抑制物阴性对照组中的表达与空白对照组间的差异无统计学意义(t=0.316~0.610,P>0.05)。提示抑制miR-92a表达可以下调Hela细胞中MMP-2和Survivin蛋白的表达。见图2、表3。
3讨论
MiR-92a家族在血管形成、器官发育和肿瘤的进展方面具有重要调控作用,成熟的miR-92a基因是由miR-92a~1和miR-92a~2生成,位于13q13染色体上[8-10]。大量研究显示,miR-92a参与甲状腺乳头状癌、膀胱癌和子宫内膜癌等多种肿瘤的发生发展[11-13]。SHARIFI等[14]发现,抑制miR-92a表达可通过调控p63诱导白血病细胞凋亡并抑制细胞增殖。仲飞等[15]研究发现,miR-92a反义寡核苷酸可抑制胃癌细胞增殖并促进细胞凋亡。XIAO等[16]和赵靓等[17]在鼻咽癌及骨肉瘤的研究中发现,抑制miR-92a的表达可调控PTEN/Akt信号通路抑制癌细胞的增殖,并促进细胞凋亡。有研究发现,miR-92a在宫颈癌中高表达,但其在宫颈癌发生发展中的作用研究较少[6-7]。本研究RT-PCR检测结果表明,miR-92a在宫颈癌Hela、C33A和Caski细胞中的表达水平均明显升高,其中以Hela細胞上升最为显著。脂质体干扰Hela细胞中miR-92a的表达后,可明显抑制细胞增殖并促进细胞凋亡。提示miR-92a可能在宫颈癌中发挥着癌基因的作用。
基质金属蛋白酶(MMPs)可通过调控细胞周期参与成神经管细胞瘤细胞的增殖过程[18],也可以通过信号途径参与肺腺癌细胞凋亡[19]。MMP-2是MMPs成员之一,可通过降解Ⅳ型胶原蛋白、调节细胞间的黏附和促进新生血管形成等参与肿瘤细胞的增殖、侵袭和凋亡等过程[20-22],干扰MMP-2表达可下调VEGF和上调Cleaved Caspase-8蛋白表达,抑制前列腺癌细胞的增殖、侵袭和迁移,并促进细胞凋亡[23]。Survivin是最强的凋亡抑制因子,通过调控半胱氨酸天冬酶和微管蛋白等参与细胞凋亡及细胞的有丝分裂,在细胞周期、细胞增殖、凋亡和血管形成等过程中发挥着重要的作用[24-25]。MMP-2和Survivin在宫颈癌中的阳性表达率均显著高于正常宫颈组织,且与肿瘤的浸润深度及恶性程度密切相关[26]。LIN等[27]在miR-92a促进肺癌细胞侵袭的研究中发现,anti-miR-92a能够降低MMP-2活性。牛巍巍等[28]研究指出,miR-92a抑制物可通过下调Survivin和Bcl-2蛋白的表达促进胃癌细胞凋亡。为了探讨miR-92a抑制宫颈癌发生发展的分子机制,本研究采用Western blot进一步检测Hela细胞中MMP-2和Survivin蛋白的表达情况。结果显示,Hela细胞中MMP-2和Survivin蛋白的表达水平均显著下降,提示抑制miR-92a可能通过下调MMP-2和Survivin表达抑制细胞增殖、侵袭并促进细胞凋亡。
综上所述,miR-92a在宫颈癌细胞中高表达,干扰其表达可抑制细胞增殖并促进凋亡,其作用机制可能为下调MMP-2和Survivin表达。
[参考文献]
[1]MSPH L A T, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA: A Cancer Journal for Clinicians, 2015,65(2):87-108..
[2]SANTORO M M, NICOLI S. miRNAs in endothelial cell signaling: the endomiRNAs[J]. Experimental Cell Research, 2013,319(9, SI):1324-1330.
[3]REN Chuanli, WANG Wenshu, HAN Chongxu, et al. Expression and prognostic value of miR-92a in patients with gastric cancer[J]. Tumor Biology, 2016,37(7):9483-9491.
[4]ZHANG Guangjun, ZHOU He, XIAO Huaxu, et al. Micro RNA-92a functions as an oncogene in colorectal cancer by targeting PTEN[J]. Digestive Diseases and Sciences, 2014,59(1):98-107.
[5]赵丹懿,宋磊,李曼奇,等. 肝细胞癌中miR-92a的表达及其对HepG2细胞凋亡的影响[J]. 现代生物医学进展, 2013,13(20):3811-3813.
[6]KONG Qianqian, TANG Zhenhua, XIANG Fenfen, et al. Diagnostic value of serum hsa-miR-92a in patients with cervical cancer[J]. Clinical Laboratory, 2017,63(2):335-340.
[7]ZHOU C, SHEN L, MAO L, et al. miR-92a is upregulated in cervical cancer and promotes cell proliferation and invasion by targeting FBXW7[J]. Biochemical and biophysical research communications, 2015,458(1):63-69.
[8]李墨林,关兴芳,孙宇强,等. miR-92a家族与肿瘤关系的研究进展[J]. 生命科学, 2014,26(7):756-761.
[9]TODOROVIC L, STANOJEVIC B, MANDUSIC V A, et al. Expression of VHL tumor suppressor mRNA and miR-92a in papillary thyroid carcinoma and their correlation with clinical and pathological parameters[J]. Medical Oncology, 2018,35(2):17-26.
[10]GU Yueli, SI Jinchun, XIAO Xichun, et al. miR-92a inhibits proliferation and induces apoptosis by regulating methylenetetrahydrofolate dehydrogenase 2 (MTHFD2) expression in acute myeloid leukemia[J]. Oncology Research, 2017,25(7):1069-1079.
[11]TODOROVIC L, STANOJEVIC B, MANDUSIC V, et al. Expression of VHL tumor suppressor mRNA and miR-92a in papillary thyroid carcinoma and their correlation with clinical and pathological parameters[J]. Medical Oncology, 2018,35(2):17.
[12]MOTAWI T K, RIZK S M, IBRAHIM T M, et al. Circulating microRNAs, miR-92a, miR-100 and miR-143, as non-invasive biomarkers for bladder cancer diagnosis[J]. Cell Biochemistry and Function, 2016,34(3):142-148.
[13]TORRES A, KOZAK J, KOROLCZUK A, et al. In vitro and in vivo activity of miR-92a-Locked Nucleic Acid (LNA)-Inhibitor against endometrial cancer[J]. BMC Cancer, 2016,16(1):822-831.
[14]SHARIFI M, SALEHI R, GHEISARI Y A. Inhibition of microRNA miR-92a induces apoptosis and inhibits cell proliferation in human acute promyelocytic leukemia through modulation of p63 expression[J]. Molecular Biology Reports, 2014,41(5):2799-2808.
[15]仲飛,郝吉庆,王芳,等. miR-92a反义寡核苷酸对胃癌细胞增殖和凋亡的影响[J]. 安徽医科大学学报, 2012,47(2):137-141.
[16]XIAO Jie, YU Weifeng, HU Kongzu, et al. miR-92a promotes tumor growth of osteosarcoma by targeting PTEN/AKT signaling pathway[J]. Oncology Reports, 2017,37(4):2513-2521.
[17]赵靓,吴堂兵,夏春军,等. 微小RNA-92a靶向PTEN/Akt信号通路对鼻咽癌细胞增殖与凋亡的影响[J]. 临床肿瘤学杂志, 2017,22(8):673-677.
[18]GANJI P C, NALLA A K, GUPTA R A, et al. siRNA-Mediated downregulation of MMP-9 and uPAR in combination with radiation induces G(2)/M Cell-Cycle arrest in medulloblastoma[J]. Molecular Cancer Research, 2011,9(1):51-66.
[19]孙根林,鲍扬漪. 基质金属蛋白酶与肿瘤关系研究进展[J]. 重庆医学, 2010,39(21):2982-2985.
[20]田甜,朱煌,王洁,等. MMP-2与Ⅰ型胶原关系的研究进展[J]. 现代生物医学进展, 2015,15(9):1775-1777.
[21]CHEN Suxiu, YIN Junfeng, LIN Baochai, et al. Upregulated expression of long noncoding RNA SNHG15 promotes cell proliferation and invasion through regulates MMP2/MMP9 in patients with GC[J]. Tumour Biology: the Journal of the International Society for Oncodevelopmental Biology and Medicine, 2016,37(5):6801-6812.
[22]PENG Z, ZHANG Y. Propofol inhibits proliferation and accelerates apoptosis of human gastric cancer cells by regulation of microRNA-451 and MMP-2 expression[J]. Genetics and Molecular Research, 2016,15(2):1-9.
[23]邱承俊,程帆. MMP-2基因对前列腺癌细胞恶性表型的影响及其机制研究[J]. 临床和实验医学杂志, 2018.177(4):365-370.
[24]曲贝贝,左金华. 凋亡抑制基因Survivin的研究进展[J]. 中华临床医师杂志(电子版), 2014,5(15):58-63.
[25]CHEN W, ZHONG X, WEI Y, et al. RETRACTED ARTICLE:TGF-β regulates survivin to affect cell cycle and the expression of EGFR and MMP9 in glioblastoma[J]. Molecular Neurobiology, 2016,53(3):1648-1653.
[26]張小平,李明玉. KiSS-1蛋白和MMP-2在宫颈癌中的表达及临床意义[J]. 中国实验诊断学, 2013,17(3):507-510.
[27]LIN H Y, CHIANG C H, HUNG W C. STAT3 upregulates miR-92a to inhibit RECK expression and to promote invasiveness of lung cancer cells[J]. British Journal of Cancer, 2013,109(3):731-738.
[28]牛巍巍,杨春春,段志英,等. miR-92a 对人胃癌细胞株生物特性的影响及机制研究[J]. 现代中西医结合杂志, 2017,26(18):1948-1951.
(本文编辑于国艺)
