南方水稻黑条矮缩病对水稻营养物质和两种稻飞虱解毒酶活性的影响
杨熙彬 蒋德春 杨洪 金道超 周操

摘 要:在稻田生態系统中,白背飞虱和褐飞虱常常混合发生。为了探明南方水稻黑条矮缩病(SRBSDV)对水稻主要营养物质和两种稻飞虱体内解毒酶活性的影响,在室内测定了水稻感染SRBSDV后的主要营养物质可溶性糖、游离氨基酸的变化,以及褐飞虱和白背飞虱取食感病稻株后体内乙酰胆碱酯酶(AchE)和谷胱甘肽-S-转移酶(GST)活性的变化。结果表明:水稻在感染SRBSDV后,体内可溶性糖含量显著降低,游离氨基酸含量显著升高;在带毒水稻上取食24 h时,白背飞虱和褐飞虱的若虫、成虫体内AchE活性与对照相比显著降低;另外,取食12 h、24 h、5 d时,褐飞虱若虫、成虫体内GST活性显著高于对照,而取食12 h、24 h时的白背飞虱成虫、若虫体内GST活性相比对照稍有增强但差异不显著,但5 d时的酶活性显著高于对照。上述结果表明SRBSDV感染影响水稻体内游离氨基酸和可溶性糖的含量;另外,褐飞虱和白背飞虱取食感病植株后,可通过调节自身解毒酶活性的变化来适应逆境。
关键词:南方水稻黑条矮缩病毒;可溶性糖;游离氨基酸;解毒酶;稻飞虱
中图分类号:Q965
文献标识码:A
文章编号:1008-0457(2019)04-0013-06 国际DOI编码:10.15958/j.cnki.sdnyswxb.2019.04.003
Effects of Southern Rice Black-Streaked Dwarf Virus on Main Nutrients in Rice and Detoxification Enzymes Activity in Two Rice Planthoppers
YANG Xi-bin1,JIANG De-chun1,YANG Hong1,2*,JIN Dao-chao1,ZHOU Cao1
(1. Institute of Entomology,Guizhou University; Provincial Key Laboratory for Agricultural Pest Management of Mountainous Regions,Guiyang,Guizhou 550025,China; 2. College of Tobacco Science of Guizhou University,Guiyang,Guizhou 550025 ,China)
Abstract:The white-backed planthopper (WBPH) and brown planthopper (BPH) often occur in rice field ecosystems. In order to investigate the effect of southern rice black-streaked dwarf virus (SRBSDV) on the main nutrients in rice plant and the detoxification enzymes activity of two rice planthoppers,we measured the changes of the main nutrients such as soluble sugar and free amino acid in rice infected with SRBSDV,as well as the changes of Acetylcholinesterase (AChE) and glutathione S-transferase (GST) activities in BPH and WBPH after feeding on infected rice. The results showed that the soluble sugar significantly decreased and free amino acid significantly increased after rice infected SRBSDV. The activities of AchE in nymphs and adults of both WBPH and BPH after feeding for 24 h on infected rice were significantly lower than that of the control groups. In addition,the activities of GST in nymphs and adults of BPH after feeding for 12 h,24 h and 5 d on infected rice were significantly lower than that of the control groups. However,the activities of GST in adults and nymphs of WBPH after feeding for 12 h and 24 h were slightly but not significantly enhanced compared with that of the control groups,while the GTS activity at 5d was significantly higher than that of the control group. The above results demonstrated that SRBSDV infection affected the content of free amino acid and soluble sugar in rice plant. In addition,BPH and WBPH can adapt to adversity by adjusting the activity of detoxification enzymes after feeding on infected plants.
Key words:Southern rice black-streaked dwarf virus; soluble sugar; free amino acid; detoxification enzyme; rice planthoppers
南方水稻黑条矮缩病毒(Southern rice black-streaked dwarf virus,SRBSDV)于2001年首次在我国广东省阳西县发现的一种新型水稻病害,此病害主要由介体白背飞虱 Sogatella furcifera (Horváth)携带传播[1],在随后的几年内此病害在我国南部及越南北部连续发生,造成水稻大面积减产甚至颗粒无收,严重威胁我国粮食安全[2]。
植物体内营养物质含量的变化直接影响到植食性昆虫的取食,进而影响到其生长发育。已有研究表明,当植物遭受病原物的侵染时,会诱导体内可溶性糖、氨基酸以及碳水化合物含量的变化,其中氨基酸含量的变化会直接影响到植食性昆虫的取食[3-5]。植食性昆虫的生长发育与植株体内营养物质的含量变化密切相关。已有研究表明,当植物遭受病原物侵染时,会诱导其体内可溶性糖、氨基酸以及碳水化合物含量的变化,其中氨基酸含量的变化会直接影响到植食性昆虫的取食[3-5]。Colvin等[6]报道了植株感染东非木薯花叶病(African cassava mosaic virus,ACMV)后,导致其韧皮部汁液中4种氨基酸含量显著升高,且取食感病植株后,烟粉虱 Bemisia tabaci (Gennadius)的生长发育较健康植株的快。同样,感染水稻黑条矮缩病(rice black streak dwarf virus,RBSDV)的水稻植株,其体内氨基酸和可溶性糖含量显著高于对照,取食感病稻株后非介体白背飞虱生态适应性提高[7]。因此,取食感染病毒的植食性昆虫生态适应性的变化与稻株体内游离氨基酸和可溶性糖含量的变化密切相关。
植食性昆虫在选择利用寄主植物的过程中,不可避免会遇到对其生长发育产生不利影响的植物次生代谢物质,导致昆虫的代谢活动发生变化,诱发一系列的防御反应[8]。昆虫体内存在多种解毒酶系,主要包括羧酸酯酶(carboxylesterase,CarE)、 谷胱甘肽-S-转移酶(glutathione S -transferases,GST)和乙酰胆碱脂酶(acetylcholinesterase,AchE)等,会通过改变体内解毒酶来应对植物的诱导反应[9]。何晓婵等[7]研究表明,取食感染RBSDV的水稻后,白背飞虱雌性成虫体内解毒酶(AchE、GST和CarE)活性均显著增加。Xu等[10]研究表明,褐飞虱 Nilaparvata lugens (Stal)取食感染SRBSDV的病株1代后,成虫体内解毒酶GST和CarE活性显著高于对照。
稻飞虱是通过刺吸稻株汁液并传播多种植株病毒而对水稻植株造成危害,因此,水稻营养物质的变化直接影响其生长发育,进而诱导害虫体内生理生化的改变。本文通过比较感染植物病毒SRBSDV的水稻与健康稻株,研究稻株体内可溶性糖和游离氨基酸含量以及稻飞虱成虫、若虫取食水稻后其体内解毒酶活性的变化,明确稻飞虱与寄主间相互作用机制,以期为综合防治提供科学依据。
1 材料与方法
1.1 供试材料
1.1.1 供试毒源
SRBSDV毒源样品于2012年7月采于贵州省锦屏县新化乡发病水稻田内,将其移栽于室内人工气候室,对采回的样品进行检测是否带毒,参照周倩等[11]方法进行检测。
1.1.2 供试水稻
选用水稻品种中优 849号作为供试材料,在人工气候室内对未感病的水稻品种进行SRBSDV侵染,取四叶一心期的新鲜稻株作为供试水稻,以同期未带毒水稻作为对照。
1.1.3 供試虫源
白背飞虱和褐飞虱于2012 年 6 月采于贵州省贵阳市花溪区,饲养于人工气候箱内,在温度 (25±1)℃、湿度(70±1)%、光周期 16L∶8D的条件下饲养3代以上,确保供试虫源未携带任何毒源。
1.2 待测虫源
以饲养于无毒TN1水稻上的3龄若虫和初羽化成虫的褐飞虱和白背飞虱为供试虫源,分别接入于感染SRBSDV的四叶一心的稻株上,每株分别接入10头3龄若虫或初羽化成虫,以同期未带毒水稻为对照。将接入12 h、24 h 和5 d的虫源分别转入无菌1.5 mL 离心管内,于液氮中快速冷冻,置于-80℃冰箱保存备用。
1.3 实验步骤
1.3.1 水稻感染SRBSDV病毒的检测
取室内接毒后长至四叶一心期疑似感染SRBSDV的水稻幼嫩新鲜组织,参照One Step RT-PCR Kit试剂盒对样品进行总RNA提取。选用周倩等[11]设计的特异引物进行RT-PCR扩增:
S10F:5′-TTAAGTTTATTCGCAACTTCGAAG-3′;
S10R:5′-GTGATTTGTCAGCATCTAAAGCG-3′。
1.3.2 可溶性糖测定和游离氨基酸含量的测定
参照李合生[12]的方法,采用蒽酮比色法测定可溶性糖,采用水合茚三酮法测定游离氨基酸含量。
1.3.3 SRBSDV对两种稻飞虱解毒酶活性的测定
酶原液提取和蛋白质浓度测定:取各不同处理的成虫或若虫10头,置于预冷玻璃匀浆器中,加入1 mL的生理盐水于冰上充分匀浆,然后将其转移置1.5 mL离心管中,4℃、2500 r/min离心10 min,取上清液即为酶原液。酶原液蛋白质浓度的测定,采用考马斯亮蓝G-250染色法测定[13],吸取0.1 mL酶原液加3.0 mL考马斯亮蓝试剂混匀,室温静置5 min,测定OD595值,求出牛血清蛋白浓度的标准曲线。根据牛血清蛋白浓度的标准曲线计算出酶原液的蛋白质含量[14]。
解毒酶活性的测定:乙酰胆碱酯酶(AchE)、谷胱甘肽-S-转移酶(GST)活性的测定,均按照南京建成生物工程研究所的试剂盒说明书进行。
1.4 数据分析
采用 Excel 2016和SPSS 22.0软件进行实验数据处理,采用独立样本t检验比较感染SRBSDV水稻与健康水稻的主要营养物质之间和两种稻飞虱解毒酶的差异显著性。
2 结果与分析
2.1 水稻感染SRBSDV病毒的检测
利用特异性引物对S10F/S10R,采用RT-PCR技术可特异性扩增出室内疑似感染SRBSDV病毒的稻株,得到约477 bp的目的条带,与预期大小相符合,且未出现非特异性条带(图1)。因此,在进行南方水稻黑条矮缩病毒对寄主植物水稻主要营养物质影响测定时,取室内确定感染上SRBSDV的四叶一心期水稻进行备用。
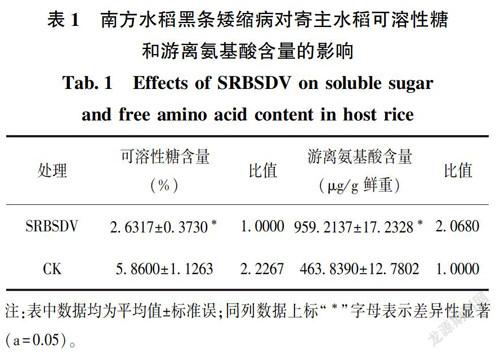
2.2 SRBSDV对寄主水稻可溶性糖和游离氨基酸含量的影响
南方水稻黑条矮缩病毒对寄主水稻可溶性糖和游离氨基酸含量的影响,统计分析结果见表1。感染SRBSDV的水稻叶片和健康水稻叶片内可溶性糖含量分别为2.6317 %和 5.8600 %,差异显著,且健康水稻叶片内的可溶性糖含量是携带SRBSDV水稻叶片内可溶性糖含量的2.2267倍;感染SRBSDV 的水稻叶片和健康水稻叶片其体内游离氨基酸含量分别为959.2137 μg/g和463.8390 μg/g,差异显著,且携带SRBSDV水稻叶片体内游离氨基酸含量是健康水稻叶片体内游离氨基酸含量的2.0680倍。
2.3 SRBSDV对褐飞虱体内解毒酶活性的影响
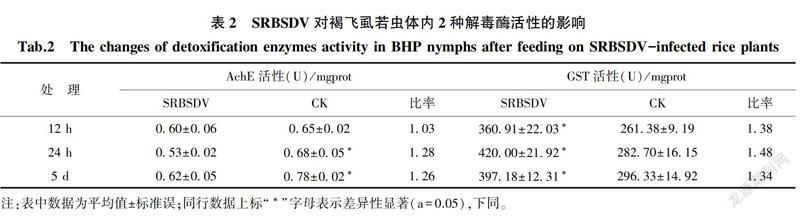
2.3.1 SRBSDV对褐飞虱若虫体内2种解毒酶活性的影响
结果表明,取食12 h时,若虫体内AchE活性相比对照差异不显著,取食感病稻株24 h、5 d时体内AchE活性显著低于对照,且为1.28和1.26倍,随着取食时间延长,在5 d时对比24 h时的活性有上调的趋势;若虫取食感病稻株12 h、24 h、5 d时的GST酶活性显著高于对照,分别为对照的1.38、1.48和1.34倍(表2)。
2.3.2 SRBSDV对褐飞虱成虫体内2种解毒酶活性的影响
结果表明,成虫取食感病稻株12 h、24 h、5 d时,体内AchE活性都低于对照,取食感病稻株24 h时的AchE活性显著低于对照,为对照的1.43倍。成虫在感病稻株上取食12 h、24 h和5 d时的GST酶活性显著高于对照,为对照的1.74、1.77和1.92倍(表3)。
2.4 SRBSDV对白背飞虱体内解毒酶活性的影响
2.4.1 SRBSDV对白背飞虱若虫体内2种解毒酶活性的影响
结果表明,若虫体内AchE活性随着取食时间延长呈现下降的趋势,且24 h、5 d时AchE活性显著低于对照,分别为对照的1.42和1.59倍;若虫取食感病稻株12 h、24h时GST活性高于对照,但差异不显著,在5d时GST活性显著高于对照,表明若虫体内GST活性随着时间的延长而升高(表4)。
2.4.2 SRBSDV对白背飞虱成虫体内2种解毒酶活性的影响
结果表明,成虫取食感病稻株12 h时,体内AchE活性低于对照水平,但差异不显著,取食24 h、5 d时的AchE活性显著低于对照,分别为对照的1.42和1.58倍,且成虫取食感病稻株后体内AchE活性随取食时间的延长而降低;总体上成虫体内GST的活性呈现出随取食的时间延长而增高的趋势,但是,成虫取食感病稻株12 h、24 h、5 d时的酶活性相比对照稍有增强,但差异不显著(表5)。
3 结论与讨论
糖类和氨基酸是植物体内的主要营养物质之一,也是昆虫重要营养物质的来源。当病原物侵染植物时,植物的正常代谢过程会受到一定的影响,进而影响到植物体内糖和氨基酸含量。本研究中发现,当SRBSDV侵染水稻后,水稻叶片体内的可溶性糖含量降低,与对照组存在显著差异。闫慧娟等[15]的研究发现感病品種的三叶期玉米植株接种矮花叶病毒(Maize dwarf mosaic virus,MDMV)后,叶片可溶性糖含量下降;张正坤等[16]和毛健民等[17]的研究发现烟草叶片接种烟草花叶病毒(Tobacco Mosaic Virus,TMV) 后,随着时间的增加,烟草中可溶性糖的含量逐渐下降,与本研究结果基本一致。但何哓婵等[7]的研究发现,水稻在感染RBSDV后植株体内的可溶性糖的含量则是正常稻株的3倍,与本研究试验结果不一致。我们发现,何晓婵等[7]测定的水稻品种为嘉优8号的叶鞘部位,而本实验中测定的是水稻中优849号的叶片部位,因此,我们推测可能是因为不同的水稻品种和测定不同部位造成结果差异。本研究中发现,当SRBSDV侵染水稻后,水稻叶片体内游离氨基酸含量上升,是对照组的2.0680倍,两组之间有显著差异。何哓婵等[7]的研究表明,感染RBSDV后水稻体内游离氨基酸含量相比对照显著增加,与本研究结果基本一致。这些研究表明,病毒感染寄主植物后,会影响寄主植物体内营养物质的改变。但这些营养物质的改变,是否有利于媒介昆虫的生长发育,进而有助于病毒的传播,还需要进一步的研究。
昆虫解毒酶及解毒机制在昆虫对植物次生物质的代谢及适应中发挥了重要作用[18]。有研究表明,GST和AchE作为昆虫体内重要的解毒酶,在昆虫的解毒代谢过程中起到重要作用[19-20]。Xu等[10]研究表明,褐飞虱取食感染RBSDV的病株1代后,成虫体内解毒酶GST和CarE活性显著高于对照组,且若虫存活率、雄性若虫发育历期、短翅型雌成虫重量均显著提高,在本研究中,非介体褐飞虱的成虫、若虫取食感染SRBSDV水稻后,体内AchE活性与对照相比显著降低,并且随着时间的延长,AchE活性整体呈现出降低的趋势;成虫、若虫取食感病稻株12 h、24 h、5 d时,体内GST酶活性显著高于对照,这与Xu等[10]的GST活性上升的结果一致。在本实验室前期研究[21]中发现褐飞虱取食感染SRBSDV的水稻后成虫寿命、产卵量显著减少,净生殖率和内禀增长率减小,表明非介体褐飞虱取食感染SRBSDV的稻株后,会导致其生长发育和繁殖能力下降。这与Xu等[10]实验结果不一致,我们推测可能是不同病毒对于害虫的生长发育具有不同的影响。
本研究发现,介体白背飛虱成虫、若虫取食感染SRBSDV水稻后,体内AchE活性显著下降,GST酶活性显著上升。Zhang等[22]报道了,介体白背飞虱取食感染SRBSDV水稻后,成虫寿命缩短,繁殖力高于对照但差异不显著,长翅型种群增长数量显著高于对照。同样,Xu等[23]研究表明,介体白背飞虱取食感染SRBSDV的稻株后,若虫发育历期、产卵量与对照相比显著提高,但成虫寿命及孵化率无显著影响,且取食感染SRBSDV水稻能够提高介体白背飞虱的生态适应性。因此,我们能够初步确定白背飞虱体内解毒酶活性的变化从生理和生化角度部分解释其生态适应性提高。本研究结果表明,同一时间下,取食感染SRBSDV水稻对白背飞虱解毒酶系统的影响大于对褐飞虱解毒酶系统的影响。
本研究结果表明,SRBSDV侵染水稻后,水稻叶片体内的可溶性糖含量显著降低,游离氨基酸含量显著上升;褐飞虱和白背飞虱的体内解毒酶GST含量显著上升、AchE含量显著下降,说明稻飞虱在取食感SRBSDV稻株后,导致害虫代谢活动发生变化的原因—通过调节自身解毒酶活性的变化来适应逆境。
参 考 文 献:
[1] 周国辉,张曙光,皱寿发,等.水稻新病害南方水稻黑条矮缩病发生特点及危害趋势分析[J].植物保护,2010,36(2): 144-146.
[2] 张 彤,周国辉.南方水稻黑条矮缩病研究进展[J].植物保护学报,2017,44(06): 896-904.
[3] Yin X,Xu F F,Zheng F Q, et al . 1.Molecular characterization of segments S7 to S10 of a southern rice black streaked dwarf virus isolate from maize in northern china[J]. Virologica Sinica ,2011,26(1): 47-53.
[4] Doring T F,Chittka L. Visual ecology of aphids-acritical review of the role of colours in host finding[J]. Arthropod Plant Interactions ,2006,1:3-16.
[5] Medina-Ortega K J,Bosque-Perez N A,Ngumbi E, et al . Rhopalosiphum padi (Hemiptera: Aphididae) responses to volatile cues from Barley yellow dwarf virus-infected wheat[J]. Environmental Entomology ,2009,38:836-845.
[6] Colvin J,Omongo C A,Govindappa M R, et al . Host-plant viral infection effects on arthropod-vector population growth,development and behavior : management and epidemiological implications[J]. Advanced in virus research ,2006,67(1):419-452.
[7] 何晓婵,徐红星,郑许松,等.水稻黑条矮缩病毒对非介体稻飞虱-白背飞虱适应性的影响[J].中国水稻科学,2011,25(6): 654-658.
[8] 曹 溪,朱春亚,张茂新,等.苦瓜素Ⅰ对亚洲玉米螟的生物活性及对其幼虫体内代谢酶活性的影响[J].昆虫学报,2015,58(6): 625-633.
[9] 陈澄宇,唐志娇,史雪岩,等.昆虫对植物次生物质的代谢适应机制及其对昆虫抗药性的意义[J].昆虫学报,2015,58(10): 1126-1139.
[10] Xu H X,He X C,Zheng X S, et al . Influence of rice black streaked dwarf virus on the ecological fitness of non-vector planthopper Nilaparvata lugens ( Hemiptera: Delphacidae) [J]. Insect Science ,2014,21(4):507-514.
[11] 周 倩,朱俊子,梁晋刚,等. 南方水稻黑条矮缩病毒快速检测[J].基因组学与应用生物学,2010,29(5): 1009-1012.
[12] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000: 195-197.
[13] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry ,1976,72: 248-254.
[14] 陈 晨,蒋德春,杨 洪,等.南方水稻黑条矮缩病对褐飞虱和白背飞虱体内三种保护酶活性的影响[J].环境昆虫学报,2016,38(1): 113-118.
[15] 闫慧娟,韩玉杰,周小梅,等. 不同抗性玉米接种矮花叶病毒后的生理生化变化研究[J].山西大学学报(自然科学版),2010,33(3): 458-462.
[16] 张正坤,沈建国,谢荔岩,等.鸦胆子素D对烟草抗烟草花叶病毒的诱导抗性和保护作用[J].科技导报,2008,26(8): 31-36.
[17] 毛健民,郑爱珍,白 岩,等.烟草叶片感染花叶病毒时的某些生理生化变化[J]. 吉林农业大学学报,2002,24(4): 19-21.
[18] 黄敏燕,李雪峰.植物次生物质对斜纹夜蛾解毒酶活性的影响[J]. 基因组学与应用生物学,2018,37(8): 3495-3502.
[19] 燕赛英,杜孟芳,尹新明,等.烟蚜茧蜂寄生对麦二叉蚜体内解毒酶和保护酶活性的影响[J].河南农业大学学报,2015,49(04): 488-493.
[20] 冯春富,严善春,鲁艺芳,等.兴安落叶松诱导抗性对舞毒蛾幼虫解毒酶活性的影响[J].林业科学,2011,47(8): 102-107.
[21] 蒋德春,金道超,杨 洪,等.南方水稻黑条矮缩病对非介体褐飞虱生长发育和繁殖的影响[J].山地农业生物学报,2013,32(1):1-5.
[22] Zhang J,Zheng X,Chen Y D,et al. Southern rice black-streaked dwarf virus infection improves host suitability for its insect vector, Sogatella furcifera ( Hemiptera: Delphacidae) [J]. Journal of Economic Entomology ,2014,107(1): 92-97.
[23] Xu H X,He X C,Zheng X S, et al . Effects of SRBSDV-infected rice plants on the fitness of vector and non-vector rice planthoppers[J]. Journal of Asia-Pacific Entomology ,2016,19:707-710.

