九香虫溶菌酶基因 CcLys 的克隆与特征分析
张振娟 齐小浪 李尚伟 喻廷君 杜娟



摘 要:九香虫 Coridius chinensis 是我国一种重要的药食两用昆虫,溶菌酶是一种具有抗菌作用的糖苷水解酶。该研究从九香虫中克隆了一种溶菌酶基因 CcLys ,其cDNA长883 bp,包含一个669 bp的开放阅读框,编码222个氨基酸。九香虫溶菌酶CcLys的N-端包含一段由18个氨基酸组成的信号肽,成熟CcLys形成7个α-螺旋,8个β-折叠片的三维结构。同源性和聚类分析显示CcLys与茶翅蝽 Halyomorpha halys 溶菌酶的亲缘关系最近。基因表达谱分析表明, CcLys 在九香虫的整个发育阶段都有表达,在3龄若虫中表达水平最高;该基因在所检测的成虫组织中都有表达,在脂肪体中表达水平最高。成虫被细菌诱导后, CcLys 的表达水平在12 h达到峰值。该研究为进一步明确 CcLys 基因的功能及开发新型抗菌藥物奠定基础。
关键词:九香虫;溶菌酶;糖苷水解酶;基因表达模式
中图分类号:R282
文献标识码:A
文章编号:1008-0457(2019)04-0001-07 国际DOI编码:10.15958/j.cnki.sdnyswxb.2019.04.001
Cloning and Characterization of Lysozyme Gene CcLys from Coridius Chinensis
ZHANG Zhen-Juan,QI Xiao-lang,LI Shang-wei,YU Ting-Jun,DU Juan
(Provincial Key Laboratory for Agricultural Pest Management of Mountainous Region,Institute of Entomology,Guizhou University,Guiyang,Guizhou 550025,China)
Abstract: Coridius chinensis is an important insect used for both medicine and food source in China,and lysozyme is a glycoside hydrolase with antimicrobial activity. In this study,alysozyme gene,designated CcLys ,was cloned from C. chinensis . The CcLys cDNA was 883 bp in length which contained a 669 bp open reading frame (ORF) that encoded 222 amino acids. CcLys contained a signal peptide composed of 18 amino acids at N-terminus,and the mature CcLys formed a three-demensional structure consisted of 7 α-helix and 8 β-pleated sheets. Homology and cluster analyses showed that CcLys possesses the closest relationship with that of Halyomorpha haly. Gene expression analyses indicated that CcLys was expressed throughout the developmental stages of C. chinensis with the highest expression level in the 3rd instar nymph,and this gene was expressed in the adult tissues tested with the highest expression level in the fat body. The mRNA expression level of this gene peaked at 12 h post induction by bacteria. This study will provide a foundation for further understanding the function of CcLys gene and developing new antimicrobial drugs.
Key words: Coridius chinensis ; lysozyme; glycoside hydrolase; gene expression pattern
昆虫在外界因素(细菌、真菌等病原体)刺激下激活体内的先天性免疫途径,产生抗菌肽等体液免疫因子,有效地抵御病原体的侵染[1]。溶菌酶是参与这种保护机制的重要分子之一。溶菌酶(lysozyme)是一个庞大而多样的肽聚糖水解酶家族,又称胞壁质酶(muramidase),广泛存在于自然界,具有抗菌、消炎、抗病毒和消化等多种作用[2-3],具有生物相容性好、对组织无刺激无毒性的特点,已被作为一种杀伤病原微生物而不破坏机体的优质酶制剂。溶菌酶化学性质稳定,商品化产品主要来自于蛋清溶菌酶,仅对革兰氏阳性菌有抑制作用,为此国内外科研人员一直致力于开发新型溶菌酶;更多溶菌酶的不断发现和对该酶的深入研究,使其在商业和医疗应用显现出巨大的潜力和价值[4-5]。
根据其分子结构和来源的不同,溶菌酶分为6类:C型(鸡型溶菌酶)、G型(鹅型溶菌酶)、I型(无脊椎动物型溶菌酶)、噬菌体型、细菌型和植物型[6]。从后生动物中已经鉴定出C、G和I型三种溶菌酶,它们都能水解细菌细胞壁肽聚糖N-乙酰胞壁酸(N-acetylmuramic acid,NAM)和N-乙酰氨基葡萄糖(N-acetylglucosamine,NAG)之间的β-1,4-糖苷键[7]。动物性溶菌酶分布广泛,主要存在于动物的免疫器官、免疫细胞、消化系统以及高等动物的分泌物中。C型溶菌酶是截止目前被众多学者研究得最多和最深入的类型,该类溶菌酶大多都来自于昆虫以及脊椎动物[8]。不同种类的溶菌酶蛋白的氨基酸排列不同,但是都具有保守的酶活性位点,发挥水解功能;C型溶菌酶的活性中心含有必需基因Asp和Glu[9]。
九香虫 Coridius chinensis 是我国重要的药用昆虫,隶属于昆虫纲半翅目蝽科瓜蝽属,具有理气止痛、温中助阳之功能[10-11]。九香虫是一种药食两用昆虫,在全国大部分地区均有分布,具有极大的开发利用价值[12-13]。该虫在自然界中很少发生被病原微生物感染而导致死亡的情况,这要归功于它的先天免疫系统。体外实验表明,九香虫对金黄色葡萄球菌、伤寒杆菌、甲型副伤寒杆菌和福氏痢疾杆菌具有很强的抗菌作用[14]。吴玛莉等[15]用凝胶过滤法从九香虫血淋巴的上清液中分离提纯获得一种1-14.4 kDa的抑菌小分子肽,对大肠杆菌和金黄色葡萄球菌都有抑制作用。李尚伟等[16]对九香虫血淋巴进行质谱分析得到了10条短肽,并对其中一条短肽进行了抗菌活性研究,结果表明该肽对革兰氏阳性菌和阴性菌均具有明显的抑菌作用。本研究用反转录PCR(reverse-transcription PCR,RT-PCR)从九香虫中克隆了溶菌酶基因,命名为 CcLys ,并对其进行特征分析,为进一步研究该基因的功能、开发新型的抗菌药物及九香虫资源的开发利用奠定基础。
1 材料与方法
1.1 实验昆虫和样品收集
对采自野外的九香虫成虫在贵州大学昆虫研究所进行室内饲养,温度为(25±1)℃,相对温度70%左右,光周期14L∶10D。收集卵、1~5龄若虫、成虫以及成虫的不同组织(头部、肌肉、体壁、脂肪体、睾丸和卵巢)样本,置于RNAlater(Qiagen,Duesseldorf,Germany)中在-20℃条件下保存备用。
1.2 主要试剂和仪器
HP TotalRNA Kit 购于美国 Omega Bio-Tek 公司;RevertAid First Strand cDNA Synthesis Kit和2× SYBR Select Master Mix购于美国Thermo Fisher科技有限公司;大肠杆菌 Escherichia coli TOP10 感受态细胞、DL2000 DNA marker和PrimeScript RT-PCR Kit均购于大连TaKaRa公司;T100 Thermal Cycler 和C1000 Thermal Cycler购于美国Bio-Rad公司;其他常规试剂与耗材均购自于生工生物工程(上海)股份有限公司。
1.3 总RNA提取和cDNA合成
使用HP Total RNA Kit(Omega Bio-Tek,GA,USA)提取4龄若虫总RNA,操作步骤按照试剂盒说明书进行。RNA的纯度和质量分别用NanoDrop 2000紫外分光光度计(Thermo Fisher,MA,USA)和1%琼脂糖凝胶电泳进行检测。以提取的九香虫总RNA为模板,用RevertAid First Strand cDNA Synthesis Kit(Thermo Fisher,MA,USA)反转录合成cDNA,根据说明书进行操作。
1.4 九香虫溶菌酶基因克隆
根据九香虫全长转录组数据中注释的溶菌酶基因序列,用Primer Premier 6.0设计PCR引物,由生工生物工程(上海)有限公司合成(表1)。在T100 Thermal Cycler(Bio-Rad,CA,USA)上进行反转录PCR(RT-PCR)。PCR反应体系为50 μL:25 μL 2× TsingKe Master Mix(北京擎科生物公司),2 μL cDNA模板,上、下游引物(10 μM)各1 μL,补加21 μL灭菌超纯水。 反应条件: 94℃预变性3 min;94℃变性30 s,53℃退火30 s,72℃延伸1 min,共進行30个循环;72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测后送生工生物工程(上海)有限公司进行测序,测得的序列用BLAST在NCBI的Nr蛋白数据库中进行比对。
1.5 生物信息学分析
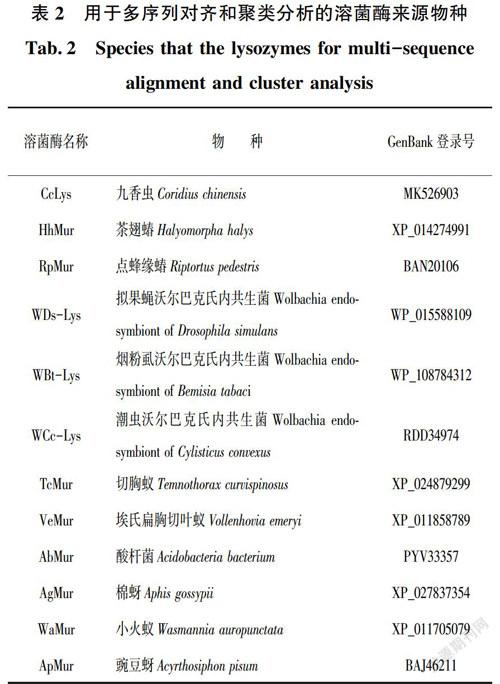
CcLys 基因的编码区用NCBI ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)进行预测,用ProtParam(https://web.expasy.org/protparam/)对编码的蛋白质进行分子量和等电点预测。采用SignalP 4.1 Server(http:www.cbs.dtu.dk/services/SignalP/)分析预测信号肽,用NetOGlyc 4.0 Server (http://www.cbs.dtu.dk/services/NetOGlyc/)和NetNGlyc 1.0 Server(http://www.cbs.dtu.dk/services/NetNGlyc/)预测糖基化位,用KinasePhos(http://kinasephos.mbc.nctu.edu.tw/)预测磷酸化位点。用MEGA-X和GeneDoc 2.7将CcLys氨基酸序列与其他11种来自昆虫和细菌的溶菌酶氨基酸序列进行对齐分析;使用MEGA-X进行聚类分析。用于多序列对齐和聚类分析的溶菌酶来源物种及GenBank登录号列于表2中。使用 SWISS-MODEL(https://swissmodel.expasy.org/)的同源建模方法预测成熟CcLys酶蛋白的三维结构,用PyMOL 1.4绘制其分子结构图。
1.6 基因表达谱分析
用实时荧光定量PCR(RT-qPCR)分析在九香虫不同发育时期、成虫的不同组织及成虫免疫后不同时间溶菌酶 CcLys 基因的表达模式。用金黄色葡萄球菌( Staphylocous aureus )和大肠杆菌( E. coli )的等量混合物分别对20只健康的成虫进行腹部注射,分别在3、6、12、24、36和48 h收集存活的成虫样品。提取这些样品的总RNA,反转录成cDNA,然后在C1000 Thermal Cycler(Bio-Rad,CA,USA)上进行RT-qPCR。反应体系为20 μL:1 μL cDNA模板,上、下游引物(20 mM)各1 μL,10 μL 2× SYBR Select Master Mix(Thermo Fisher,MA,USA),补加7 μL 无RNA酶的灭菌超纯水。反应条件:50℃,2 min;95℃,2 min;95℃变性15,58℃退火15,72℃延伸1 min,共40个循环。用九香虫 β-actin 基因(GenBank登录号:MK370101)作内参对照,相关的引物列于表1。用2 -ΔΔCt方法分析 CcLys 的mRNA表达水平,每个样本进行3次重复实验。
1.7 数据统计与分析
数据以平均值±标准差表示,采用SPSS 22统计软件方差分析(ANOVA)的邓肯氏新复极差法(Duncan’s test)进行多重检验,显著性检验水平为 P < 0.05。
2 结果与分析
2.1 CcLys 的cDNA克隆
以4龄若虫总RNA为模板经RT-PCR扩增得到九香虫溶菌酶基因 CcLys 的cDNA(GenBank登录号:MK526903)。该cDNA长883 bp,包含一个长669 核苷酸(nt)的开放阅读框,编码222个氨基酸;5端有66 nt的非编码区(UTR),3端有148 nt的UTR。该溶菌酶CcLys的N端具有一段由18个氨基酸组成的信号肽(图1)。
2.2 CcLys特征分析
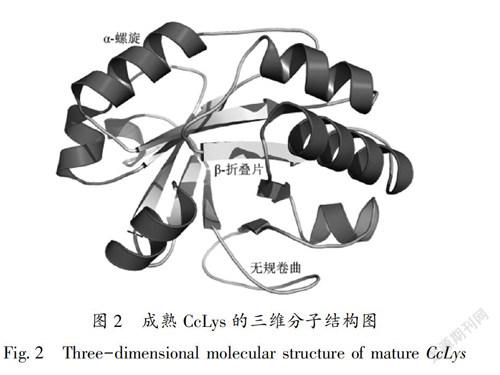
CcLys酶蛋白的分子式为C1121H1718N310O331S7,分子量为25.06 kDa,理论等电点为7.7。该酶蛋白在N209具有N-糖基化位点,无O-糖基化位点,有7个磷酸化位点(S16、T52、Y57、T67、S167、S168和S211)。BLAST分析表明,CcLys含有糖基水解酶25家族(GH25)催化结构域。同源建模分析显示,成熟CcLys的三维分子结构包括7个α-螺旋,8个β-折叠片,15个无规卷曲(图2)。
2.3 同源性比较与聚类树
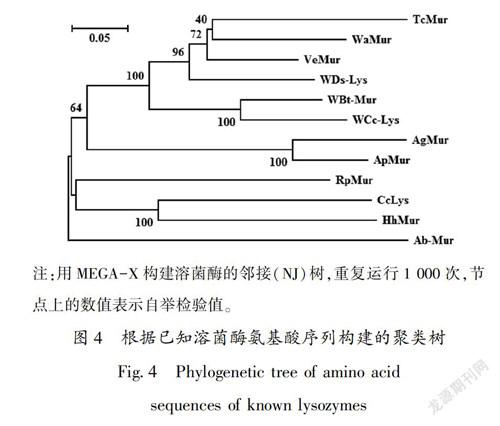
将CcLys氨基酸序列在NCBI的蛋白质数据库中进行比对,结果显示该溶菌酶与茶翅蝽、点蜂缘蝽和拟果蝇沃尔巴克氏内共生菌的溶菌酶氨基酸序列分别具有61%、52%和52%的相似性。CcLys氨基酸序列与来自于7种昆虫和4种细菌的溶菌酶氨基酸进行对齐,结果显示他们都具有保守的谷氨酸(E)、天冬氨酸(D)和色氨酸(W),这3种氨基酸是溶菌酶活性中心的必需基团;具有DXE保守序列(图3)。系统进化树显示,CcLys与茶翅蝽溶菌酶首先聚为一支,再与点蜂缘蝽溶菌酶聚为一支;棉蚜与豌豆蚜的溶菌酶聚为一支;3种蚂蚁溶菌酶聚为一支,再与拟果蝇沃尔巴克氏内共生菌的溶菌酶聚为一支;来自烟粉虱和潮虫的沃尔巴克氏内共生菌溶菌酶聚为一支(图4)。同源性比较和聚类分析表明,九香虫溶菌酶与茶翅蝽溶菌酶的亲缘关系最近。
2.4 CcLys 基因表达模式
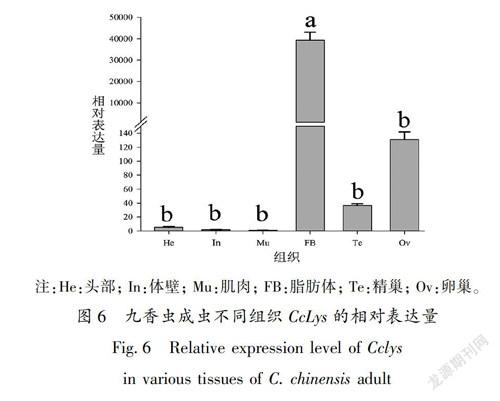
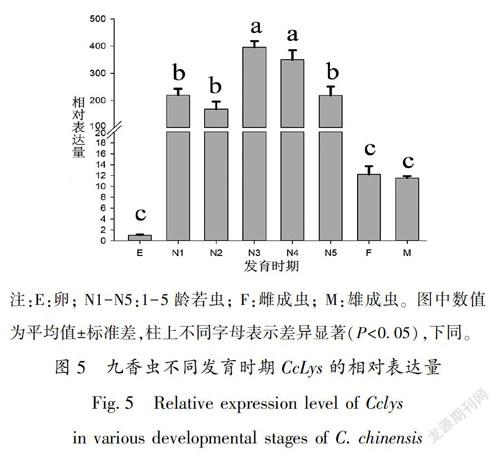
RT-qPCR分析显示, CcLys 在九香虫的所有发育17阶段都有表达,在若虫期的表达水平较高,在成虫的表达水平次之,在卵中的表达水平最低;在3龄若虫中的表达水平最高,是成虫的33倍、卵的395倍(图5)。该基因在所检测的成虫组织中都有表达,在脂肪体中的表达水平最高,在肌肉中的
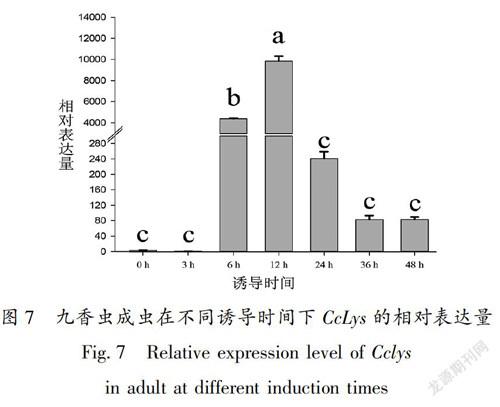
表达最低;表达水平从高到低的组织依次是:脂肪体>卵巢>精巢>头部>体壁>肌肉,在脂肪体中的表达水平是在肌肉中的39304倍(图6)。九香虫成虫在被大肠杆菌和金黄色葡萄球菌混合菌液刺激后, CcLys 表达先下调然后上调,在12 h达到峰值,之后又下降;在36 h和48 h表达水平没有变化。 CcLys 基因在诱导后12 h的表达水平是诱导前的2455倍,是诱导后3 h的9676倍(图7)。
3 结论与讨论
溶菌酶是一种抗菌酶,是昆虫先天免疫系统的一部分。它是一种糖苷水解酶,水解两种或多种碳水化合物之间或碳水化合物和非碳水化合物之间的糖苷键。基于序列相似性的糖基水解酶分类系统已经定义了85个不同的家族[17]。糖苷水解酶第25 家族(GH25)僅包含一种具有已知活性的酶,该酶主要水解肽聚糖中N-乙酰胞壁酸和N-乙酰-D-氨基葡萄糖残基间及壳聚糖中N-乙酰-D-氨基葡萄糖残基间的β-1,4-糖苷键。许多细胞壁裂解酶是共同进化的,可以归为一个家族[18-19]。Glu和Asp两个残基对溶菌酶的催化活性极其重要,这些残基以及它们附近的一些其他残基在这个家族的所有蛋白质成员中都是保守的[20]。GH25家族溶菌酶都含有一段DXE保守序列,该功能域负责识别和切断β-l,4-糖苷键。CcLys含有GH25家族溶菌酶高度保守的Glu和Asp这两个必需基团,且都位于DXE基序之中,这对于九香虫溶菌酶发挥催化功能具有重要作用。
Martinez-Fleites等[21]通过研究炭疽杆菌的GH25溶菌酶的结构,发现这个家族的溶菌酶采用类似于桶状折叠片层的(α/β)5(β)3二级结构。GH25溶菌酶的活性中心与同属糖苷水解酶家族的GH18、GH20、GH56、GH84和GH85的活性中心极其相似,这意味着GH25溶菌酶很可能保留这一“超级家族”常见的异头物构型,并使用相同的邻位催化机制。Korczynska等[22]测定了烟曲霉中GH25溶菌酶的X射线结构,第一次研究真菌中GH家族溶菌酶的结构,改进了α/β桶状折叠片层模型,8个β-折叠桶两侧围绕3个α-螺旋。活性位点位于这个模型带负电的口袋底部,其构型与GH25和相关GH家族的其他成员已揭示的结构有很多相似之处。这些研究证实了糖苷水解酶家族通过“酶催化物辅助”催化机制起作用的观点[23-24]。预测的成熟CcLys的三级结构由8个β-折叠片层形成桶状构型,7个α-螺旋围绕在桶周围,与GH25溶菌酶具有类似的结构。
同源性比较和聚类分析显示,CcLys与茶翅蝽溶菌酶的亲缘关系最近,然而人们对这个酶的特征了解得较少;CcLys与其他已知昆虫的C型和I型溶菌酶的相似性低[25-28],因此,我们还无法判断CcLys属于哪一类溶菌酶,需要进一步研究。 CcLys 基因在九香虫的整个生活史中均有表达,表明它在九香虫的生长发育过程中起着重要的作用。基因表达分析显示 CcLys 在九香虫脂肪体表达水平高,昆虫脂肪体是昆虫体内一种非常重要的器官,类似于高等动物的肝脏。脂肪体既是糖類、脂类和蛋白质代谢的中心,又是昆虫对激素和外源化合物进行降解和解毒代谢的重要组织。
该研究从九香虫中克隆了一种溶菌酶 CcLys 基因,并进行了特征分析,为进一步明确该基因的功能、开发新型抗菌药物及深度开发利用九香虫资源奠定了基础。
参 考 文 献:
[1] 初 源,周 帆,张明明,等. 昆虫天然免疫反应研究前沿 [J].应用昆虫学报,2013,50(2):311-320.
[2] Callewaert L,Michiels CW. Lysozymes in the animal kingdom [J]. Journal of Biosciences ,2010,35(1):127-160.
[3] Dobson DE,Prager EM,Wilson AC. Stomach lysozymes of ruminants [J]. The Journal of Biological Chemistry ,1984,259(18):11617-11625.
[4] 朱元镇,刘婧仪,于常红.溶菌酶的研究进展及应用 [J].山东医学高等专科学校学报,2018,40(3):207-210.
[5] 尹金凤. 溶菌酶对大肠杆菌的抗菌作用机制及其增效技术的研究[D].无锡:江南大学,2011:1-41.
[6] Jolles P,Jolles J. What’s new in lysozyme research [J].Molecular and Cellular Biochemistry,1984,63(2):165-189.
[7] Buonocore F,Randelli E,Trisolino P, et al. Innate immunity in sea bass (Dicentrarchus labrax L.):Molecular characterization,expression and 3D structural analysis and antibacterial activity of a G-type lysozyme [J]. Fish & Shellfish Immunology ,2013,34(6):1697-1698.
[8] 刘 梅,张士璀. 溶菌酶C及其生物学功能 [J].生命的化学,2006,26(5):465-467.
[9] Sanz JM,García P,García JL. Role of Asp-9 and Glu-36 in the active site of the pneumococcal CPL1 lysozyme:an evolutionary perspective of lysozyme mechanism [J]. Biochemistry ,1992,31(36):8495-8499.
[10] 张 颖,陈建伟,高 源. 九香虫资源鉴定、化学、药理与药食应用研究[J].亚太传统医药,2009,5(9):44-47.
[11] 魏 超,舒国周,罗会嵩,等. 九香虫的形态特征和生物学特性[J].山地农业生物学报,2015,34(4):26-30.
[12] 姚银花. 九香虫的生物学特性及其应用价值[J].黔东南民族师范高等专科学校学报,2006,24(6):48-49.
[13] 郭玉红,张庆林. 药食昆虫九香虫的生物学及开发利用研究进展[J].时珍国医国药,2015,26(3):692-693.
[14] 国家中医药管理局中华本草编委会. 中华本草(第9册)[M].上海:上海科学技术出版社,1999:173-174.
[15] 吴玛莉,金道超. 九香虫血淋巴及其纯化蛋白抑菌活性的研究[J].应用昆虫学报,2005,42(3):315-318.
[16] 李尚伟,赵柏松,杜 娟. 九香虫抗菌肽CcAMP1的分离纯化和抗菌活性检测[J].昆虫学报,2015,58(6):610-616.
[17] Henrissat B,Callebaut I,Fabrega S, et al. Conserved catalytic machinery and the prediction of a common fold for several families of glycosyl hydrolases [J]. Proceedings of the National Academy of Sciences of the United States of America ,1995,92(15):7090-7094.
[18] Croux C,García JL. Sequence of the lye gene encoding the autolytic lysozyme of Clostridium acetobutylicum ATCC824:comparison with other lytic enzymes [J]. Gene ,1991,104(1):25-31.
[19] Henrissat B. A classification of glycosyl hydrolases based on amino acid sequence similarities [J]. Biochemical Journal ,1991,280(Pt 2):309-316.
[20] Fouche PB,Hash JH. The N,O-diacetylmuramidase of Chalaropsis species. Identificaiton of aspartyl and glutamyl residues in the active site [J]. Journal of Biological Chemistry ,1978,253(19):6787-6793.
[21] Martinez-Fleites C,Korczynska JE,Davies GJ, et al. The crystal structure of a family GH25 lysozyme from Bacillus anthracis implies a neighboring-group catalytic mechanism with retention of anomeric configuration [J]. Carbohydrate Research ,2009,344(13):1753-1757.
[22] Korczynska JE,Danielsen S,Schagerlof U, et al. The structure of a family GH25 lysozyme from Aspergillus fumigatus [J]. Acta Crystallographica Section F ,2010,66(Pt 9):973-977.
[23] Weaver LH,Grütter MG,Remington SJ, et al. Comparison of goose-type,chicken-type,and phage-type lysozymes illustrates the changes that occur in both amino acid sequence and three-dimensional structure during evolution [J]. Journal of Molecular Evolution ,1985,21(2):97-111.
[24] Abbott DW,Macauley MS,Vocadlo DJ, et al. Streptococcus pneumoniae endohexosaminidase D,structural and mechanistic insight into substrate-assisted catalysis in family 85 glycoside hydrolases [J]. Journal of Biological Chemistry ,2009,284(17):11676-11689.
[25] Bachali S,Jager M,Hassanin A, et al. Phylogenetic analysis of invertebrate lysozymes and the evolution of lysozyme function [J]. Journal of Molecular Evolution ,2002,54(5):652-664.
[26] 張 波,王林美,叶 博,等. 柞蚕溶菌酶基因的克隆和序列分析[J].蚕业科学,2009,35(3):539-546.
[27] 于 洁,王登杰,雷仲仁,等. 烟粉虱溶菌酶基因的鉴定及表达分析[J].中国农业科学,2016,49(13):2534-2543.
[28] 张元臣,刘向东. 棉蚜溶菌酶基因 AgLYS 的克隆与表达分析[J].昆虫学报,2017,60(2):127-135.

