右美托咪定对脑膜瘤切除术病人血清BDNF影响
郭海燕 李琳章 李淑虹 刘茂东 杨峰云 王士雷
[摘要]目的 探讨负荷剂量右美托咪定对脑膜瘤切除术病人血清脑源性神经营养因子(BDNF)含量及血流动力学参数的影响。方法 将40例择期行脑膜瘤切除术病人采用随机数字表法随机分为对照组(C组)和右美托咪定组(D组),每组20例。D组病人于麻醉诱导前10 min静脉泵注右美托咪定1 μg/kg,20 min注射完毕;C组病人静脉泵注等容量生理盐水。记录病人术前和术后24 h的简易精神状态量表(MMSE)评分;记录所有病人入手术室后(T0)、诱导前即刻(T1)、插管后1 min(T2)、手术开始时(T3)、打开硬脑膜时(T4)、术毕即刻(T5)、术后10 min(T6)的平均动脉压(MAP)及心率;分别于T0、T3、T4、T5、术后18 h(T7)采集静脉血,测定血清中的BDNF含量。结果 C组病人术后MMSE评分显著低于术前(t=2.33,P<0.05),而D组病人术前、术后MMSE评分比较差异无显著意义(P>0.05)。D组病人T3~T6时的MAP和心率较T0时显著降低(F=5.93、7.72,P<0.01),且在T2时显著低于C组(t=2.60、4.26,P<0.05)。D组病人T3、T5时的血清BDNF含量显著高于C组(t=2.22、2.34,P<0.05)。结论 负荷剂量右美托咪定可以减小脑膜瘤切除术中血清BDNF的波动,有利于维持病人围手术期血流动力学参数平稳,具有一定的脑保护作用。
[关键词]右美托咪定;脑膜瘤;脑源性神经营养因子;神经保护
[中图分类号]R614;R971.3
[文献标志码]A
[文章编号] 2096-5532(2019)05-0590-05
doi:10.11712/jms201905021
[开放科学(资源服务)标识码(OSID)]
脑膜瘤是临床常见的颅内肿瘤,占所有脑肿瘤的25%~33%[1]。手术切除是治疗脑膜瘤的主要方法,但手术过程中脑组织会受到各种形式的损伤[2],如皮质切开[3]、牵开器的牵拉、术中出血[4]、电凝的热损伤等。颅脑手术病人的围手术期脑保护是神经外科医师和麻醉科医师共同關注的重点之一。盐酸右美托咪定是高选择性高特异性的新型α2受体激动剂,具有镇静、镇痛、稳定血流动力学、抑制交感神经活性、脏器保护等作用,现已广泛应用于临床[5]。
有Meta分析表明,右美托咪定应用于颅脑手术可以降低病人术中血压及心率的变化[6]。同时,有多项动物实验证明了右美托咪定的脑保护作用[7-8]。本研究旨在探讨右美托咪定对脑膜瘤切除术病人简易精神状态量表(MMSE)评分、血清脑源性神经营养因子(BDNF)含量及血流动力学参数影响,为右美托咪定在脑膜瘤切除术病人中的应用提供参考。
1 资料与方法
1.1 一般资料
选取2016年1—8月在我院行择期脑膜瘤切除术的病人40例,病人均为女性,年龄50~70岁,体质量指数(BMI)20~30 kg/m2,ASA Ⅱ级;脑膜瘤的最大直径为20~40 mm,均为大脑凸面脑膜瘤;预计手术时间2~4 h。排除标准:基础心率小于60 min-1者,有乙醇或药物滥用者,有精神疾病者,有内分泌系统疾病者,心、肺、肝、肾功能异常者。采用随机数字表法将病人随机分为右美托咪定组(D组)和对照组(C组),每组20例。本研究已通过我院伦理委员会的审批,已在中国临床试验注册中心注册(注册号ChiCTR-IPR-15006498),病人均签署知情同意书。
1.2 麻醉方法
所有病人术前常规禁饮禁食8 h,手术前1 h肌肉注射苯巴比妥0.1 g、东莨菪碱0.3 mg。入手术室后,常规监测心电图(ECG)、血压和血氧饱和度(SpO2),足背动脉穿刺置管,监测有创动脉血压。每例病人开放两条静脉通路,一条用于补液、麻醉用药,一条用于收集血液标本。麻醉诱导前10 min,D组病人静脉泵注右美托咪定(1支规格为200 μg/2 mL的原液用生理盐水稀释至4 mg/L)1 μg/kg,于20 min内注射完毕,C组病人以相同速度泵注等容量的生理盐水。静脉推注丙泊酚1~2 mg/kg、盐酸咪达唑仑0.05 mg/kg、枸橼酸舒芬太尼0.3 μg/kg、顺苯磺酸阿曲库铵0.2 mg/kg进行麻醉诱导。3~5 min后行气管插管,连接麻醉机行机械通气,麻醉机参数设置:潮气量 8~10 mL/kg,呼吸频率为10~14 min-1,呼气末二氧化碳分压(PETCO2)3.99~4.52 kPa。麻醉维持:顺苯磺酸阿曲库铵0.15 mg·kg-1·h-1、丙泊酚4~7 mg·kg-1·h-1,间断追加舒芬太尼。术中使麻醉意识指数(IoC)维持在40~59之间,根据IoC调节舒芬太尼和丙泊酚的用量。手术时间小于2 h或大于4 h者、术中失血量大于800 mL或围手术期有输血者退出本研究。
1.3 观察指标
记录所有病人术前24 h和术后24 h的MMSE评分。记录所有病人入手术室后(T0)、诱导前即刻(T1)、插管后1 min(T2)、手术开始时(T3)、打开硬脑膜时(T4)、术毕即刻(T5)、术后10 min(T6)的MAP及心率。分别于T0、T3、T4、T5、术后18 h(T7)采集静脉血5 mL,注入真空分离胶管中,于室温下静置1 h后,以3 000 r/min离心10 min,取上清液约1 mL放入EP管中,置于-80 ℃的冰箱中待测。采用酶联免疫吸附试验(ELISA)法(试剂盒购自优尔生公司)测定血清中BDNF的含量。
1.4 统计分析
采用SPSS 21.0软件进行统计学分析。计量资料结果以[AKx-D]±s的形式表示,两组病人的一般资料和MMSE评分比较采用t检验,心率、平均动脉压(MAP)以及血清BDNF含量的比较采用重复测量方差分析和Bonferroni检验。以P<0.05表示差异有统计学意义。
2 结果
D组1例病人因术后病理结果与术前诊断不一致退出本次试验,C组1例病人因血液样本发生溶血退出本次试验。D组1例病人术中因心率低于50 min-1,静脉给予阿托品0.3 mg后心率逐渐恢复正常。两组病人均未发生不可控制的高血压、低血压或严重的心律失常。
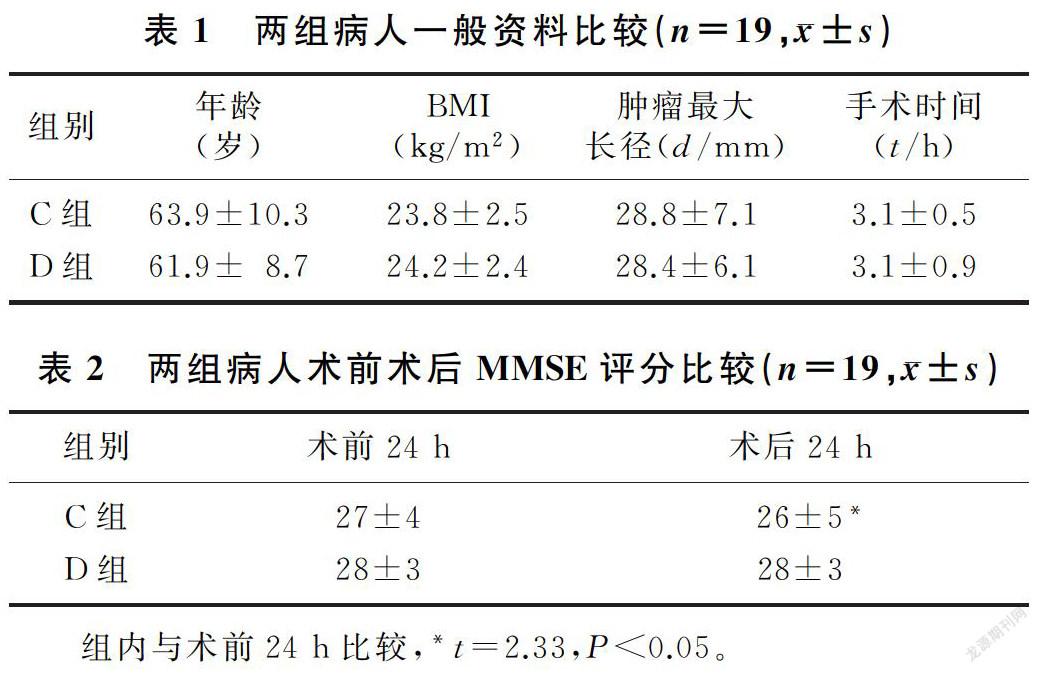
2.1 两组一般资料比较
两组病人一般资料比较,差异无统计学意义(P>0.05)。见表1。
2.2 两组MMSE评分比较
C组病人术后MMSE评分显著低于术前(t=2.33,P<0.05),而D组病人术前、术后MMSE评分比较差异无统计学意义(P>0.05);两组病人术后MMSE评分比较差异无统计学意义(P>0.05)。见表2。
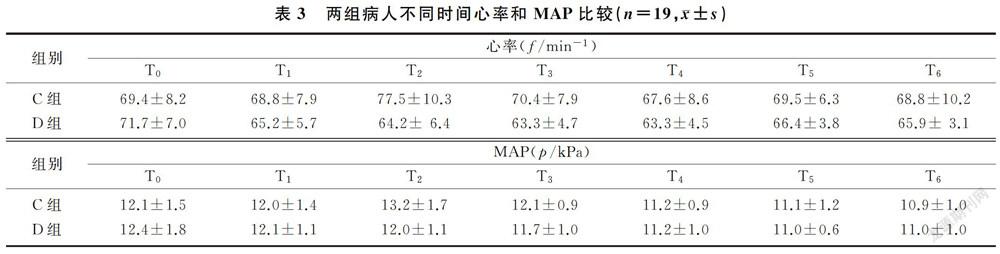
2.3 两组围手术期血流动力学参数变化
两组间心率比较差异有统计学意义(F=8.89,P<0.01),组内不同时间心率比较差异有统计学意义(F=4.70,P<0.01),时间与组间存在交互效应(F=6.65,P<0.01)。D组病人T1~T6时的心率均显著低于T0时(F=5.93,P<0.01),C组病人T2时的心率则显著高于T0时(F=52.30,P<0.01)。D组围手术期心率的变化更平稳,且在T2和T3时均明显低于C组(t=2.60、7.05,P<0.05)。两组间MAP比较差异有统计学意义(F=9.60,P<0.01),组内不同时间MAP比较差异具有显著意义(F=23.71,P<0.01),时间与组间存在交互效应(F=3.66,P<0.05)。C组病人T2时的MAP明显高于T0时,而T4~T6时的MAP则显著低于T0时(F=16.63,P<0.01);D组病人T3~T6时的MAP显著低于T0时(F=7.72,P<0.01)。在T0时两组病人的MAP比较差异无统计学意义(P>0.05),在T2时D组明显低于C组(t=4.26,P<0.05)。见表3。
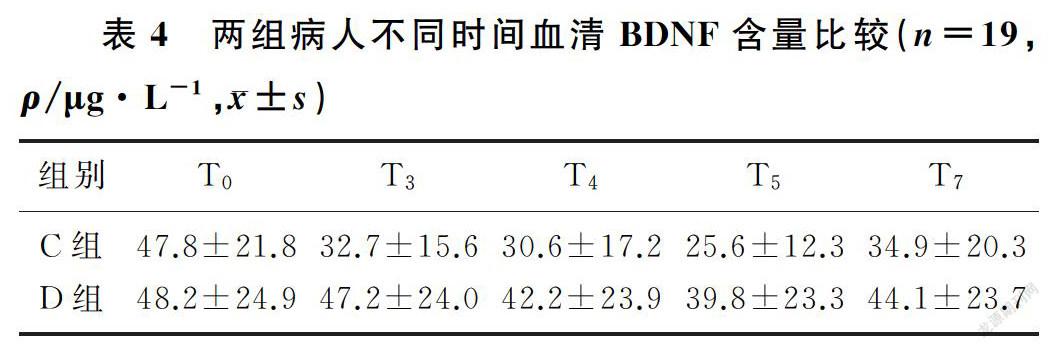
2.4 两组不同时间血清BDNF含量的比较
两组间血清BDNF含量比较差异无统计学意义(F=2.41,P>0.05),不同时间血清BDNF含量比较差异具有统计学意义(F=18.73,P<0.01),时间与组间存在交互效应(F=4.89,P<0.01)。C组病人T3~T7时的血清BDNF含量显著低于T0时(F=5.94,P<0.01);D组病人在T4、T5时的血清BDNF含量显著低于T0时(F=3.83,P<0.05)。两组血清BDNF含量均在T5时最低。在T3、T5时D组血清BDNF含量均高于C组,差异具有统计学意义(t=2.22、2.34,P<0.05)。见表4。
3 讨论
BDNF是一种在脑内合成、主要存在于中枢神经系统的促生长神经营养蛋白,与神经元的生长和发育有关[9]。血液中的BDNF可通过转运系统穿过血-脑脊液屏障进入脑组织,脑组织中的BDNF也可以通过脑脊液非特异性重吸收释放入血,血液中BDNF的含量与脑组织中的含量是密切相关的[10]。既往研究表明,右美托咪定通过增加体内和体外BDNF的表达发挥脑保护作用[11-12],右美托咪定可以增加非颅脑手术病人血浆中BDNF的含量[13]。然而,右美托咪定对颅脑手术病人BDNF的影响却鲜有报道。早期的动物实验发现,麻醉药可以抑制皮质神经元释放BDNF[14]。一项临床前期研究也表明,部分麻醉药具有潜在的神经毒性作用[15]。本文的研究结果显示,C组病人麻醉诱导后20 min时的血清BDNF含量显著降低,与有关研究结果相一致[15-16]。虽然引起BDNF变化的具体原因和机制不详,但D组BDNF的含量变化表明,诱导前静脉输注右美托咪定可以减小血清BNDF的波动,从而起到神经保护的作用。右美托咪定可以增加脑脊液的生成或重吸收,促进脑组织中的BNDF释放入血,抑制血液中的BDNF透过血-脑脊液屏障回流入脑组织。由于BNDF主要由脑组织生成,并且主要存在于脑组织中,故我们推测,脑膜瘤切除术中的手术操作可能影响血清BDNF含量。本研究结果显示,术毕时血清中的BDNF含量两组均降至最低。这种变化可能是由于手术操作对脑组织的损伤造成的,也可能是由于麻醉药物连续使用引起的,具体原因仍需进一步研究。术后18 h两组血清BDNF含量均较术毕时有所上升,这可能与脑组织的修复或麻醉药物的代谢有关。总体上,D组血清BDNF含量在T3、T5时显著高于C组,提示脑膜瘤切除术病人在麻醉誘导前静脉输注1 μg/kg的右美托咪定可以增加BNDF 含量从而起到脑保护作用。
术后认知功能障碍(POCD)是一种由手术、麻醉或者创伤引起的并发症[17]。MMSE评分简便易操作,在临床上常被用于认知功能障碍的辅助诊断[18]。本研究结果显示,C组病人术后24 h的MMSE评分较术前明显下降,而D组病人术前术后的MMSE评分差异无统计学意义,表明术前应用右美托咪定可以降低脑膜瘤病人围手术期MMSE评分变化,从而减少POCD的发生,有利于病人的预后。KORLEY等[19]研究表明,血清BDNF含量可作为脑损伤诊断和预后判断的参考指标。由于本文两组病人的围手术期MMSE评分变化趋势与血清BDNF含量变化趋势相似,因此我们推测,脑膜瘤切除术病人术后MMSE评分可能与血清BDNF含量相关,但是两者之间的具体关系以及两者是否可作为脑损伤诊断和预后判断的参考指标仍需进一步研究证明。
有研究表明,神经外科手术病人在麻醉诱导前静脉输注负荷剂量的右美托咪定,头架放置的过程中血流动力学会更加平稳[20]。行幕上肿瘤切除的病人术中持续输注右美托咪定有利于维持血流动力学稳定[21]。本研究结果显示,C组病人在插管后1 min心率和MAP均显著升高,而D组病人未见明显变化;D组病人术中的心率和MAP均低于麻醉诱导前的基础值,且低于同时间的C组病人。表明右美托咪定可以减轻插管时的血流动力学参数波动,降低脑膜瘤切除术病人术中的心率和血压。TANSKANEN等[22]研究发现,适当地降低心率和MAP可以降低手术病人的颅内压从而改善预后。本文D组病人围手术期相对平稳的血流动力学变化可能也是其术后MMSE评分较高的原因之一。
綜上所述,术前静脉输注负荷剂量右美托咪定可以增加脑膜瘤切除术病人围手术期血清中BDNF含量和术后24 h的MMSE评分,有利于维持病人围手术期的血流动力学参数平稳,对行脑膜瘤切除术的病人是有利的,但其具体作用机制以及对远期脑功能的影响还需进一步研究。
[参考文献]
[1]JENKINSON M D, JAVADPOUR M, HAYLOCK B J, et al. The ROAM/EORTC-1308 trial: radiation versus observation following surgical resection of atypical meningioma: study protocol for a randomised controlled trial[J]. Trials, 2015,16:519-525.
[2]JADHAV V, SOLAROGLU I, OBENAUS A, et al. Neuroprotection against surgically induced brain injury[J]. Surgical Neurology, 2007,67(1):15-20.
[3]SOLAROGLU I, BESKONAKLI E, KAPTANOGLU E, et al. Transcortical-transventricular approach in colloid cysts of the third ventricle:surgical experience with 26 cases[J]. Neurosurg Rev, 2004,27(2):89-92.
[4]HELLWIG D, BERTALANFFY H, BAUER B L, et al. Pontine hemorrhage[J]. Neurosurg, 2003,99(4):796-797.
[5]IHMSEN H, DEXMEDETOMIDINE S T. Pharmacokinetics and pharmacodynamics[J]. Der Anaesthesist, 2012,61(12):1059-1066.
[6]WANG Wenjie, LU Houqing, SUN Gengyun. Effects of dexmedetomidine on outcomes following craniocerebral operation-a meta-analysis[J]. Clinical Neurology and Neurosurgery, 2014,125:194-197.
[7]MA D Q, HOSSAIN M, RAJAKUMARASWAMY N, et al. Dexmedetomidine produces its neuroprotective effect via the alpha2A-adrenoceptor subtype[J]. European Journal of Pharmacology, 2004,502(1/2):87-97.
[8]ESER O, FIDAN H, SAHIN O, et al. The influence of dexmedetomidine on ischemic rat hippocampus[J]. Brain Research, 2008,1218:250-256.
[9]PILAKKA-KANTHIKEEL S, ATLURI V S, SAGAR V, et al. Targeted brain derived neurotropic factors (BDNF) delivery across the blood-brain barrier for neuro-protection using magnetic nano carriers:an in-vitro study[J]. PLoS One, 2013,8(4):e62241.
[10]PAN W H, BANKS W A, FASOLD M B, et al. Transport of brain-derived neurotrophic factor across the blood-brain barrier[J]. Neuropharmacology, 1998,37(12):1553-1561.
[11]DEGOS V, CHARPENTIER T L, CHHOR V, et al. Neuroprotective effects of dexmedetomidine against glutamate agonist-induced neuronal cell death are related to increased astrocyte brain-derived neurotrophic factor expression[J]. Anesthesiology, 2013,118(5):1123-1132.
[12]SHIN M K, KIM H G, KIM K L. A novel brain-derived neurotrophic factor-modulating peptide attenuates Abeta(1-42)-induced neurotoxicity in vitro[J]. Neuroscience Letters, 2015,595:63-68.
[13]YANG Lin, XU Junmei, JIANG Xinghua, et al. Effect of dexmedetomidine on plasma brain-derived neurotrophic factor:a double-blind, randomized and placebo-controlled study[J]. Upsala Journal of Medical Sciences, 2013,118(4):235-239.
[14]GOGGI J, PULLAR I A, CARNEY S L, et al. The control of [125I]BDNF release from striatal rat brain slices[J]. Brain Research, 2003,967(1/2):201-209.
[15]VLISIDES P, XIE Z C. Neurotoxicity of general anesthetics:an update[J]. Current Pharmaceutical Design, 2012,18(38):6232-6240.patients undergoing minor surgery:a randomized controlled trial[J]. Neurochemical Research, 2008,33(7):1325-1331.
[17]TERRANDO N, BRZEZINSKI M, DEGOS V, et al. Perio-perative cognitive decline in the aging population[J]. Mayo Cli-nic Proceedings, 2011,86(9):885-893.
[18]FOLSTEIN M F, FOLSTEIN S E, MCHUGH P R. “Mini-mental state” a practical method for grading the cognitive state of patients for the clinician[J]. Journal of Psychiatric Research, 1975,12(3):189-198.
[19]KORLEY F K, DIAZ-ARRASTIA R, WU A H, et al. Circulating brain-derived neurotrophic factor has diagnostic and prognostic value in traumatic brain injury[J]. Journal of Neurotrauma, 2016,33(2):215-225.
[20]UYAR A S, YAGMURDUR H, FIDAN Y, et al. Dexmedetomidine attenuates the hemodynamic and neuroendocrinal responses to skull-pin head-holder application during craniotomy[J]. Journal of Neurosurgical Anesthesiology, 2008,20(3):174-179.
[21]SOLIMAN R N, HASSAN A R, RASHWAN A M, et al. Prospective, randomized controlled study to assess the role of dexmedetomidine in patients with supratentorial tumors undergoing craniotomy under general anesthesia[J]. Middle East Journal of Anaesthesiology, 2011,21(1):23-33.
[22]TANSKANEN P E, KYTT J V, RANDELL T T, et al. Dexmedetomidine as an anaesthetic adjuvant in patients undergoing intracranial tumour surgery:a double-blind, randomized and placebo-controlled study[J]. British Journal of Anaesthe-sia, 2006,97(5):658-665.
(本文編辑 马伟平)

