桂花萜烯合酶(TPS)的生物信息学与原核表达分析
曾祥玲 邹晶晶 王彩云







摘 要:揮发性萜烯类化合物是植物花和果实中重要的香气活性物质,萜烯合酶(TPS)的种类和功能决定物种中萜烯类物质的多样性。桂花作为重要的香花植物,萜烯类物质是其花香的重要成分,但有关桂花萜烯合酶的研究却并不多。为揭示桂花萜烯类物质的生物合成机理,该研究利用生物信息学分析了4个TPS蛋白的理化性质、亚细胞定位及其结构,在原核表达系统中进行4个TPS蛋白的体外表达,并对可溶性的TPS4重组蛋白进行了体外酶反应功能分析。结果表明:(1)4个TPS蛋白的理化性质差异较小,但仅有TPS4蛋白定位于其他靶向,不含信号肽,延伸链的比例较低,在靠近氨基端的区域内不含延伸链。(2)4个TPS蛋白在原核系统中均可成功表达,但仅有TPS4获得了可溶性重组蛋白。(3)将纯化的TPS4重组蛋白分别与GPP、NDP和FPP进行反应,均只检测到一种产物,分别为反式-β-罗勒烯、β-水芹烯和α-法呢烯。这为揭示植物萜烯类物质生物合成的分子机理提供了参考,对从蛋白水平研究桂花花香基因功能奠定了基础。
关键词: 桂花, 萜烯合酶, 原核表达, 花香
中图分类号:Q943
文献标识码:A
文章编号:1000-3142(2019)05-0624-09
Bioinformatic and prokaryotic expression analysis ofterpene synthase (TPS) from Osmanthus fragrans
ZENG Xiangling1,2, ZOU Jingjing1,2, WANG Caiyun2*
( 1. School of Nuclear Technology and Chemistry & Biology, Hubei University of Science and Technology, Xianning 437100, Hubei, China;2. Key Laboratory for Biology of Horticultural Plants, Ministry of Education, Huazhong Agricultural University, Wuhan 430070, China )
Abstract:Volatile terpenes are important aroma active compounds in flowers and fruits of plant. Diversities of terpenes are usually determined by type and function of terpene synthase in different species. Osmanthus fragransis an important fragrant plant, in which terpenes are the important components of floral scent. But there are few studies on terpene synthase in O. fragrans. To reveal the biosynthesis mechanism of terpenes inO. fragrans,we predicted the physicochemical properties, subcellular localization and structure of four TPS proteins by bioinformatics, and expressed them in prokaryotic expression system. Finally, the function of soluble TPS4 recombinant protein was analyzed by enzyme reaction in vitro. The results were as follows: (1) The physicochemical properties of the four TPS proteins had relatively little difference. Only TPS4 protein locating in other targets without signal peptide had low proportional extended strand and no extended strand near amidogen terminal. (2) All of the four TPS proteins were successfully expressed in prokaryotic system, but only TPS4 obtained soluble recombinant protein. (3) The purified TPS4 recombinant protein was reacted with GPP, NDP and FPP respectively, and only one product (trans-β-ocimene, β-phellandrene and α-farnesene) was detected. The results provide reference for functional analysis of floral scent related gene at protein level in O. fragransand for revealing the molecular mechanism of terpenes biosynthesis in plant.
Key words: Osmanthus fragrans, terpene synthase (TPS), prokaryotic expression, floral scent
萜烯类化合物是植物中重要的挥发性物质,也是花和果实香味形成的重要活性物质,主要包含单萜、倍半萜和不规则萜类( Moses et al., 2013;Dudareva et al., 2013)。不同物种间的萜烯类物质成分和含量差异很大,熊敏等(2012)分析蜡梅花挥发油成分主要为倍半萜;蕙兰鲜花中主要是单萜类物质(张莹等,2013);梅花的挥发性成分中萜烯类物质含量很少(赵印泉等,2010)。物种内不同品种间在物质成分和含量上存在一定差异。杜永芹等(2013)比较不同品种蜡梅花精油成分发现,‘古蜡梅’中石竹烯占比较高,‘扬州黄’主要为β-荜澄茄油萜。由于萜烯类化合物在物种间或品种间的多樣性,近年来已成为科学研究的热点。植物萜烯类化合物有两种合成途径:2-C-甲基-D-赤藓糖醇-4-磷酸途径(Methylerythritol-4-phosphate pathway, MEP)和甲羟戊酸途径(Mevalonate pathway, MVA)(Nagegowda, 2010)。萜烯合酶(Terpene synthase, TPS)是作用于萜烯物质合成最后一步的反应酶,将MEP途径产生的牻牛儿焦磷酸(Geranyl pyrophosphate, GPP)或MVA途径产生的法泥基焦磷酸(Farnesyl pyrophosphate, FPP)进一步催化成各种萜烯类化合物(Tholl, 2006;Degenhardt et al., 2009)。有的物种的TPS可催化GPP和FPP的顺式异构体橙花基二磷酸(Neryl diphosphate, NDP)和Z,Z-FPP产生新的化合物(Bleeker et al., 2011)。TPS的种类和功能往往决定物种中萜烯物质的多样性,不同物种中萜烯合酶的种类和作用功能有很大的不同(Tholl et al., 2005;Garms et al., 2010;Martin et al., 2010)。目前关于萜烯合酶的挖掘和功能分析仅在拟南芥、葡萄、猕猴桃等少数物种中比较全面,其他物种还有待研究。
桂花(Osmanthus fragrans)是著名香花植物,鲜花及精油在高端香水、香料和化妆品行业需求广泛。桂花花朵中的挥发性成分主要有萜烯类、芳香族类和酯类等物质(曹慧等,2009;杨秀莲等,2015)。萜烯类化合物是其主要成分,也是重要的香味活性物质,主要成分为单萜和不规则萜类(Xin et al., 2013;Cai et al., 2014)。不同桂花品种萜烯类物质的成分和含量差异大。Cai et al.(2014)的研究发现,‘厚瓣银桂’中反式-β-罗勒烯最多,‘柳叶金桂’中β-紫罗兰酮最多,而‘镉橙丹桂’中芳樟醇最多。Zeng et al.(2015)进一步研究发现,TPS是造成不同品种间萜烯类香气成分差异的关键基因,从中克隆了4个TPS基因成员,并在烟草中进行了初步的功能验证。本研究在课题组前期研究的基础上,对4个TPS蛋白的理化性质、亚细胞定位和结构进行生物信息分析,构建原核表达载体在大肠杆菌中进行体外表达,并纯化可溶性重组蛋白进行体外酶功能的验证,为揭示桂花萜烯类物质生物合成的分子机理提供参考,有助于将来提高和改善其他物种的香气。
1 材料与方法
1.1 材料
所用植物材料为华中农业大学校园苗圃内光照均匀且无病虫害的健康植株桂花品种‘柳叶金桂’(Osmanthus fragrans‘Liuye jingui’)。对取样材料称重后立即置于液氮中速冻,尽快转移至-80 ℃冰箱保存备用。
1.2 方法
1.2.1 基因编码区序列获得 利用课题组前期克隆并已上传NCBI基因数据库的结果[GeneBank no. KT591180(TPS1)、KT591181(TPS2)、KT591182(TPS3)和KT591183(TPS4)]。
1.2.2 蛋白生物信息学分析 利用生物信息学分析网站(表1)预测编码蛋白理化性质、亚细胞定位、转运肽及蛋白质二级结构, 为原核表达载体构建和体外蛋白功能解析提供依据。
1.2.3 原核表达载体的构建 根据基因编码序列设计引物,上游引物不含ATG起始密码子和N-端信号肽序列,以StuI和XbaI为双酶切位点,引物序列见表2。以实验室保存的TA-克隆载体为模板,将目的片段连接到pET6xHN(Clontech公司)原核表达载体上,挑取阳性克隆送公司测序。测序完全正确的原核表达载体转化Transetta(DE3)(全式金公司)感受态细胞。
1.2.4 重组质粒在大肠杆菌中的诱导表达及SDS-PAGE分析 挑取阳性的Transetta(DE3)菌株单克隆接种到 2 mL LB(100 mg·L-1Amp)培养基中,37 ℃ 200 r·min-1振荡培养12 h 后,将菌液按 1∶50 的比例扩大培养,37 ℃ 200 r·min-1振荡培养至OD600 nm为0.6~0.8时,加入IPTG至终浓度为0.2 mmol·L-1,在18 ℃ 150 r·min-1的条件下诱导表达14~16 h后收集菌液。以不含目的基因的pET6xHN-空载转化的Transetta (DE3)大肠杆菌为阴性对照。取收集的菌块加入1/10原菌液体积的1 × PBS缓冲液,加入溶菌酶至终浓度0.75 mg·mL-1,并加入DNase I至1U·mL-1,重悬,超声波3次,每次10 s,期间在冰上放置30 s。先4 ℃ 10 000×g离心20 min,取上清至干净的离心管中, 再用 1/10原菌液体积的1× PBS缓冲液重悬沉淀。在得到的上清和沉淀悬浮液中分别加入等体积的2×SDS上样缓冲液混匀,95 ℃加热3~5 min,10 000×g离心2 min,上样进行SDS-PAGE (5 %浓缩胶,12 %分离胶),检测蛋白表达结果。
1.2.5 重组蛋白的分离纯化及体外酶活性分析 取重组蛋白表达稳定而且可溶性较好的剩余菌液沉淀,按1 mg菌体沉淀加入20 μL 菌体裂解液的比例加入HisTALON xTractor Buffer,重悬沉淀。向每2 mL HisTALON xTractor Buffer中加入1 μL DNAse(1U·μL-1),轻轻混匀,冰浴15 min,间歇性混合,4 ℃ 10 000×g离心20 min,小心收集干净的上清液,用0.45 μm的滤膜进行抽滤。参考说明书利用HisTALONTM重力柱(Clontech公司)对重组蛋白进行纯化。用Bradford方法检测重组蛋白质的浓度,并将纯化过程中收集的各组分进行SDS-PAGE分析。为了后续研究不受影响,通过PD-10柱(GE公司)过滤去除纯化后蛋白溶液中过量的咪唑,并将原有的洗脱缓冲液替换成反应缓冲液[15 mmol·L-1MOPSO,12.5 %(v/v)甘油,1mmol·L-1抗坏血酸,1 μL·mL-1吐温20,1 mmol·L-1氯化镁,2 mmol·L-1DTT,pH 7.0]。向5 mL可密封的反应瓶中加入50 μg重组蛋白(以100 ℃ 加热5 min的50 μg重组蛋白为对照)和终浓度为10 μmol·L-1的底物GPP、FPP或NDP,补加反应缓冲液至2 mL,混合均匀,密封。置于28 ℃的摇床,转速125 r·min-1,反应40 min。然后将固相微萃取(SPME)萃取头插入反应瓶内,静置萃取40 min。萃取完成之后,进行GC-MS分析。
1.2.6 GC-MS分析 用30 m × 0.25 mm × 0.25 μm HP-5MS毛细管柱 (J & W Scientific公司)进行色谱分离,以高纯度氦气(99.999%)为载气,流速为1.2 mL·min-1。色谱分析条件:起始柱温40 ℃,维持3 min;以3 ℃·min-1的速度升至73 ℃,保持3 min;以 5 ℃·min-1升至220 ℃,维持2 min。結合HP5975B 四极质谱(Agilent Technologies公司)进行质谱分析,质谱条件如下:传输线温度为250 ℃;离子源温度为220 ℃;EI电离模式;电子能量为70 eV;扫描的质谱范围45~450 amu。在相同的条件下,对C8-C40的正构烷烃标样(每个化合物浓度为0.005 μL·mL-1)(Sigma-Aldrich公司) 进行GC-MS分析,计算目标物质的保留指数(RI)。
2 结果与分析
2.1 蛋白质理化性质分析
登录ProtParam分析四个TPS蛋白氨基酸理化性质,结果见表3。TPS1蛋白由581个氨基酸组成,相对分子量67.27,理论等电点为5.49,负电荷残基 Asp+Glu 82,正电荷残基 Arg+Lys 69,半衰期为30 h,不稳定系数55.60(不稳定系数<40时稳定),属于不稳定蛋白,脂肪系数92.19,平均疏水性为-0.274,为亲水蛋白。TPS2蛋白由555个氨基酸组成,相对分子量63.68,理论等电点为6.08,负电荷残基 Asp+Glu 74,正电荷残基 Arg+Lys 65,半衰期为30 h,不稳定系数35.03,属于稳定蛋白,脂肪系数87.35,平均疏水性为-0.350,为亲水蛋白。TPS3蛋白由591个氨基酸组成,相对分子量68.27,理论等电点为6.07,负电荷残基 Asp+Glu 74,正电荷残基 Arg+Lys 67,半衰期为30 h,不稳定系数48.01,属于不稳定蛋白,脂肪系数88.97,平均疏水性为-0.299,为亲水蛋白。TPS4蛋白由548个氨基酸组成,相对分子量63.53,理论等电点为5.23,负电荷残基 Asp+Glu 75,正电荷残基 Arg+Lys 54,半衰期为30 h,不稳定系数52.04,属于不稳定蛋白,脂肪系数97.12,平均疏水性为-0.247,为亲水蛋白。
2.2 蛋白亚细胞定位和信号肽预测
利用常用在线工具TargetP 1.1 Server 对TPS蛋白进行亚细胞定位预测,结果见表4。TPS1定位在叶绿体中的概率为0.831,线粒体为0.131,为分泌蛋白的可能性0.028,其他的可能性为0.067,因此定位于叶绿体的可信度最高。TPS2位于叶绿体的概率为0.226,线粒体为0.530,为分泌蛋白的可能性0.028,其他的可能性为0.196,因此有可能定位于线粒体。TPS3定位于叶绿体的概率为0.409,线粒体为0.222,为分泌蛋白的可能性0.071,其他的可能性为0.245,因此可能定位于叶绿体。TPS4位于叶绿体的概率为0.145,线粒体为0.147,为分泌蛋白的可能性0.100,其他的可能性为0.804。SignalP 4.1 Server 分析4个TPS蛋白未出现明显的信号肽和信号肽剪切位点,结果未列出。ChloroP 1.1 Server分析TPS1和TPS3的转运肽长度分别为47个和38个氨基酸。
2.3 TPS蛋白二级结构预测
运用SPOMA预测TPS二级结构,结果如表5和图1。TPS1蛋白中 391个氨基酸形成α-螺旋,占比最多,为67.30%;32个氨基酸形成延伸链,占比5.51%;21个氨基酸形成β-转角,占比 3.61%;还有137个形成无规则卷曲,占整条链23.58%。TPS2蛋白中 369个氨基酸形成α-螺旋,占比最多,为66.49%; 23个氨基酸形成延伸链, 占比4.14%;21个氨基酸形成β-转角,占比 3.78%;还有142个形成无规则卷曲,占整条链25.59%。TPS3蛋白中 399个氨基酸形成α-螺旋,占比最多,为67.51%;25个氨基酸形成延伸链,占比4.23%;17个氨基酸形成β-转角,占比 2.88%;还有150个形成无规则卷曲,占整条链25.38%。TPS4蛋白中 379个氨基酸形成α-螺旋,占比最多,为69.16%;20个氨基酸形成延伸链,占比3.65%;19个氨基酸形成β-转角,占比 3.47%;还有130个形成无规则卷曲,占整条链23.72%。从图1可以看出,TPS1、TPS2、TPS3蛋白在N端均存在延伸链,TPS1的延伸链密度最大,TPS3次之,TPS2较少。TPS4的N基端没有延伸链。TPS1的N端延伸链涵盖59个氨基酸的区域内,TPS2涉及42个氨基酸的区域,TPS3涉及46个氨基酸的区域。
2.4 TPS重組蛋白的原核表达分析
原核表达载体的构建过程中,TPS1和TPS3分别去掉了47和38个氨基酸的转运肽,四个蛋白的N端均增加了24个氨基酸的组蛋白标签,经ProtParam预测的重组蛋白分子量分别为65、66、67、66 kDa。构建正确的原核表达载体转化至大肠杆菌Transetta DE3中,经过诱导,4个重组蛋白都能够在大肠杆菌中顺利地表达,表达蛋白的分子量介于50~70 kDa之间,说明与预期的蛋白大小一致(图2:A)。对表达的重组蛋白进行溶解度分析,结果只有TPS4蛋白在上清液中有表达,其他三个重组蛋白在上清液中几乎检测不到(图2:B)。将TPS4蛋白进行进一步的蛋白分离与纯化,整个蛋白的分离纯化过程如图2:C所示,最终能够得到较好完整性和较高纯度的TPS4重组蛋白,可用于进一步的蛋白功能分析。
2.5 TPS4重组蛋白的功能分析
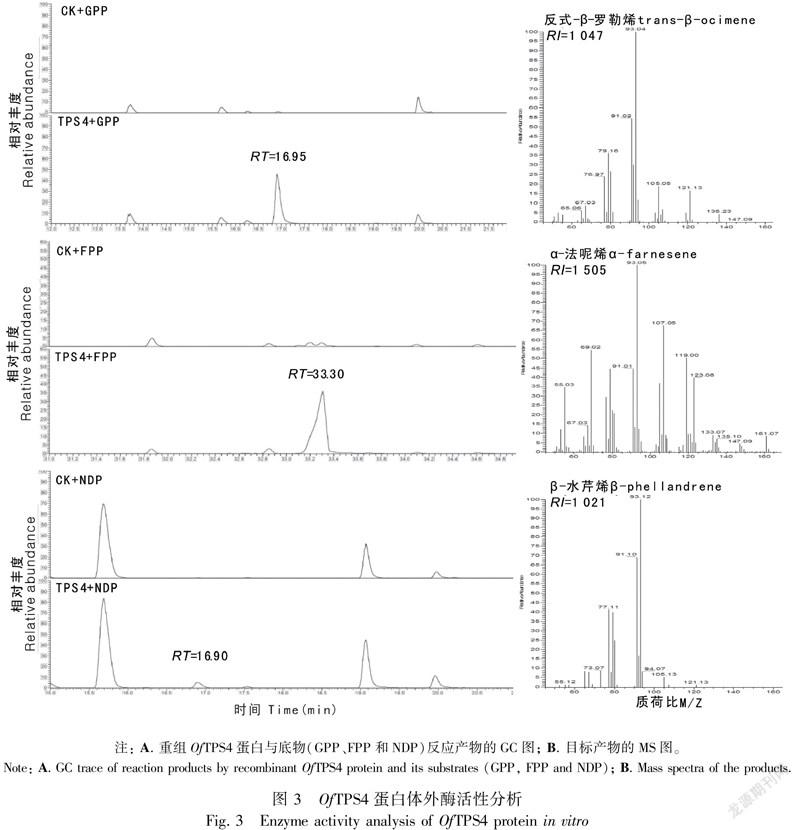
将纯化的TPS4重组蛋白与底物GPP、FPP和NDP分别在反应缓冲液中进行反应,反应产物用SPME-GC-MS 方法进行产物检测(图3)。由图3可知,与经过高温加热失活后的TPS重组蛋白(CK)相比,未加热蛋白与GPP反应后,在保留时间(RT)16.95 min的位置出现明显特征峰,经过质谱特征和保留指数(RI=1 047)鉴定为反式-β-罗勒烯;与FPP反应后,在保留时间(RT=1 505)33.30min的位置出现特征峰,鉴定为α-法呢烯;与NDP反应后,在保留时间(RT=1 021)16.90 min的位置出现微弱特征峰,鉴定为β-水芹烯。该蛋白与3种底物分别进行反应,都只产生一种化合物。
3 讨论
大肠杆菌原核表达系统具有遗传背景清楚、培养简单、应用广泛等特点,可用于蛋白功能验证、酶活性分析、抗体制备等多个领域 (Cabrita & Bottomley, 2004;Terpe, 2006)。获得产量高且以可溶形式表达的外源重组蛋白是实际应用的关键。但是,蛋白可溶性与自身氨基酸组成、蛋白亲水性、等电点等有一定关系,在原核系统中表达的真核蛋白往往以不可溶性的包涵体形式存在,不具备生物学活性(Wilkinson & Harrison, 1991;Shimada et al., 2005)。本研究将4个桂花TPS蛋白在大肠杆菌原核系统中实现了表达,但只有TPS4获得了可溶性蛋白,另外3个的重组蛋白均以包涵体形式存在。比较它们的理化性质发现,4个TPS蛋白均为亲水性蛋白;TPS4蛋白与其他三个蛋白的理化性质相差不大,仅TPS4等电点和正电荷残基略低,脂肪系数略高。亚细胞定位和信号肽预测发现,TPS1和TPS3定位于质体,在蛋白的氨基端分别具有明显的47和38个氨基酸的转运肽。去除预测转运肽之后的TPS1蛋白等电点为5.22,脂肪系数95.19,正电荷残基63,与TPS4蛋白相差不大(结果未列出)。可见,蛋白理化性质并不是引起其他三个TPS形成包涵体的主要原因。有研究发现,信号肽可导致原核表达系统中包涵体的形成 (Bohlmann et al., 1998;Crowell et al., 2002)。本研究只有TPS1和TPS3预测到明显的转运肽,比较4个TPS蛋白的二级结构,结果发现,TPS4中的α-螺旋比例高于另外三个,而延伸链比例低于另外三个蛋白。在TPS1、TPS2和TPS3靠近氨基端的区域内均有延伸链的存在,而TPS4的氨基端不存在延伸链;而且TPS1、TPS2和TPS3的氨基端延伸链覆盖区域长于转运肽预测长度,说明它们实际的信号肽长度可能大于预测值。由此说明,蛋白质二级结构延伸链的比率和存在区域很可能影响蛋白在原核系统表达的溶解度。
萜烯合酶是一个中等规模的蛋白家族,大多萜烯合酶都具有催化GPP和FPP的双重功能,分别产生不同种类的萜烯类化合物(Tholl, 2006;Chen et al., 2011)。我们前期发现,在烟草中表达4个TPS基因均只能检测到一种产物,TPS4基因的产物是一种倍半萜物质α-法呢烯(Zeng et al., 2015)。本研究将可溶性的TPS4蛋白分别与GPP、FPP和NDP反应,分别检测到一种底物。相同体系下,将TPS4蛋白与GPP反应产生反式-β-罗勒烯,TPS4蛋白与FPP反应产生大量的α-法呢烯,与NDP反应只检测到少量β-水芹烯,说明TPS4蛋白催化底物FPP的活性最高,虽可催化GPP的顺式异构体NDP,但效率不高。我们前期也发现,TPS3基因在烟草中表达同样产生反式-β-罗勒烯,而且TPS3和TPS4同聚为TPS-b亚家族(Zeng et al., 2015)。由此说明,桂花中的TPS4具有催化GPP和FPP的双重功能;与TPS3不仅起源较近,而且催化相同的反应,应属同工酶。虽然,烟草中的基因表达和体外酶活性分析都证明从花瓣中获得的TPS4可产生倍半萜α-法呢烯(Zeng et al., 2015)。但研究发现,桂花的花瓣挥发物中很少含有倍半萜类物质,也未曾检测到α-法呢烯的存在(曹慧等,2009;Xin et al., 2013;杨秀莲等,2015)。这可能是由两方面的原因造成的:一是由于TPS4在桂花花瓣中的基因表达丰度太低;二是因为桂花花瓣中存在的FPP底物不足。本研究结果为揭示桂花萜烯类物质生物合成的机理提供参考,也为从蛋白水平研究桂花花香形成奠定基础。
参考文献:
BLEEKER PM, SPYROPOULOU EA, DIERGAARDE PJ,et al., 2011. RNA-seq discovery, functional characterization, and comparison of sesquiterpene synthases from Solanum lycopersicumand Solanum habrochaitestrichomes [J]. Plant Mol Biol, 77: 323-336.
BOHLMANN J, MEYERGAUEN G, CROTEAU R,1998. INAUGURAL ARTICLE by a recently elected academy member: Plant terpenoid synthases: Molecular biology and phylogenetic analysis [J]. Proc Natl Acad Sci USA, 95: 4126-4133.
CABRITA LD, BOTTOMLEY SP, 2004. Protein expression and refolding-A practical guide to getting the most out of inclusion bodiprotein expression and refolding-A practical guide to getting the most out of inclusion bodieses [J]. Biotechnol Ann Rev, 10(4): 31-50.
CAI X, MAI RZ, ZOU JJ, et al., 2014. Analysis of aroma-active compounds in three sweet osmanthus (Osmanthus fragrans) cultivars by gas-chromatography-olfactometry and GC-mass spectrometry[J]. J Zhejiang Univ Sci B, 15(7): 638-648.
CAO H, LI ZG, SHEN DL, 2009. GC/MS fingerprint analysis of Osmanthus fragransLour. in different varieties [J]. Acta Hortic Sin, 36(3): 391-398. [曹慧,李祖光,沈德隆,2009. 桂花品种香气成分的GC/MS指纹图谱研究 [J]. 园艺学报,36(3): 391-398.]
CHEN F, THOLL D, BOHLMANN J, et al., 2011. The family of terpene synthases in plants: A mid-size family of genes for specialized metabolism that is highly diversified throughout the kingdom [J]. Plant J, 66: 212-229.
CROWELL AL, WILLIAMS DC, DAVIS EM, et al., 2002. Molecular cloning and characterization of a new linalool synthase [J]. Arch Biochem Biophys, 405(1): 112-121.
DEGENHARDT J, KLLNER TG, GERSHENZON J, 2009. Monoterpene and sesquiterpene synthases and the origin of terpene skeletal diversity in plants [J]. Phytochemistry, 70: 1621-1637.
DU YQ, TIAN XL, GAN JZ, et al., 2013. Essential oils extracted from different varieties of wintersweet (Chimonanthus praecox) [J]. J Beijing For Univ, 35(Suppl.1): 81-85.[杜永芹,田曉龙,甘建忠,等,2013. 不同品种蜡梅花精油成分的研究 [J]. 北京林业大学学报,35(增刊1): 81-85.]
DUDAREVA N, KLEMPIEN A, MUHLEMANN JK, et al., 2013. Biosynthesis, function and metabolic engineering of plant volatile organic compounds[J]. New Phytol, 198(1): 16-32.
GARMS S, KOLLNER TG, BOLAND W, 2010. A multiproduct terpenesynthase fromMedicago truncatulagenerates cadalane sesquiterpenes via two different mechanisms [J]. J Organ Chem, 75: 5590-5600.
MARTIN DM, AUBOURG S, SCHOUWEY M, et al., 2010. Functional annotation, genome organization and phylogeny of the grapevine (Vitis vinifera) terpene synthase gene family based on genome assembly, FLcDNA cloning, and enzyme assays [J]. BMC Plant Biol, 10: 226.
MOSES T, POLLIER J, THEVELEIN JM, et al., 2013. Bioengineering of plant (tri)terpenoids: From metabolic engineering of plants to synthetic biology in vivoand in vitro[J]. New Phytol, 200(1): 27-43.
NAGEGOWDA DA, 2010. Plant volatile terpenoid metabolism: Biosynthetic genes, transcriptional regulation and subcellular compartmentation [J]. FEBS Lett, 584(14): 2965-2973.
SHIMADA K, NAGANO M, KAWAI M, et al., 2005. Influences of amino acid features of glutathione S-transferase fusion proteins on their solubility [J]. Proteomics, 5(15): 3859-3863.
TERPE K, 2006. Overview of bacterial expression systems for heterologous protein production: From molecular and biochemical fundamentals to commercial systems [J]. Appl Microbiol Biotechnol, 72(2): 211-222.
THOLL D, CHEN F, PETRI J, et al., 2005. Two sesquiterpene synthases are responsible for the complex mixture of sesqui-terpenesemitted from Arabidopsis flowers [J]. Plant J, 42(5):757-771.
THOLL D, 2006. Terpene synthases and the regulation, diversity and biological roles of terpene metabolism [J]. Curr Opin Plant Biol, 9: 297-304.
WILKINSON DL, HARRISON RG, 1991. Predicting the solubility of recombinant proteins in Escherichia coli[J]. Nat Biotechnol, 9: 443-448.
XIN HP, WU BH, ZHANG HH, et al., 2013. Characterization of volatile compounds in flowers from four groups of sweet osmanthus (Osmanthus fragrans) cultivars[J]. Can J Plant Sci, 93: 923-931.
XIONG M, ZHOU MQ, XIANG L, et al., 2012. Analysis of essential oil in Chimonanthus praecox by GC-MS [J]. J Huazhong Agric Univ, 31(2): 182-186.[熊敏,周明芹,向林,等,2012. 蜡梅花挥发油成分的GC-MS分析 [J]. 华中农业大学学报,31(2): 182-186.]
YANG XL, SHI TT, WEN AL, et al., 2015. Variance analysis of aromatic components from different varieties of Osmanthus fragrans[J]. J NE For Univ, 43(1): 83-87. [杨秀莲,施婷婷,文爱林,等,2015. 不同桂花品种香气成分的差异分析 [J]. 东北林业大学学报, 43(1): 83-87. ]
ZENG XL, LIU C, ZHENG RR, et al., 2015. Emission and accumμlation of monoterpene and the key terpene synthase (TPS) associated with monoterpene biosynthesis inOsmanthus fragransLour[J]. Front Plant Sci, 6: 1232.
ZHANG Y, LI XL, WANG Y, et al., 2011. Changes of aroma components in OncidiumSharry Baby in different florescence and flower parts [J]. Sci Agric Sin, 44(1): 110-117.[張莹,李辛雷,王雁,等,2011. 文心兰不同花期及花朵不同部位香气成分的变化 [J]. 中国农业科学,44(1): 110-117.]
ZHAO YQ, ZHOU SJ, PENG PH, et al., 2011. Analysis of volatile compounds from Prunus mume flowers [J]. Guihaia, 31(4): 554-558.[赵印泉,周斯建,彭培好,等,2011. 三轮玉蝶梅花朵挥发性成分的分析 [J]. 广西植物,31(4): 554-558.]

