斜纹夜蛾蛋白二硫键异构酶基因的发育表达分析
申建梅 汪超 钟宏新 胡黎明

摘要:【目的】分析斜紋夜蛾蛋白二硫键异构酶基因(SlitPDI)的序列特征和发育表达模式,为解析SlitPDI蛋白在斜纹夜蛾生长发育过程中的生理功能提供依据。【方法】采用DNASTAR对SlitPDI基因序列特征和进化关系进行分析,并以实时荧光定量PCR研究SlitPDI基因在斜纹夜蛾2龄、4龄、6龄幼虫及蛹和新羽化雌、雄成虫共6个不同发育时期的相对表达量。【结果】SlitPDI基因编码494个氨基酸,预测该蛋白分子量约55.3 kD,理论等电点(pI)为4.52。氨基酸序列分析结果表明,SlitPDI蛋白序列具有PDI家族的典型特征:在序列的N端及C端均具有二硫键/巯基氧化还原位点-CGHC-。系统发育进化树分析结果表明,SlitPDI蛋白与意大利蜜蜂(Apis mellifera)的PDI蛋白序列一致性最低,为50.2%;与家蚕(Bombyx mori)的PDI蛋白序列一致性最高,为83.4%。斜纹夜蛾不同发育时期的实时荧光定量PCR分析结果表明,SlitPDI基因在4龄幼虫中的表达量最高,其表达量是基准含量2龄幼虫的1.27倍;在刚羽化雌、雄成虫的表达量也较高,分别为基准含量2龄幼虫的1.03和1.12倍。【结论】SlitPDI蛋白属于I类PDI家族蛋白,SlitPDI基因在斜纹夜蛾4龄幼虫和新羽化成虫中的表达量相对较高。
关键词: 斜纹夜蛾;二硫键异构酶;实时荧光定量PCR;表达模式
图文分类号: S433.4;Q966 文献标志码: A 文章编号:2095-1191(2019)05-0996-05
Abstract:【Objective】The sequence characteristics and developmental expression patterns of Spodoptera litura protein disulfide isomerase(SlitPDI) were analyzed to provide reference for the study of the physiological function of SlitPDI protein during S. litura growth. 【Method】The sequence characteristics and evolutionary relationship of SlitPDI gene was analyzed by DNAstar software. The relative expression levels of SlitPDI gene in the stages of the 2nd, 4th, 6th instar larvae, pupa, newly emerged male and female adults were investigated by real-time fluorescence quantitative PCR method. 【Result】The SlitPDI gene encoded 494 amino acids with an estimated molecular mass of 55.3 kD, and the theoretical isoelectric point(pI) was 4.52. Amino acid sequence analysis showed that the SlitPDI protein sequence had the typical characteristics of the PDI protein family: it had disulfide bond/sulfhydryl reduction-oxidation site CGHC at the N-terminus and C-terminus of the sequence. Phylogenetic analysis indicated that SlitPDI protein had the lowest sequence identity(50.2%) with the PDI protein sequence of Apis mellifera, and it had the highest sequence identity(83.4%) with the PDI protein sequence of Bombyx mori. Real-time fluorescence quantitative PCR analysis showed that the expression level of SlitPDI in the 4th instar larva reached the highest peak, and the amount was as 1.27 times as that in the 2nd instar larva. The expressions of the newly emerged male and female larvae were also high, which were as 1.03 and 1.12 times as that in the 2nd instar larva respectively. 【Conclusion】The SlitPDI protein belongs to the class I PDI family protein, and the SlitPDI gene is expressed relatively high in the 4th instar larvae and newly emerged adults of S. litura.
Key words: Spodoptera litura; disulfide isomerase; real-time fluorescence quantitative PCR; expression pattern
0 引言
【研究意义】斜纹夜蛾(Spodoptera litura)是一种食性杂、繁殖力强的鳞翅目夜蛾科害虫,其可危害300多种植物,对农作物的种植经济效益造成严重影响(张南等,2016;张丽丽等,2018)。化学防治在斜纹夜蛾的防治中一直占据主导地位,势必引起斜纹夜蛾对多种化学药剂产生严重的抗药性(聂南生等,2007;桑松等,2013;Armes et al.,2015),致使化学药剂的防治效果明显下降,导致农户过度滥用化学药剂而影响作物的绿色生产。因此,寻找新的药物作用靶标将成为防治斜纹夜蛾的新途径。蛋白二硫键异构酶(Protein disulfide isomerase,PDI)是一个多功能蛋白,其不仅参与蛋白二硫键的形成、蛋白折叠及翻译后修饰等过程(Wilkinson and Gilbert, 2004),还可作为分子伴侣抑制错误折叠蛋白的聚集,帮助蛋白重新正确折叠(Puig and Gilbert,1994)。因此,以PDI蛋白为药物作用靶标可为斜纹夜蛾的防治提供新思路。【前人研究进展】PDI可促进蛋白二硫键的形成和催化配对错误二硫键的重排,进而稳定蛋白质三维结构,属于蛋白二硫键/巯基氧化还原蛋白超家族(Hatahet and Ruddock,2009)。Goo等(2002)报道,PDI在家蚕(Bombyx mori)抵御细菌入侵过程中起到重要作用。Bourchookarn等(2008)研究发现,受黄头病毒(YHV)感染后,斑节对虾(Penaeus monodon)体内的PDI表达量明显提高。李燕等(2013)利用实时荧光定量PCR分析,发现在莱氏野村菌的诱导下,斜纹夜蛾PDI表达量显著上调。可见,PDI是一种应激蛋白,对病毒、细菌的侵染具有防御功能。此外,Hu等(2010)在桔小实蝇化学感受蛋白(Chemosensory proteins,CSPs)互作蛋白的筛选中发现PDI与CSP具有一定的亲和性,推测其可能参与昆虫化学感受蛋白中二硫键的形成,并在昆虫生命活动中扮演着重要角色。【本研究切入点】PDI不仅可修饰重要的功能蛋白结构,还可防御病毒、细菌等外来生物的侵染。因此,以斜纹夜蛾PDI蛋白为药物作用靶标来设计药物,可有效干扰斜纹夜蛾一些重要功能蛋白的正确折叠或降低其对外来生物的抵御能力,为斜纹夜蛾的防控提供新策略。但目前关于斜纹夜蛾PDI蛋白其他生理功能的报道相对较少。【拟解决的关键问题】以斜纹夜蛾为试验材料,定量比较从幼虫到新羽化成虫等不同发育时期斜纹夜蛾蛋白二硫键异构酶基因(SlitPDI)的mRNA表达量变化模式,以期解析SlitPDI蛋白在斜纹夜蛾发育过程中的生理功能,为斜纹夜蛾的行为调控提供重要的作用靶标。
1 材料与方法
1. 1 试验材料
1. 1. 1 供试昆虫 斜纹夜蛾采集自广州从化十字花科蔬菜田,于仲恺农业工程学院植物保护实验室内继代饲养。饲养条件:温度26~27 ℃,相对湿度75%~80%,光周期L∶D=16 h∶8 h。
1. 1. 2 主要试剂 RNA提取试剂盒(R6834)和DNaseΙ购自广州飞扬生物工程有限公司;反转录试剂盒、Ex Taq DNA聚合酶和荧光定量试剂盒SYBR Premix Ex Taq II购自广州瑞真生物工程有限公司。
1. 2 RNA提取和反转录
参照RNA提取试剂盒的操作说明提取斜纹夜蛾2龄、4龄、6龄幼虫及蛹和雌雄成虫(新羽化)6个不同发育时期的样品总RNA,RNA质量检查合格后反转录合成cDNA,以此作为实时荧光定量PCR的模板,并贮存于-20 ℃冰箱备用。
1. 3 序列生物信息学分析
利用NCBI(https://www.ncbi.nlm.nih.gov/)对选取的21种昆虫PDI蛋白序列进行同源性比对分析;使用DNASTAR的MegAlign程序构建系统发育进化树,并与SlitPDI蛋白序列进行进化关系分析。
1. 4 SlitPPDI基因表达分析
根据已登录的SlitPDI(GenBank登录号JX18 3988)和actin(GenBank登录号KP331524)的序列,利用Primer Premier 5.0设计荧光定量特异性引物PDIQF(5'-TCCATCAAGCTGGCTAAGGT-3')和PDIQR(5'-ATCAATAGGGCTGCCGTTC-3');actF(5'- TTCCCGACGGACAAGTCAT-3')和actR(5'-GCATA CGGTCAGCAATACCAG-3')。引物均由廣州英骏生物技术有限公司合成。
实时荧光定量PCR反应体系25.0 μL:cDNA模板2.0 μL,SYBR预混液12.5 μL,上、下游引物各1.0 μL,灭菌超纯水8.5 μL。扩增程序:94 ℃预变性30 s;94 ℃ 5 s,58 ℃ 40 s,72 ℃ 10 s,共进行35个循环。每个样品重复3次,分别检测目的基因和内参基因的Ct值。
1. 5 统计分析
试验采用2-△△Ct法计算目的基因的相对表达量,再用SPSS 17.0进行单因素方差分析(One-way ANOVA)。
2 结果与分析
2. 1 SlitPDI生物信息学分析结果
分析结果显示,SlitPDI基因编码494个氨基酸,预测该蛋白分子量约55.3 kD,理论等电点(pI)为4.52。将选取的昆虫PDI蛋白与SlitPDI蛋白进行氨基酸序列一致性分析,结果(图1)表明,4条不同目的昆虫PDI蛋白具有较高的序列一致性,且序列中均包含2个-Cys-X-Y-Cys-(-CGHC-)位点,该位点是PDI蛋白序列的典型特征。
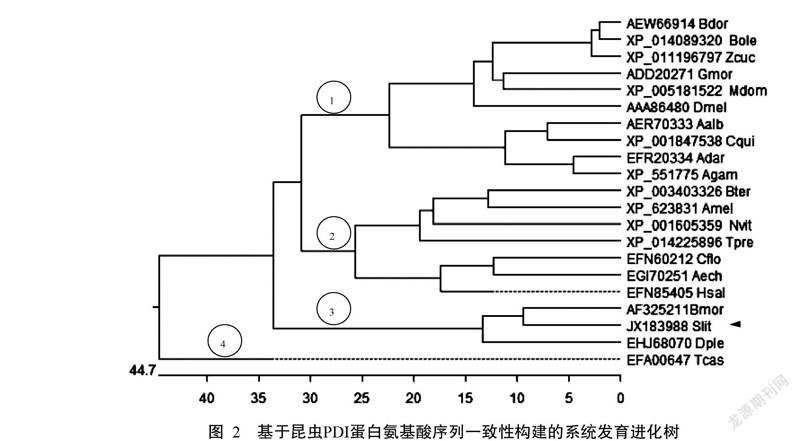
将SlitPDI基因对应的氨基酸序列与所选的21种昆虫PDI蛋白序列进行同源性比对分析,并采用MegAlin中的ClustalW方法构建系统发育进化树,分析其进化关系。结果(图2)表明,SlitPDI与意大利蜜蜂(Apis mellifera)PDI序列的一致性最低,为50.2%。在昆虫纲中SlitPDI蛋白与家蚕PDI序列的一致性最高,为83.4%。由图2可知,21条PDI序列分别聚为四大支,第一支对应双翅目昆虫的PDI序列;第二支对应膜翅目昆虫的PDI序列;第三支对应鳞翅目昆虫的PDI序列;第四支对应鞘翅目昆虫的PDI序列。Slit-PDI蛋白序列与鳞翅目中的家蚕和君主斑蝶(Danaus plexippus)的亲缘关系较近,聚为一支。
2. 2 不同发育期SlitPDI基因的mRNA表达分析结果
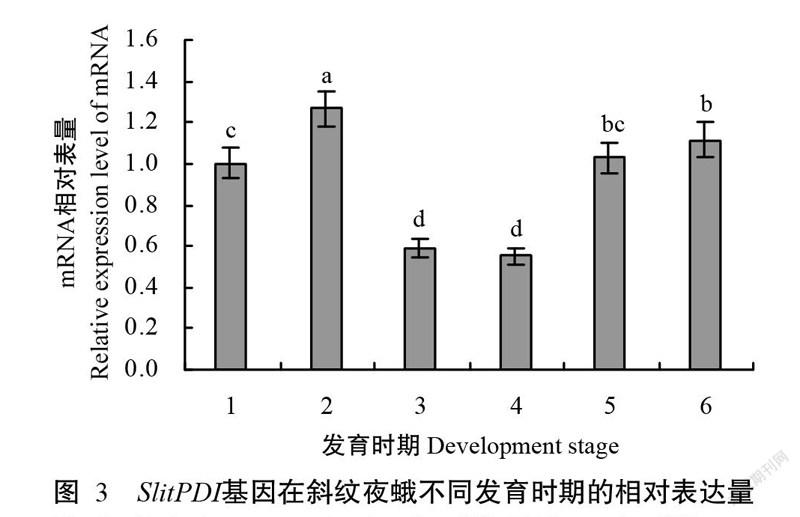
实时荧光定量PCR检测结果(图3)显示,SlitPDI基因在斜纹夜蛾的各发育时期均有表达,2龄和4龄幼虫中SlitPDI mRNA表达量呈逐渐上升趋势,4龄幼虫中表达量达最高峰。以2龄幼虫SlitPDI基因mRNA含量为基准含量,4龄幼虫的表达量是基准含量的127%;但在6龄幼虫和蛹中其表达量又突然下降,分别为基准含量的59%和55%;随后其在新羽化雌、雄成虫中的表达量又呈增加趋势,分别为基准含量的103%和112%。
3 讨论
PDI蛋白属于硫氧还蛋白超家族,一般由a、a'、b和b'共4个活性结构域组成,其中a和a'区域具有催化活性域的典型序列特征-CGHC-;而b和b'不具催化活性(Kemmink et al.,1997;Benham et al.,2000)。不同物种的催化活性域-CGHC-的个数不同,含有2个活性域的为Ⅰ类PDI家族蛋白,含有3个活性域的为Ⅱ类PDI家族蛋白(Frand and Kaiser,2000;Ren et al.,2011;李燕等,2013)。本研究对来自家蚕、赤拟谷盗、黑腹果蝇及斜纹夜蛾等4种不同目的昆虫PDI蛋白进行氨基酸序列比对,结果发现在这4种蛋白的N端和C端各具有一个高度保守的氧化还原活性域-CGHC-,因此,SlitPDI蛋白属于Ⅰ类PDI家族蛋白。本研究的氯基酸序列聚类分析结果表明同一目的昆虫PDI序列均聚在一起,序列的聚类关系与各物种的分类地位一致。
PDI是一种重要的折叠酶,可催化新生肽链中二硫键的形成和异构化,在维持蛋白质稳定性和生物活性方面发挥重要作用(Benham et al.,2000;王志强等,2009)。胡黎明等(2012)研究表明桔小实蝇PDI基因在其1 d蛹中的mRNA表达量最高,并发现从3龄幼虫到蛹的发育过程中其表达量呈上升趋势,推测PDI可能在桔小实蝇化蛹过程中发挥重要作用。李燕等(2013)研究发现,SlitPDI在脂肪体、头部、中肠、马氏管、体壁和血液等组织中均有表达,但在血液中表达量最高,脂肪体次之,头部最低。本研究利用实时荧光定量PCR检测了SlitPDI基因在斜纹夜蛾不同发育时期的mRNA表达量变化情况,旨在分析SlitPDI在其生长发育过程中的生理功能,结果表明,SlitPDI基因在斜纹夜蛾4龄幼虫中的表达量最高,在其新羽化成虫中的表达量次之。因此,推测SlitPDI在斜纹夜蛾4龄幼虫和刚羽化成虫等发育过程中发挥重要作用,但具体功能还有待后续进一步验证。
4 结论
本研究分析了SlitPDI蛋白的生物信息学特征,发现SlitPDI蛋白的氨基酸序列具有2个高度保守的氧化还原活性域-CGHC-,属于Ⅰ类PDI家族蛋白。SlitPDI基因在斜纹夜蛾4龄幼虫和新羽化成虫中的表达量相对较高。
参考文献:
胡黎明,申建梅,胡美英,宾淑英,黄华枝,廖泓之,林进添. 2012. 桔小实蝇二硫键异构酶基因的克隆及其发育表达[J]. 华中农业大学学报, 31(4):457-462. [Hu L M, Shen J M, Hu M Y, Bin S Y, Huang H Z, Liao H Z, Lin J T. 2012. Cloning and developmental expression pa-ttern analysis of PDI in Bactrocera dorsalis(Hendel)[J]. Journal of Huazhong Agricultural University,31(4):457-462.]
李燕,王中康,陈环,冯二艳,殷幼平. 2013. 斜纹夜蛾SpLPDI的克隆、表达及其对莱氏野村菌的免疫应答分析[J]. 中国农业科学,46(7):1359-1369. [Li Y, Wang Z K, Chen H, Feng E Y, Yin Y P. 2013. Molecular cloning and expression pattern analysis of a protein disulfide isomerases (SpLPDI) in Spodoptera litura[J]. Scientia Agricultura Sinica, 46(7):1359-1369.]
聶南生,黄水金,龙丘陵. 2007. 斜纹夜蛾的抗药性及其治理策略[J]. 江西农业学报, 19(7):51-54. [Nie N S, Huang S J, Long Q L. 2007. Insecticide-resistance and control strategy for common cutworm, Spodoptera litura(Fab.) [J]. Acta Agriculturae Jiangxi, 19(7):51-54.]
桑松,王政,齐江卫,舒本水,钟国华. 2013. 斜纹夜蛾抗药性研究进展[J]. 环境昆虫学报, 35(6):808-814. [Sang S, Wang Z, Qi J W, Shu B S, Zhong G H. 2013. Research progresses on pesticide resistance of Spodoptera litura[J]. Journal of Environmental Entomology, 35(6):808-814.]
王志强,周智敏,郭占云. 2009. 蛋白质二硫键异构酶家族的结构与功能[J]. 生命科学研究,13(6):548-552. [Wang Z Q, Zhou Z M, Guo Z Y. 2009. The structure and function of the protein disulfide isomerase family[J]. Life Science Research,13(6):548-552.]
张丽丽,武怡琼,杨正飞,郭丽,魏佳平,阚云超. 2018. 斜纹夜蛾保幼激素环氧水解酶基因的克隆和原核表达[J]. 河南农业科学,47(12):84-89. [Zhang L L,Wu Y Q,Yang Z F,Guo L,Wei J P,Kan Y C. 2018. Cloning and prokaryotic expression of JHEH gene from Spodoptera litura[J]. Journal of Henan Agricultural Sciences,47(12):84-89.]
張南,陈巨龙,仵均祥. 2016. 斜纹夜蛾半人工饲料的改进[J]. 西北农林科技大学学报(自然科学版),44(4):109-113. [Zhang N,Chen J L,Wu J X. 2016. Improvement of semi-artificial diet for Spodoptera litura[J]. Journal of Northwest A & F University(Natural Science Edition),44(4):109-113.]
Armes N J,Wightman J A,Jadhav D R,Rao G V. 2015. Status of insecticide resistance in Spodoptera litura in andhra pradesh,India[J]. Pest Management Science,50(3):240-248.
Benham A M,Cabibbo A,Fassio A,Bulleid N,Sitia R,Braakman I. 2000. The CXXCXXC motif determines the fol-ding,structure and stability of human Ero1-Lalpha[J]. The EMBO Journal,19(17): 4493-4502.
Bourchookarn A,Havanapan P O,Thongboonkerd V,Krittanai C. 2008. Proteomic analysis of altered proteins in lymphoid organ of yellow head virus infected Penaeus mo-nodon[J]. Biochimica et Biophysica Acta-biomembranes,1784: 504-511.
Frand A R, Kaiser C A. 2000. Two pairs of conserved cystei-nes are required for the oxidative activity of Ero1p in protein disulfide bond formation in the endoplasmic reticu-lum[J]. Molecular Biology of the Cell, 11:2833-2843.
Goo T W, Yun E Y, Hwang J S, Kang S W, Park S, You K H, Kwon O Y. 2002. Molecular characterization of a Bombyx mori protein disulfide isomerase(bPDI)[J]. Cell Stress & Chaperones,7(1): 118-125.
Hatahet F,Ruddock L W. 2009. Protein disulfide isomerase: A critical evaluation of its function in disulfide bond formation[J]. Antioxidants and Redox Signalling,11(11): 2807-2850.
Hu L M,Shen J M,Hu M Y,Muhammad R. 2010. Screening of T7 phage displayed Bactrocera dorsalis(Hendel) antenna cDNA library against chemosensory protein[J]. Archives of Insect Biochemistry and Physiology,75(3): 174-186.
Kemmink J,Darby N J,Dijkstra K,Dijkstra K,Nilges M,Creighton T E. 1997. The folding catalyst protein disulfide isomerase is constructed of active and inactive thioredoxin modules[J]. Current Biology,7(4): 239-245.
Puig A, Gilbert H F. 1994. Anti-chaperone behavior of BiP du-ring the protein disulfide isomerase-catalyzed refolding of reduced denatured lysozyme[J]. The Journal of Biological Chemistry, 269(41):25889-25896.
Ren Q A,Zhou J,Sun S S,Kang C J,Zhao X F,Wang J X. 2011. Molecular cloning and expression pattern analysis of two novel disulfide isomerases in shrimp[J]. Compara-tive Biochemistry and Physiology:Part C,153(3):301-309.
Wilkinson B,Gilbert H F. 2004. Protein disulfide isomerase[J]. Biochimica et Biophysica Acta-biomembranes,1699: 35-44.
(责任编辑 麻小燕)

