籼稻明恢86多基因遗传转化体系的研究
魏林艳 连玲 魏毅东 罗曦 何炜 谢鸿光 谢华安 张建福





摘 要:【目的】探索适合籼稻明恢86多基因遗传转化的条件,为创制含高产、抗逆、抗虫、抗病等基因的水稻新材料奠定基础。【方法】以籼稻明恢86为受体材料,将构建好的含作物高产基因RRM2、耐旱基因 HS1、抗除草剂基因EPSPS、抗虫基因Bt、细胞凋亡抑制基因iap和促细胞再生基因p35等多基因载体(载体分别命名为P5和P8)进行遗传转化。在此基础上,分别对多基因遗传转化体系的受体材料、农杆菌浓度、侵染时间、共培养方式、G418筛选浓度和草甘膦筛选浓度等主要影响因素进行试验,探讨其适宜的转化条件。【结果】受体材料的筛选结果表明,幼胚的出愈率显著高于成熟胚,且其愈伤组织状态相对较好;各转化条件的筛选结果,农杆菌侵染浓度OD600为0.4~0.6、侵染时间15~20 min、共培养2~3 d、培养基上添加无菌滤纸、G418筛选浓度150 mg·L-1和草甘膦筛选浓度800 mg·L-1是提高转化效率的优化条件; PCR分析结果,多基因载体P5中的GUS基因成功转入籼稻明恢86。【结论】通过对培养条件的优化,可使籼稻明恢86愈伤组织的诱导愈伤率和抗性愈伤率得到显著提高。
关键词:基因;遗传转化;籼稻;明恢86
中图分类号:S 511文献标识码:A文章编号:1008-0384(2019)06-621-09
Abstract:【Objective】Conditions for simultaneous transformation of multiple genes in Indica rice, Minghui 86, were studied to facilitate the development of high yield and resistant breeds.【Method】Two multi-gene vectors designated as P5 and P8 that harbored the high-yield RRM2, drought-tolerant HS1, herbicide-resistant EPSPS, and insect-resistant Bt as well as the apoptosis-inhibiting iap and gene that promotes cell regeneration p35 were transformed to the receptor Minghui 86 using agrobacterium-based transformation methodology. The receptor, callus culture, agrobacterium concentration, infection time, co-culture, and screening concentrations of G418 and glyphosate were evaluated for the selection. 【Result】 Under same culture conditions, the recovery rate of Minghui 86 immature embryos was significantly higher with a better callus quality than that of the mature embryos. The optimal transformation conditions were determinated to be a bacterial concentration of OD600=0.4-0.6, an infection time of 15-20 m, co-culture for 2-3 d with the addition of sterile filter paper in medium, and the screening concentration of G418 at 150 mg·L-1 and of glyphosate at 800 mg·L-1. The PCR detection confirmed that GUS in the polygenic vector P5 was successfully transferred into Indica cv. Minghui 86.【Conclusion】 The optimized culture conditions afforded significantly improved callus and resistance induction rates in Minghui 86.
Key words: gene; genetic transformation;indica rice;Minghui 86
0 引言
【研究意義】水稻是世界上最重要的粮食作物之一,世界上50%以上的人口以稻米为主食。水稻主要有籼稻和粳稻两大亚种,栽培面积最大的是籼稻[1]。随着分子生物技术的发展,遗传转化技术已经成为水稻遗传改良的重要手段之一[2]。在转基因育种方面,粳稻品种已具有一套高效稳定的遗传转化体系,而籼稻品种的遗传转化体系还不稳定,其转化效率大概在10%左右[3]。因此,进行籼稻品种的多基因遗传转化体系研究,探讨其适宜的转化条件,对籼稻分子育种具有重要的现实意义。【前人研究进展】1986年Baba等[4]采用聚乙二醇(PEG)法将农杆菌与水稻原生质体融合起来,得到了一部分能够合成胭脂碱的胚性愈伤组织,使水稻转基因技术得到了发展。1994年Hiei等[5]建立了农杆菌介导的粳稻遗传转化体系,转化率高达28.6%,至此农杆菌介导的水稻转化取得了初步成功。1998年,Cheng等[6]用农杆菌介导法,将Bt的基因转入水稻,有效控制了水稻病虫害。1999年,项友斌等[7]将改良的Bt基因cryIA(b)和cryIA(c),分别转入水稻愈伤组织,获得转基因植株。随着水稻遗传转化研究的深入发展,在稳定的单基因和双基因转化体系研究的基础上,人们开始尝试多基因转化。Chen等[8]用基因枪法将14个含不同基因的质粒转化到水稻中。冯道荣等[9]将含有2~3个抗真菌基因和2个抗虫基因的多基因表达载体混合,利用基因枪法将它们共同导入到水稻胚性愈伤组织中,发现70%的转基因植株含有6~7个目的基因。目前,基因枪法虽然在多基因转化方面效果较理想,但基因枪法转化费用较高,实际应用受到一定限制。Ye等[10]利用调控前维生素 A或胚乳色素体中番茄红素合成的2个重要植物酶基因psy和crtI,以及标记基因aphⅣ构建了3个表达载体,借助LBA4404农杆菌转化水稻幼胚均获得胚乳中合成β-胡萝卜素的转基因植株,培育了备受关注的黄金水稻。【本研究切入点】在以往的转基因育种中,除了基因枪法外的大多数方法只能转化1~2个基因,对作物改良效果有限。若能在费用不是太高的情况下一次性对多个基因进行共转化,其转化效率将显著提高,不仅省时省力,还能在获得转基因材料的同时获得多个目标性状[11-12]。为此,本研究主要从多基因转化体系转化效率和转化效果的影响因素入手,分别对多基因遗传转化体系的受体材料、农杆菌浓度、侵染时间、共培养方式、G418筛选浓度和草甘膦筛选浓度等主要影响因素进行试验,探讨其适宜的转化条件。【拟解决的关键问题】本研究在实验室前期对籼稻明恢86进行多基因遗传转化的基础上,进一步对其转化条件进行优化,期望建立高效、稳定的多基因遗传转化体系,并获得含高产、抗逆、抗虫、抗病等基因的水稻新材料。
1 材料与方法
1.1 材料
1.1.1 水稻品种
供试水稻品种为杂交水稻籼型恢复系明恢86,由福建省农业科学院水稻国家工程实验室提供。
1.1.2 农杆菌和载体
农杆菌菌株EHA105由福建省农业科学院水稻国家工程实验室保存;多基因表达载体P5、P8 由中国农业大学农业生物技术国家重点实验室王涛教授提供。本研究所用的多基因遗传转化载体P5和P8,包含有作物高产基因RRM2、耐旱基因HS1、抗除草剂基因EPSPS、抗病虫害基因Bt、细胞凋亡抑制基因iap和促细胞再生基因p35等基因。虽然P8载体中包含了P5载体的基因,但是由于两个载体的大小不同,对转化效率也会造成不同影响。为了对比两个载体的转化效果,本试验通过农杆菌介导将P5、P8载体分别转化籼稻明恢86。P5、P8载体示意图如图1。
1.2 方法
1.2.1 受体材料试验
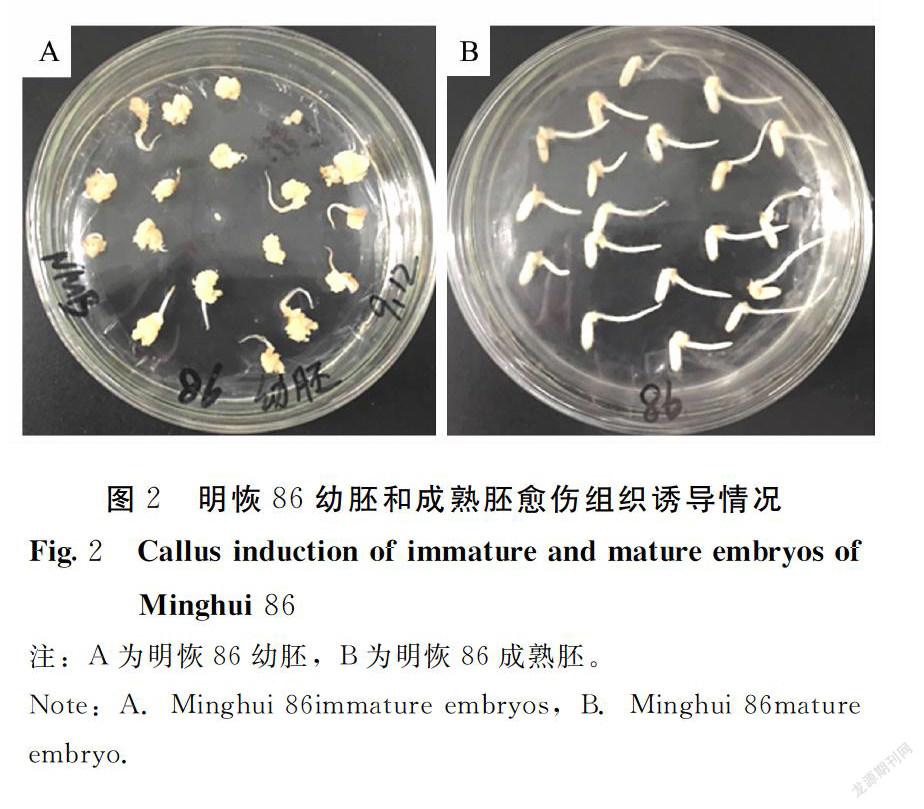
设置2个受体材料处理,即幼胚和成熟胚,每次诱导100粒,做3次重复试验。胚性愈伤组织的诱导及继代方法:挑选状态良好的明恢86幼胚、成熟胚种子,放入灭菌过的三角瓶中。在超净台上先用灭菌水冲洗3~4遍,用75%无水乙醇消毒1~2 min,用20% NaClO溶液消毒20~30 min,再用无菌水冲洗7~8遍,把种子铺在无菌滤纸上吹干。把消毒的种子接到诱导培养基上,28℃、光/暗(16 h/8 h)交替培养。将新长出的亮黄色胚性愈伤组织接到继代培养基上,每隔14 d继代培养1次。
1.2.2 农杆菌侵染浓度试验
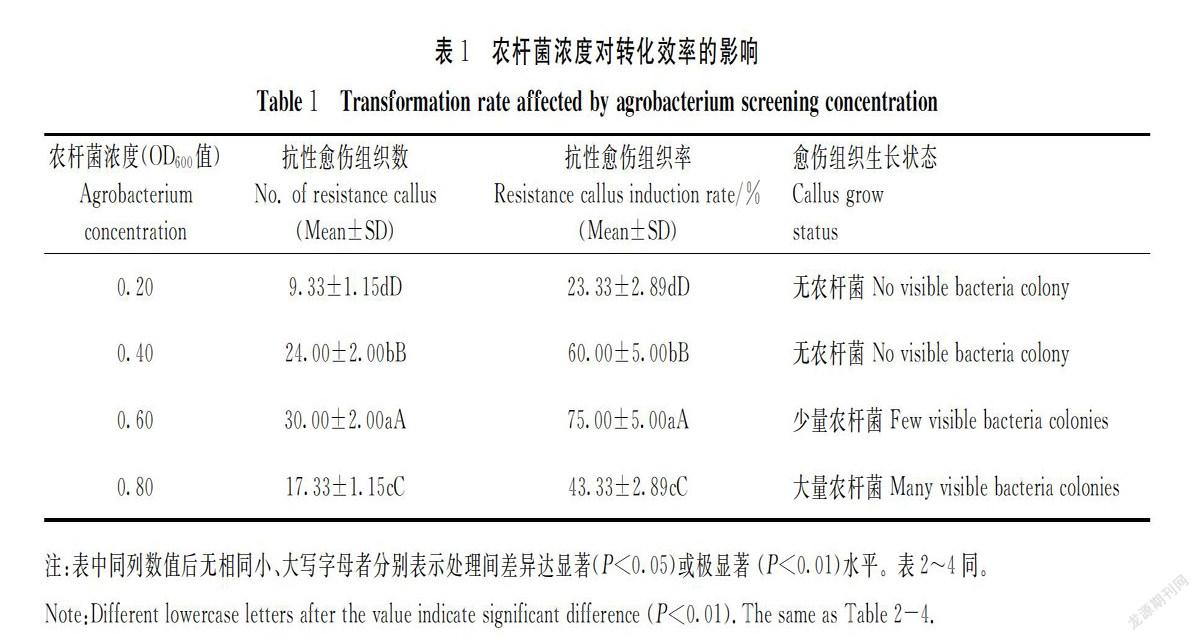
从-80℃冰箱里取出农杆菌菌液,用接种环蘸取农杆菌在LB固体培養基(含50 mg·L-1 Rif和50 mg·L-1Kan)上划线,把培养皿封口倒扣放在28℃暗培养箱中,培养2 d后,肉眼可见 LB固体培养基上长出农杆菌。用移液枪吸取适量的AAM液(乙酰丁香酮浓度100 μmol L-1)在长有农杆菌的LB固体培养基上反复吹打,直到把适量的农杆菌菌落冲洗下来,使农杆菌和AAM液混合。设置5个农杆菌侵染浓度(OD600值分别设为:0.2、0.4、0.6、0.8、1.0)处理,每个浓度处理侵染40个愈伤组织,3次重复。
1.2.3 侵染时间试验
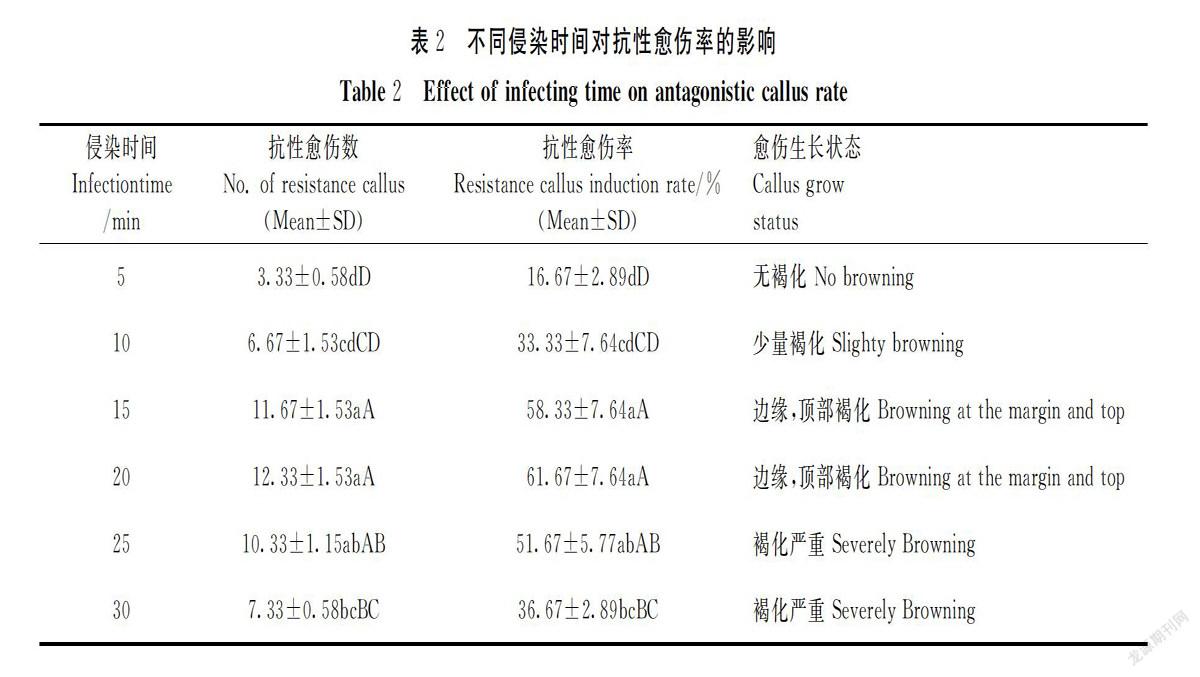
采用经1.2.2试验筛选出的农杆菌侵染浓度OD600值0.4~0.6,将状态良好的预培养愈伤组织挑入农杆菌中,侵染时间梯度设5、10、15、20、30 min等5个处理,每个时间侵染愈伤组织20个,3次重复。在规定的侵染时间内把愈伤组织从农杆菌中取出,并放到灭菌过的滤纸上吹干,最后转接到共培养基上培养。
1.2.4 共培养方式试验
设置2个共培养方式处理(在共培养基上加滤纸和不加滤纸),每个处理培养40个侵染愈伤,3次重复。愈伤组织放置于26℃暗培养箱中,观察2种共培养方式的愈伤组织质量和形态差别,统计其抗性愈伤组织数。
1.2.5 共培养时间试验
设置4个共培养时间处理(1、2、3、4 d),3次重复。把经农杆菌侵染过的愈伤组织,放置于铺有滤纸的共培养基上,培养1、2、3、4 d后转移到含有抗生素的筛选培养基上,培养14 d,统计其抗性愈伤组织数。
1.2.6 标记草甘膦、G418筛选浓度试验
草甘膦设置4个质量浓度处理:400、600、800、1 000 mg·L-1,G418设置4个质量浓度处理:50、100、150、200 mg·L-1,3次重复。挑选出状态良好的明恢86愈伤组织接到不同处理的筛选培养基上,28℃暗培养14 d,观察愈伤组织生长情况。
2 结果与分析
2.1 受体材料的选择
本试验采用明恢86的成熟胚和幼胚来诱导愈伤组织(图2),将幼胚和成熟胚接到相同的培养基和环境中培养,结果幼胚在诱导培养基上诱导2~3 d就能长出愈伤组织,愈伤组织颜色淡黄,质地密实,生长形态良好,出愈率高达100%。而成熟胚出愈时间较长,诱导7~10 d才冒出幼小的愈伤组织,愈伤形态不及幼胚,出愈率50%。虽然成熟胚的取材不受季节和环境的限制,但是如果保存方式不当,种子的活性容易丧失,影响出愈率。总之,幼胚长出愈伤组织的时间早、生长旺盛、质量状态好,且幼胚的出愈率显著高于成熟胚。因此,以下转化条件试验均采用幼胚作为转化受体材料。
2.2 草甘膦对明恢86愈伤组织的致死浓度
将生长状态良好的愈伤组织,接到草甘膦质量浓度分别为400、600、800、1 000 mg·L-1的筛选培养基上,27℃暗培养14 d后观察愈伤组织的生长状态(图3)。经试验观察发现,400和600 mg·L-1处理的愈伤组织在27℃暗培养14 d后仍继续生长,其大小、质地都无明显变化,只是颜色稍显暗黄;800 mg·L-1处理的愈伤组织生长缓慢,色泽暗淡;1 000 mg·L-1处理的愈伤组织全部褐化死亡。试验结果表明,籼稻明恢86愈伤对草甘膦敏感性较差,需使用较高的筛选浓度。因此,用P5载体转化明恢86宜采用800 mg·L-1作为草甘膦筛选浓度。
2.3 G418对明恢86愈伤组织的致死浓度
将生长状态良好的明恢86愈伤组织接到G418质量浓度分别为50、100、150、200 mg·L-1的筛选培养基上,27℃暗培养14 d后观察愈伤组织的生长状态(图4)。经试验观察发现,当G418质量浓度为50 mg·L-1时,愈伤组织仍持续生长;当G418质量浓度为100 mg·L-1时,愈伤组织局部出现褐化;当G418质量浓度为150 mg·L-1时,愈伤组织一边缓慢生长,一边逐渐褐化;当G418质量浓度达到200 mg·L-1时,愈伤组织焦化,无再生愈伤组织。试验结果表明,当G418质量浓度不断升高,愈伤组织逐渐丧失活力,直至全部褐化死亡。因此,P8载体转化明恢86选择用G418质量浓度150 mg·L-1来筛选培养抗性愈伤组织。
2.4 农杆菌浓度对愈伤组织转化率的影响
农杆菌浓度会影响转化效率,农杆菌浓度过高,农杆菌会大量繁殖,愈伤组织会被农杆菌包裹,甚至造成愈伤组织死亡,影响转化效率。反之,农杆菌浓度过低,农杆菌不易吸附在愈伤组织表面,较难得到转化体。本研究表明:当农杆菌浓度OD600为0.2~0.6时,抗性愈伤组织数和抗性愈伤组织率呈上升趋势。当OD600为0.2时,抗性愈伤组织数和抗性愈伤组织率最低;当农杆菌浓度OD600为0.4和0.6时,愈伤组织被农杆菌污染的情况少,抗性愈伤组织率分别为60%和75%;当OD600为0.6时,抗性愈伤组织数和抗性愈伤组织率达到最高值;当OD600为0.8时,抗性愈伤组织数和抗性愈伤组织率下降,大量农杆菌繁殖。以上4个浓度处理的抗性愈伤组织数和抗性愈伤组织率的差异均达到极显著水平(表1)。由此可见,农杆菌浓度OD600为0.4~0.6时,愈伤组织状态好,获得的抗性愈伤组织率较高。
2.5 侵染时间对愈伤组织转化率的影响
侵染时间是影响转化效率的重要因素。侵染时间过短,农杆菌不能充分吸附,T-DNA不能有效整合,抗性愈伤率低;侵染时间过长,愈伤水渍软化,会被毒害死亡。试验结果(表2)表明,当农杆菌侵染愈伤时间为5~10 min时,愈伤组织质量和形态变化不明显,抗性愈伤数和抗性愈伤率的差异均不显著;当农杆菌侵染愈伤时间为15~20 min时,抗性愈伤数和抗性愈伤率比5~10 min时明显升高,差异极显著,而且愈伤组织褐化较少;当农杆菌侵染时间为25~30 min时,抗性愈伤数和抗性愈伤率呈下降趋势;30 min时抗性愈伤数和抗性愈伤率比15~20 min时明显下降,且差異极显著,共培养基上的愈伤组织出现严重的褐化干瘪现象。因此,本试验确定农杆菌的最佳侵染时间为15~20 min。
2.6 共培养方式对愈伤组织转化率的影响
农杆菌菌液在侵染转化愈伤组织时,农杆菌只是黏着在愈伤组织细胞表面上,并没完全渗透到细胞的细胞壁和细胞膜中,共培养才是使 T-DNA整合到受体细胞基因中的主要阶段。试验结果(表3)表明,没加滤纸的共培养处理,抗性愈伤率仅为44%,究其原因是:农杆菌因吸收了培养基上的营养而过度繁殖,从而抑制了抗性愈伤的生长;而加滤纸的共培养处理,抗性愈伤率为76%,显著高于没加滤纸的共培养处理。这是因为加滤纸共培养基的环境干燥,且减少了农杆菌对培养基营养的过度吸收,抑制了农杆菌的生长,有利于抗性愈伤的生长。说明,在共培养基上铺1~2层的灭菌滤纸,能达到较好的转化效果。
2.7 共培养时间对愈伤组织转化率的影响
随着愈伤组织与农杆菌共培养天数的增加,愈伤组织污染率也逐渐增加。共培养时间短,农杆菌不易吸附到愈伤组织上,农杆菌所携带的外源基因也不能完全进入到细胞中,从而降低转化效率。本研究结果(表4)表明,4个共培养时间处理之间的抗性愈伤率的差异均达极显著水平。共培养1 d时,获得抗性愈伤率最低(35.96%);共培养2 d时,愈伤底部稍见少量农杆菌,其抗性愈伤率显著提高,为77.26%;共培养3 d时,愈伤底部聚集了明显的农杆菌,其抗性愈伤率最高,达82.67%;愈伤组织与农杆菌共培养4 d时,农杆菌大量繁殖生长,且抗性愈伤率显著降低,为67.33%。可见,明恢86的愈伤组织与农杆菌共培养的最适宜时间为2~3 d。
2.8 抗性植株的获得及检测
用多基因遗传转化载体P5、P8转化明恢86愈伤组织,获得抗性植株共83株(图5)。其中:用P5载体转化明恢86,获得抗性植株60株;用P8载体转化明恢86,获得抗性植株23株。用CTAB法提取抗性植株的基因组DNA,分别用GUS、RRM、EPSPS、iap、HS等引物进行PCR检测,结果表明:用GUS引物进行PCR检测(图6),P5载体转化明恢86的植株中,有6株抗性植株扩增出相应的目的条带,为阳性植株;但是用EPSPS引物、RRM引物、HS引物、iap引物,分别进行PCR分析,相应的抗性植株并没有扩增出目的条带,因此需要做进一步的确认。而用P8载体转化明恢86,用相应的引物进行PCR分析,未能检测出目的条带,为假阳性植株。
3 讨论与结论
将外源基因转入植物基因组是植物分子生物学和遗传工程的一项基本技术,目前大多数转化技术只是通过转化一个或两个外源基因,来获得和改善植物的性状 [13]。但是单独转化1~2个基因,不仅消耗资源,延长转化周期,对植物体的改良效果不明显[14]。为此,为了满足人们对植物性状改良的迫切需要,实施多基因遗传转化成为植物基因工程发展的必然趋势。
在农杆菌介导的水稻遗传转化中,愈伤组织的生长状态与转化频率直接相关。研究过程中,首先考虑品种的再生性能,良好的愈伤组织状态和具有较强的细胞分裂能力是转化的前提[15-16]。本研究挑选大小为2~3 mm、颜色亮黄、结构密实的籼稻明恢86幼胚愈伤组织进行转化,此时的细胞处于生命活动的旺盛期,接受外源DNA能力强,有助于提高转化效率。
影响农杆菌介导转化的关键因素还包括筛选浓度、农杆菌活性、农杆菌浓度、侵染时间以及共培养条件等。不同基因型的植物对农杆菌的侵染敏感度不同,在其他植物的农杆菌介导遗传转化中,所采用的农杆菌浓度OD600值为0.5~1.0、侵染时间20~40 min、共培养时间2~4 d[17]。陈明利等[18]认为,农杆菌浓度OD600值小于0.5时,即使采用长时间侵染,转化效率也不高。奚亚军等[19]在转化小麦的试验中农杆菌采用的OD600值为1.5,雷江丽等[20]在做中华结缕草Zoysiasinica转化时农杆菌浓度却采用的OD600值为0.9。本研究在前人建立的农杆菌介导转化籼稻的技术体系的基础上,明确了在农杆菌浓度OD600值为0.4~0.6、愈伤组织侵染15~20 min、共培养2~3 d的条件下,可使籼稻明恢86获得了较高的转化效率。
共培养是农杆菌转化过程中的主要环节之一,共培养时间和共培养方式会影响农杆菌的吸附和T-DNA的转移[21]。与传统的共培养方式相比,侵染后的愈伤组织在铺有滤纸的共培养基上,其转化效率高,说明干燥的培养环境更有利于农杆菌对愈伤组织的侵染和转化[22-23]。在遗传转化筛选的过程中,培养基筛选是针对筛选标记基因进行的,因此只要筛选浓度合适,在筛选培养基上获得的抗性植株就基本上为转基因植株[24-25]。由于明恢86的愈伤组织对草甘膦、G418质量浓度不是特别敏感,只有提高筛选浓度,愈伤状态才会有显著的变化。通过筛选梯度试验,多基因载体P5转化籼稻明恢86选择的草甘膦质量浓度为800 mg·L-1;多基因载体P8转化籼稻明恢86选择的G418质量浓度为150 mg·L-1。
高效、稳定的遗传转化体系是农杆菌介导转化成功的关键。本试验通过对农杆菌介导转化的愈伤诱导率、农杆菌侵染浓度、农杆菌侵染时间、共培养方式、G418和草甘膦筛选浓度等相关因素的研究,使籼稻明恢86愈伤组织的诱导愈伤率和抗性愈伤率得到提高。多基因表达载体P5、P8,遗传转化籼稻明恢86,共获得了83株抗性植株。通过提取抗性植株的DNA,用GUS、RRM、EPSPS、iap、HS等基因特异引物进行PCR检测,结果表明:多基因载体P5中的GUS基因已经转入明恢86,且有6株抗性植株为阳性植株;多基因载体P8未有基因转入籼稻明恢86,为假阳性植株。本研究结果验证了多基因遗传转化是可行的,也是极其不稳定的。一次多基因遗传转化会出现基因缺失现象,随着插入区域基因越多,插入片段越长,转化过程中DNA片段断裂与缺失的现象就越严重,最终影响转化效果。针对多基因转化DNA片段断裂与缺失的现象,今后将尝试减少基因数量或进行单基因的多次转化等方法,以减少这种现象的发生。
参考文献:
[1]王维旭,张骥诚,刘学群,等.籼稻品种Kasalath遗传转化条件的研究[J].安徽农业科学,2010,38(4):1735-1737,1856.
WANG W X,ZHANG J C,LIU X Q, et al.Study on the Factors of Genetic Transformation for Indica Rice Kasalath[J]. Journal of Anhui Agri.Sci.2010,38(4):1735-1737,1856. (in Chinese)
[2]柳红.籼稻高效遗传转化体系的建立[D].福州:福建农林大学,2009:1-75.
LIU H.Establishment of Indica efficient genetic transformationsystem[D].Fuzhou:Fujian Agriculture and Forestry University,2009:1-75. (in Chinese)
[3]向陽,赵德刚,朱冬雪,等.籼稻成熟胚愈伤组织诱导及不定芽分化[J].山地农业生物学报,2004,23(3):193-197.
XIANG Y,ZHAO D G,ZHU D X,et al.Indica rice matureembryo callus induction and adventitious bud differentiation[J].J Mountain Agric Biol,2004,23(3):193-197. (in Chinese)
[4]BABA A,HASEZAWA S,SYONO K,et al. Cultivation of riceprotoplasts and their transformation mediated by Agrobacterium spheroplasts[J]. Plant Cell Physiol,1986,27:463-468.
[5]HIEI Y,OHTA S,KOMARI T,et al. Efficient transformation of rice (Oryza sativa L.). mediated by Agrobacterium and sequence analysis of the boundaries of the T-DNA[J]. Plant J,1994(6):271-282.
[6]CHENG X,SARDANA R,KAPLAN H,et al.Agrobacterium-transformed rice plants expressing syntheticcryIA(a) and cry IA(c) genes are highly toxic to striped stem borer and yellow stem borer[J]. Proc Natl Acad Sci USA,1998,95:2767-2772.
[7]项友斌,梁竹青,高明尉,等.农杆菌介导的苏云金杆菌抗虫因cryIA(b)和cryIA(c)在水稻中的遗传转化及蛋白表达[J].生物工程学报,1999,15 (4):494-500.
XIANG Y B,LIANG Z Q,GAO M W,et al.Agrobacterium mediated Transformation of Insecticidal BacillusthuringiensiscryIA(b) and cryIA(c) Genes and Their Expression in Rice Chinese Journal of Biotechnology[J]. Journal of Bioengineering,1999,15 (4):494-500. (in Chinese)
[8]CHEN L,MARMEY P,TAYLOR N J,et al. Expression and inheritance of multiple transgenes in rice plants[J]. Nature Biotechnology,1998,16:1060-1064.
[9]冯道荣,许新萍,邱国华,等.多个抗病抗虫基因在水稻中的遗传和表达[J].科学通报,2000,45(15):1593-1599.
FENG D R,XU X P,QIU G H,et al.Inheritance and expression of multiple disease resistance and insect resistance genes in rice[J].Chinese Science Bulletin,2000,45 (15):1593-1599. (in Chinese)
[10]YE X,AL-BABILI S,KLOTI A,et al. Engineering the provitamin A (β-Carotene)biosynthetic pathway into (Carotenoid-free) rice endosperm[J].Science,2000,287:303-305.
[11]李宝健,朱华晨.论应用多基因转化策略综合改良生物体遗传性研究方向的前景[J].中山大学学报, 2005, 44(4):79-83.
LI B J, ZHU H C.Prospects for the application of multi-gene transformation strategies to comprehensively improve the genetic research direction of organisms[J].Journal of Sun Yat-sen University,2005, 44(4):79-83. (in Chinese)
[12]王慧中,黄大年,鲁瑞芳.转 mt1D/gutD双价基因水稻的耐盐性[J].科学通报, 2000, 45(7):724-728.
WANG H Z,HUANG D N,LU R F.Salt tolerance of transgenic rice with mt1D/gutD[J].Chinese Science Bulletin, 2000, 45(7):724-728. (in Chinese)
[13]朱永興,曹鹏,许兴,等.多基因表达载体KCTB转化宁夏枸杞的研究[J].中国科学通报,2010,26(9):74-77.
ZHU Y X,CAO P,XU X,et al.The Transformation of Multigene Expressed Vector for Lyciumbarbarum L.[J].Chinese Agricultural Science Bulletin,2010,26(9):74-77. (in Chinese)
[14]朱丽,傅亚萍,刘文真,等.利用共转化和花药培养技术快速获得无选择标记的三价转基因水稻[J].中国水稻科学, 2007,21(5):475-481.
ZHU L,FU Y P,LIU W Z,et al.Rapidly obtaining trivalent transgenic rice without selection marker by co-transformation and anther culture techniques[J].Chinese Rice Science,2007,21(5):475-481. (in Chinese)
[15]CAO M X, HUANG J Q, WEI Z M, et al. Agrobacterium-mediated multiple-gene transformation in rice using a single vector[J]. J IntegrPlantBiol, 2005, 47(2):233-242.
[16]NAQVI S,FARRE G,SANAHUJA G,et al.When more is better:multigene engineering in plants[J].Trends Plant Sci,2010,15 (1):48-56.
[17]凌键,陈永文,龚一富,等.甘薯离体遗传转化体系的优化[J].西南师范大学学报(自然科学版),2004,29(3):466-470.
LING J,CHEN Y W,GONG Y F,et al.Optimization of system for in vitro genetic transformation in sweetpotato[J].Journal of Southwest China Normal University (Natural Science Edition),2004,29(3):466-470. (in Chinese)
[18]陈明利,刘香利,唐广立,等.农杆菌侵染小麦的优化方案[J].分子植物育种,2007,5(4):577-582.
CHEN M L,LIU X L,TANG G L,et al.Optimization of Agrobacterium infecting Wheat[J].Molecular plant breeding,2007,5(4):577-582. (in Chinese)
[19]奚亚军,张启发,林拥军,等.利用农杆菌浸种法将叶片衰老抑制基因PSAG12-IPT导入普通小麦的研究[J].中国农业科学,2004,37(8):1235-1238.
XI Y J,ZHANG Q F,LIN Y J, et al.Introduction of Leaf Aging Inhibitory Gene PSAG12-IPT into Common Wheat by Agrobacterium Soaking[J].Chinese Agricultural Science,2004,37(8):1235-1238. (in Chinese)
[20]雷江麗,王丹,吴燕民,等.农杆菌浸种法介导中华结缕草遗传转化体系的建立[J].农业生物技术学报,2009,17(5):865-871.
LEI J L,WANG D,WU Y M,et al.Agrobacterium tumefaciens seed soaking method mediates the establishment of genetic transformation system of Zoysia japonica[J].Journal of Agricultural Biotechnology,2009,17(5):865-871. (in Chinese)
[21]田文忠.提高籼稻愈伤组织再生频率的研究[J].遗传学报,1994,3(5):27-31.
TIAN W Z.Study on the Improve of Regeneration Frequency of Mature Embryo-derived indica Rice Callus[J].J Genet Genom,1994,3(5):27-31. (in Chinese)
[22]CHENG M,HU T,JEAMME L,et al.Desiccation of plant tissue post-Agrobacterium infection enhances T-DNA delivery and in creases stable transformation efficiency in wheat[J].In Vitro Cell Dev Biol Plant,2003,39:595-604.
[23]马艳丽,叶兴国,刘艳鹏,等.农杆菌敏感小麦基因型的筛选研究[J].麦类作物学报,2005,25(6):6-10.
MA Y L,YE X G,LIU Y P,et al. Screening of wheat genotype sensitive to Agrobacterium tumefaciens infection[J].Journal of Triticeae Crops,2005,25(6):6-10. (in Chinese)
[24]王文治,蔡文伟,冯翠莲,等.高效快速甘蔗转基因方法探索[J]. 热带作物学报, 2012, 33(9):1619-1624.
WANG W Z,CAI W W,FENG C L,et al.Exploring the method of high efficient and rapid sugarcane transgenic[J].Journal of Tropical Crops , 2012, 33(9):1619-1624. (in Chinese)
[25]项友斌,梁竹青,高明尉,等.农杆菌介导的苏云金杆菌抗虫因cryIA(b)和cryIA(c)在水稻中的遗传转化及蛋白表达[J].生物工程学报,1999,15 (4):494-500.
XIANG Y B,LIANG Z Q,GAO M W,et al.Agrobacterium mediated Transformation of Insecticidal BacillusthuringiensiscryIA(b) and cryIA(c) Genes and Their Expression in Rice[J].Chinese Journal of Biotechnology,1999,15 (4):494-500. (in Chinese)
(责任编辑:杨小萍)

