三物白散对Survivin-RNA基因沉默转染胃癌SGC-7901细胞凋亡、迁移的影响
范婧莹 娄余 张娜 彭瑶 朱莹

〔摘要〕 目的 探討三物白散对Survivin-RNA基因沉默转染胃癌SGC-7901细胞凋亡、迁移的影响。方法 将实验分成6组:空白对照组、LV-RNAi 组、Survivin-RNAi-LV组、空白对照+中药组、LV-RNAi+中药组、Survivin-RNAi-LV+中药组;采用流式细胞仪检测各组细胞的凋亡,划痕实验检测各组细胞的迁移能力。结果 细胞凋亡率:Survivin-RNAi-LV组明显高于空白对照组和LV-RNAi组(P<0.05);Survivin-RNAi-LV+中药组与空白对照+中药组、LV-RNAi+中药组比较明显较高(P<0.05);Survivin-RNAi-LV+中药组高于Survivin-RNAi-LV组,差异具有统计学意义(P<0.05)。胃癌细胞的24 h迁移率:Survivin-RNAi-LV组明显低于空白对照组和LV-RNAi组(P<0.05);Survivin-RNAi-LV+中药组与空白对照+中药组、LV-RNAi+中药组比较,其结果明显低于后两组(P<0.05);Survivin-RNAi -LV+中药组与Survivin-RNAi-LV组比较,细胞迁移率明显降低,差异有统计学意义(P<0.05)。结论 Survivin基因沉默转染,增强了三物白散诱导胃癌SGC-7901细胞凋亡和抑制其迁移的作用。
〔关键词〕 Survivin;三物白散;胃癌;细胞凋亡;迁移
〔中图分类号〕R285.5;R735.2 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.08.002
〔Abstract〕 Objective To investigate the effects of Sanwubai Powder on apoptosis and migration of gastric cancer SGC-7901 cells transfected with Survivin-RNA gene silencing. Methods The experiment was divided into 6 groups: a blank control group, a LV-RNAi group, a Survivin-RNAi-LV group, a blank control group + TCM group, a LV-RNAi + TCM group, a Survivin-RNAi -LV + TCM group. The cell apoptosis was observed by flow cytometry, and the cell migration was assessed by cell scratch experiment. Results The apoptotic rate of the Survivin-RNAi -LV group was significantly higher than that of blank control group and LV-RNAi group (P<0.05); The apoptosis rate of the Survivin-RNAi-LV + TCM group was significantly higher than that of the blank control group + TCM group and the LV-RNAi + TCM group (P<0.05); The Survivin-RNAi-LV+ TCM group was higher than the Survivin-RNAi-LV group, and the difference was statistically significant (P<0.05). The 24 hour cell migration rate in the Survivin-RNAi -LV group was significantly lower than that in the blank control group and the LV-RNAi group (P<0.05). The Survivin-RNAi -LV + TCM group was significantly lower than that of the blank control group + TCM group and the LV-RNAi + TCM group (P<0.05); Compared with the Survivin-RNAi-LV group, the cell migration rate of the Survivin-RNAi-LV + TCM group was significantly decreased, and the difference was statistically significant (P<0.05). Conclusion After Survivin gene silencing transfection, the sensitivity of SGC-7901 cells to Sanwubai Powder was significantly enhanced, which further promoted the apoptosis of SGC-7901 cells and inhibited their migration.
〔Keywords〕 Survivin; Sanwubai Powder; gastric cancer; apoptosis; migration
胃癌是常见的消化道恶性肿瘤之一,其高发病率及死亡率严重威胁了人类的健康。我国是胃癌的高发区,胃癌的发病例数和死亡例数分别占全球胃癌发病和死亡的42.6%和45.0%[1]。中医药对肿瘤有着明确的治疗效果,且毒副作用小,但与常规化疗药物相比,中药抗肿瘤的效果一般[2],寻找新的途径提高中药的抗肿瘤效果,具有重要的研究意义。我们前期研究发现[3-4],三物白散可抑制胃癌细胞的增殖,诱导其凋亡,其机制可能与抑制Survivin的表达有关。RNA干扰(RNA interference, RNAi)是抑制靶基因表达的核酸操作技术,广泛应用于肿瘤基因治疗的研究[5-6]。有研究发现,胃癌MGC-803细胞经Cdx2基因沉默转染后,对人参黄芪复方的敏感性明显增强,进而促进了胃癌细胞的凋亡等[2]。因此,本实验拟通过RNA干扰Survivin基因沉默,观察三物白散对Survivin基因沉默的胃癌SGC-7901细胞凋亡、迁移的影响,以期通过干预基因的表达增强中药对胃癌细胞的作用效果。
1 材料
1.1 细胞株及慢病毒
人胃癌细胞SGC-7901购自上海吉凯基因技术有限公司,Survivin基因沉默的重组慢病毒颗粒由上海吉凯基因技术有限公司构建。
1.2 动物
SPF级雄性SD大鼠,体质量180~220 g,由湖南斯莱克景达实验动物有限公司提供(动物合格证号:43004700030743),饲养于湖南中医药大学动物实验中心[场地许可证号:SKY(湘)2013-0005],本实验经湖南中医药大学动物伦理委员会同意,符合实验动物伦理学规定。
1.3 药物
根据本课题组前期研究[7],三物白散混悬液由巴豆霜(含10%油)、浙貝母、桔梗以1∶3∶3组成,所需饮片购自湖南中医药大学第二附属医院中药房。
1.4 主要试剂及仪器
DMEM培养基、PBS冲洗液(Hyclone公司);胰蛋白酶(北京索莱宝科技有限公司);胎牛血清(杭州四季青公司);二甲基亚砜(DMSO,AMRESCO公司);Puromycin(Clontech公司);D-Hanks(上海吉凯基因技术有限公司);Annexin-FITC/PI 细胞凋亡检测试剂盒(eBioscience公司)。SW-CJ-2FD双人单面净化工作台(苏州净化设备有限公司);HERAcell 150iCO2培养箱贺利氏(赛默飞世尔公司);DW-HL3985超低温冰箱(中科美菱低温科技股份有限公司);倒置显微镜(日本Olympus公司);Guava easyCyte HT流式细胞仪(默克密理博)等。
2 方法
2.1 三物白散含药血清制备
将20只SD雄性大鼠随机分为空白组和三物白散组,按0.07 g/kg剂量灌胃,1次/d,采用“通法”灌药,连灌7 d;空白组灌胃给予等体积生理盐水。于末次给药后1 h后,腹主动脉采血,4 ℃下静置4 h,3 000 r/min离心20 min,分离血清。经56 ℃水浴锅灭活30 min及0.22 μm微孔滤膜无菌过滤后,置于-20 ℃冰箱保存备用。
2.2 细胞培养
将SGC-7901细胞培养于含10%胎牛血清的DMEM培养基中,置于37 ℃、含5% CO2的恒温培养箱中常规培养。至细胞生长至70%~80%传代,取对数生长期细胞用于实验。
2.3 慢病毒颗粒转染人胃癌SGC-7901细胞
取处于对数生长期的细胞经胰酶消化,如完全培养基制成(3~5)×104个/mL细胞悬液,按2 mL/孔接种于6孔板,继续培养保证转染时铺板量达到15%~30%左右。将SGC-7901细胞分为3组:空白对照组、LV-RNAi 组(阴性对照空载体慢病毒颗粒转染细胞组)、Survivin-RNAi-LV组(Survivin基因沉默慢病毒颗粒转染细胞组)。每组设3个复孔,在细胞密度达到20%、MOI值为10时,用含有5 μg/mL polybrene的1 mL新鲜培养基替换原培养基,在LV-RNAi组加入4 μL/孔病毒,Survivin-RNAi-LV组加入6.67 μL/孔病毒,空白对照组无特殊处理。转染后16 h更换为常规培养基继续培养,中途可对细胞换液,保持细胞活性。转染后72 h,荧光显微镜下观察转染细胞中Survivin的表达情况,转染效率达到80%,转染后细胞状态正常,进行后续实验。
2.4 流式细胞仪检测各组细胞的凋亡
(1)慢病毒转染后对SGC-7901细胞凋亡的影响,分3组:空白对照组、LV-RNAi组、Survivin-RNAi-LV组。(2)慢病毒转染后加上三物白散含药血清干预对SGC-7901细胞凋亡的影响,分为3组:空白对照+中药组、LV-RNAi+中药组、Survivin-RNAi-LV+中药组。将以上6组细胞悬液以5×104个/孔分别相应地接种到6孔板中,每组设3个复孔,常规培养。12 h后,弃培养基,前3组每孔加入DMEM培养基2 mL,后3组每孔加入含5%含药血清的培养基2 mL,继续培养48 h。用胰酶消化各组细胞,完全培养基重悬成细胞悬液,离心收集细胞;经Annexin V-FITC/PI染色后,流式细胞仪检测各组SGC-7901细胞的凋亡率。
2.5 划痕实验检测各组细胞的迁移能力
(1)慢病毒转染后对SGC-7901细胞迁移能力的影响,分为3组:空白对照组、LV-RNAi组、Survivin-RNAi-LV组。(2)慢病毒转染后加上三物白散含药血清干预对SGC-7901细胞迁移能力的影响,分为3组:空白对照+中药组、LV-RNAi+中药组、Survivin-RNAi-LV+中药组。将以上6组的细胞悬液以3×104个/孔分别相应地接种到96孔板中,每组设5个复孔,每孔培养基100 μL,6个组均37 ℃培养24 h。第2天细胞达到90%以上融合度,使用划痕仪对准96孔板的下端中央部位,向上轻推形成划痕;使用无血清DMEM培养基轻轻漂洗2~3遍,前3组每孔加入DMEM培养基100 μL,后3组每孔加入含5%含药血清的DMEM培养基100 μL,于37 ℃、5% CO2培养箱培养,选择0、8、24 h在荧光显微镜拍照,计算各组细胞迁移率。
2.6 统计学分析
采用SPSS 20.0进行统计分析,所有数据均以“x±s”表示,并进行正态性及方差齐性检验,符合正态性以及方差齐性则使用单因素方差分析,如不满足,则行秩和检验。P<0.05 时判定差异有显著性。
3 结果
3.1 细胞培养及传代
选取分裂活跃,代谢旺盛的对数生长期的SGC-7901细胞用作后续实验。见图1。
3.2 慢病毒转染人胃癌SGC-7901细胞
将人胃癌SGC-7901细胞取MOI值为10进行慢病毒转染,转染效率可达到80%,转染72 h后,LV-RNAi组与Survivin-RNAi-LV組均可见绿色荧光,空白对照组未见荧光。见图2。
3.3 各组对胃癌SGC-7901细胞凋亡的影响
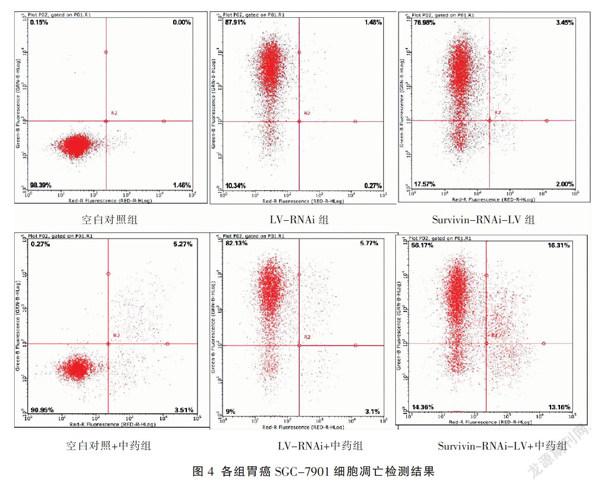
流式细胞仪检测结果表明,Survivin-RNAi-LV组的细胞凋亡率明显高于空白对照组和LV-RNAi组,差异有统计学意义(P<0.05);Survivin-RNAi-LV+中药组的细胞凋亡率与空白对照+中药组、LV-RNAi+中药组比较,差异有统计学意义(P<0.05);Survivin-RNAi-LV组与Survivin-RNAi-LV+中药组比较,差异具有统计学意义(P<0.05)。见图3-4。
3.4 各组对胃癌SGC-7901细胞迁移的影响
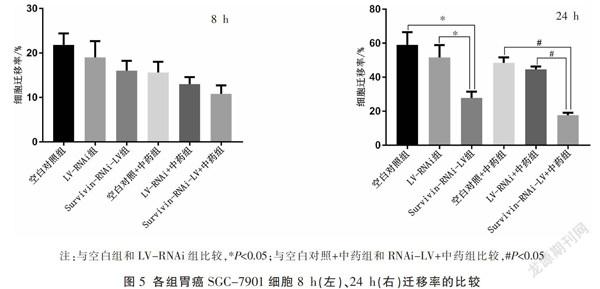
划痕实验检测各组细胞的迁移能力,得到不同拍照时间点的细胞迁移率。结果发现:胃癌细胞的8 h迁移率各组间比较均无统计学意义;胃癌细胞的24 h迁移率:(1)Survivin-RNAi-LV组明显低于空白对照组和LV-RNAi组,差异有统计学意义(P<0.05);(2)Survivin-RNAi-LV+中药组与空白对照+中药组、LV-RNAi+中药组比较,其结果明显低于后两者,差异有统计学意义(P<0.05);(3)Survivin-RNAi-LV+中药组与Survivin-RNAi-LV组比较,细胞迁移率明显降低,差异有统计学意义(P<0.05)。见图5-6。
4 讨论
中医学认为胃癌的发生发展过程中,其病机普遍都伴随着寒凝、痰结、毒积、血瘀的病理特点,因而运用具有温下攻逐作用的加味三物白散治疗进展期胃癌,取得了一定的临床疗效[8]。三物白散出自《伤寒论·太阳病脉证并治》第141条:“寒实结胸,无热证者,与三物白散”。原方由巴豆、浙贝母、桔梗三物组成,方中巴豆辛热有毒,有温通寒实,攻逐痰水之功,贝母有止咳化痰,清热散结之用,桔梗有开肺散结祛痰之效。三药合用,能散寒而除实,共奏温下逐瘀,化痰散结之功。有研究表明,三物白散可以抑制胃癌细胞增殖,通过阻滞细胞有丝分裂,诱导细胞凋亡,降低胃癌细胞P53、RasP21等基因的表达率,逆转胃癌细胞多药耐药性,防止胃癌复发转移[9]。
胃癌的发生发展是一个多因素、多步骤和多阶段的复杂过程,需要众多基因的参与[10]。Survivin是凋亡蛋白抑制因子家族(inhibitor of apoptosis proteins,IAPs)成员,具有最强的凋亡抑制作用,其在正常胃黏膜中的表达呈缺失状态,胃癌细胞系呈过表达状态,且因其独特的分子结构及生物学功能,参与抑制细胞凋亡、细胞有丝分裂和新生血管的生成[11];再者,高表达的Survivin基因使得肿瘤对化疗药物的敏感性降低[12],故而Survivin已成为肿瘤基因治疗的研究热点。已有研究发现沉默Survivin基因的表达可增加肿瘤细胞对5-氟尿嘧啶的化疗敏感性[13]。而Survivin基因沉默后能否增加胃癌细胞对中药复方三物白散的敏感性,以增强三物白散对胃癌细胞的增殖抑制及诱导凋亡等作用,尚未见相关报道。因此,本实验拟通过RNA干扰Survivin基因沉默转染胃癌SGC-7901细胞,观察三物白散对干预后的胃癌细胞凋亡、迁移的影响,为研究提高三物白散抗胃癌的治疗效果提供理论依据。
本研究结果显示,Survivin基因沉默促进了胃癌细胞的凋亡并抑制其迁移,再经三物白散处理后(Survivin-RNAi-LV+中药组)与单用中药三物白散(空白对照+中药组)或仅抑制Survivin基因的表达(Survivin-RNAi-LV组)比较,其促进细胞凋亡、抑制细胞迁移能力显著升高。因此,RNA干扰Survivin基因沉默转染胃癌细胞,可增强胃癌细胞对三物白散的敏感性,提高了对胃癌细胞诱导凋亡、抑制迁移的作用。其作用机制极可能与Survivin有着强大的抗凋亡作用有关,其可直接作用于Caspase,抑制Caspase-3及Caspase-7的活性,阻断细胞的凋亡过程[14],而凋亡抑制及相关细胞凋亡抑制基因的表达能够引起多药耐药的产生[15]。当然,亦可能存在其他的作用机制,Survivin参与肿瘤新生血管的生成,与血管内皮生长因子(vascular endothelial growth factor, VEGF)关系密切。VEGF是目前发现的功能最强的调控血管生成的效应因子,已成为肿瘤生长的药物靶点之一,而Survivin可调控VEGF抑制血管内皮细胞的凋亡,促进血管生成,为肿瘤的生长和侵袭提供所需的营养物质[16]。
综上所述,RNA干扰Survivin基因沉默后,三物白散对人胃癌细胞的诱导凋亡、抑制迁移的作用显著增强,其机制极可能是Survivin基因的表达下调,凋亡抑制作用降低,增加了肿瘤细胞对药物的敏感性;亦可能因Survivin与EVGF表达的正相关性,当Survivin基因的表达下调,增加了血管内皮细胞的凋亡,抑制了肿瘤血管的生成,提高了药物的疗效。因此,还需进一步深入研究探讨其作用。
参考文献
[1] FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. International journal of Cancer,2015,136(5):E359-386.
[2] 韦尉元,吴 锟,王晓通,等.Cdx2-RNA基因沉默转染胃癌MGC-803细胞对中药人参黄芪复方药物敏感性的影响[J].广东医学,2013,
34(7):994-998.
[3] 邹君君,朱 莹.三物白散对人胃癌SGC-7901细胞增殖、凋亡的影响[J].中国中医急症,2011,20(5):749-750,761.
[4] 李擎虎,朱 莹,邹君君.三物白散对胃癌SGC-7901细胞凋亡及survivin基因表达的影响[J].中国中医信息杂志,2012,19(10):35-37.
[5] LIU A H, HE A B, TONG W X, et al. Prognostic significance of Livin expression in nasopharyngeal carcinoma after radiotherapy[J]. Cancer Radiother, 2016,20(5):384-390.
[6] KIRAZ Y, ADAN A, KARTAL YANDIM M, et al. Major apoptotic mechanisms and genes involved in apoptosis[J]. Tumour Biology, 2016,37(7):8471-8486.
[7] 邹君君.三物白散对人胃癌SGC-7901细胞增殖、凋亡的影响[D].长沙:湖南中医药大学,2010.
[8] 朱 莹,袁伟建,张晓江,等.加味三物白散方治疗进展期胃癌临床研究[J].中国中医急症,2010,19(4):578-580.
[9] 濮文渊,孙松娴,凌 云,等.《伤寒论》三物白散抗肿瘤作用研究进展[J].中华中医药杂志,2017,32(1):225-227.
[10] TAN P, YEOH K G. Genetics and molecular pathogenesis of gastric adenocarcinoma[J]. Gastroenterology, 2015,149(5):1153-1162.
[11] 李 丹,劉延庆.Survivin与胃癌的中西医研究进展[J].中国实验方剂学杂志,2018,24(19):141-147.
[12] SUN X P, DONG X, LIN L, et al. Up-regulation of surviving by AKT and hypoxia-inducible factor-1?琢 contributes to cisplatin resistance in gastric cancer[J]. FEBS Journal,2014,281(1):115-28.
[13] 牛朝霞,彭蕤蕤,陈 洁,等.靶向survivin基因的小干扰RNA对食管癌细胞Eca-109化疗敏感性的影响[J].安徽医药,2016,20(6):683-686.
[14] PORE M M, HILTERMANN T J, KRUYT F A. Targeting apoptosis pathways in lung cancer[J]. Cancer Lett,2013,332(2):359-368.
[15] KOMSHI T, SASAKI S, WATANABE T, et al. Exogenous expression of hRFI induces multidrug resistance though escape from apoptosis in eolorectal cancer cells[J]. Anti-cancer Research, 2005,25(4):2737-2741.
[16] 黄妙灵,蔡兴东,黄志宏,等.VEGF和Survivin在肺腺癌中的表达及意义[J].广东医学,2018,39(12):1800-1805.

