益气解毒方对鼻咽癌CNE2细胞增殖的影响
胡晶 刘洁 徐冰雁 范婧莹 罗晶婧 胡梅 何迎春
〔摘要〕 目的 研究益氣解毒方抑制鼻咽癌CNE2细胞增殖的效应。方法 采用实时无标记细胞功能分析技术(real-time unlabeled cell function analysis technique, RTCA)动态监测不同浓度(0.125、0.250、0.500、1.000 mg/mL的益气解毒方水提物对人鼻咽癌CNE2细胞增殖的影响;采用CCK-8法检测不同浓度益气解毒方水提物对人鼻咽癌CNE2细胞增殖能力的影响;通过高通量细胞成像多功能检测系统Cytation5监测不同浓度益气解毒方水提物对鼻咽癌CNE2细胞增殖形态的影响;采用Western Blot技术检测不同浓度益气解毒方水提物对鼻咽癌CNE2细胞增殖相关蛋白Survivin、XIAP、PCNA表达的影响。结果 RTCA 和 CCK-8 法实验结果显示,与空白对照组比较,益气解毒方水提物可以明显抑制鼻咽癌CNE2细胞的增殖,而且随着益气解毒方水提物的作用时间越长,其抑制效应越显著(P<0.05);Cytation5结果显示,与空白对照组比较,不同浓度益气解毒方水提物处理CNE2细胞后,细胞形态发生了明显变化,且浓度越高,作用时间越长,细胞膜皱缩,细胞核质浓缩、破碎更明显;Western Blot结果显示,与空白对照组比较,益气解毒方水提物能明显抑制CNE2细胞中增殖相关蛋白Survivin、XIAP、PCNA的表达(P<0.05)。结论 益气解毒方水提物能明显抑制鼻咽癌细胞增殖,该效应与其抑制增殖相关蛋白Survivin、XIAP、PCNA的表达有关。
〔关键词〕 益气解毒方;鼻咽癌;细胞增殖;Survivin;XIAP;PCNA
〔中图分类号〕R285.5;R739.63 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.08.003
〔Abstract〕 Objective To study the inhibitory effects on the proliferation of human nasopharyngeal carcinoma CNE2 cells with Yiqi Jiedu Formula. Methods Real-time unlabeled cell function analysis technique (RTCA) was used to dynamically monitor the effects of different concentrations (0.125 mg/mL, 0.25 mg/mL, 0.5 mg/mL, 1.0 mg/mL) of Yiqi Jiedu Formula water extract on the proliferation of human nasopharyngeal carcinoma CNE2 cells; CCK-8 assay was used to detect the effects of different concentrations of water extract of Yiqi Jiedu Formula on the proliferation of human nasopharyngeal carcinoma CNE2 cells; the effects of drugs on the proliferation and morphology of nasopharyngeal carcinoma CNE2 cells were monitored by high throughput cell imaging multifunctional detection system Cytation5; Western Blot technique was used to detect the effect of drugs on the expression of proliferation-related proteins Survivin, XIAP and PCNA in nasopharyngeal carcinoma CNE2 cells. Results The results of RTCA and CCK-8 showed that the water extract of Yiqi Jiedu Formula could significantly inhibit the proliferation of nasopharyngeal carcinoma CNE2 cells compared with the blank control group, and the longer the action time of the water extract of Yiqi Jiedu Formula, the more significant the inhibitory effect was (P<0.05); Cytation5 results showed that compared with the blank control group, the morphology of CNE2 cells treated with different concentrations of Yiqi Jiedu Formula water extract changed, and the higher the concentration, the longer the action time was. The shrinkage of cell membrane, and the concentration and fragmentation of nucleoplasm were more obvious; The results of Western Blot showed that compared with the blank control group, the water extract of Yiqi Jiedu Formula could significantly inhibit the expression of proliferation-related proteins Survivin, XIAP and PCNA in CNE2 cells (P<0.05). Conclusion Yiqi Jiedu Formula can significantly inhibit the proliferation of nasopharyngeal carcinoma cells, which is related to the inhibition of the expression of proliferation-related proteins Survivin, XIAP and PCNA.
〔Keywords〕 Yiqi Jiedu Formula; nasopharyngeal carcinoma; cell proliferation; Survivin; XIAP; PCNA
鼻咽癌(nasopharyngeal carcinoma, NPC)是目前比較常见的头颈部恶性肿瘤,在南方的发病几率比较高[1],其发病与遗传因素、EB病毒感染、环境影响等关系密切[2-3],目前公认鼻咽癌的有效治疗方法为放疗、化疗,但放化疗有其固有的局限性,如敏感性降低、放疗后的不良反应大、复发甚至转移等[4],寻求一种更加安全高效的诊疗方式是耳鼻咽喉科医生在临床治疗中迫切需要解决的问题。益气解毒方(以下简称YQ)是湖南中医药大学第一附属医院田道法教授依据临床经验创立的经验方,能够有效减轻放疗化疗所带来的副反应[5]。前期体内外实验研究表明,该方能够有效抑制人鼻咽癌不同分化类型细胞株,如5-8F、6-10B、CNE1、CNE2、HNE1等细胞的增殖、迁移,并具有诱导其凋亡的效应[6-10]。
本研究选取CNE2细胞株,从增殖、形态变化方面观察益气解毒方水提物对鼻咽癌CNE2细胞增殖效应的影响,通过实时无标记细胞功能分析技术(real-time unlabeled cell function analysis technique, RTCA)和CCK-8法检测益气解毒方水提物在不同时间点对CNE2细胞的抑制增殖效应,采用Cytation5动态监测益气解毒方水提物对CNE2细胞形态变化的影响,最后用Western Blot检测益气解毒方水提物对CNE2细胞增殖相关蛋白Survivin、XIAP、PCNA表达的影响,探讨益气解毒方抑制CNE2细胞增殖的作用机制,现报道如下。
1 材料与方法
1.1 细胞株
人鼻咽癌细胞株CNE2,购自北京北纳创联生物技术研究院,本实验室传代培养。
1.2 实验药物及试剂
益气解毒方药物组成及水提物的制备:黄芪30 g,党参15 g,黄连10 g,白花蛇舌草10 g,茯苓15 g,天花粉10 g,甘草6 g。煎煮收集药液浓缩,并冷冻干燥,干燥完全后将水提物-20 ℃密封保存,用培养基配成4.0 mg/mL的母液,主要参考廖雪等[11]的制备方法。RPMI-1640培养基、PBS缓冲液(Hyclone公司);胎牛血清(Gibco公司);DMSO(Amresco公司);CCK-8试剂盒(日本同仁公司);一抗Survivin、XIAP、PCNA(CellSignalingTechnology,CST公司)。
1.3 实验仪器
贺利氏HERAcell 150i CO2培养箱(赛默飞世尔公司);ELX800全自动酶标分析仪(BioTek公司);5415R高速冷冻离心机(Eppendorf公司);实时无标记细胞功能分析仪(艾森生物科技公司);Cytation5高通量细胞成像多功能检测系统(美国伯腾仪器有限公司);倒置显微镜(Olympus 公司);Odyssey CLX荧光扫描成像系统(Gene有限公司)。
1.4 方法
1.4.1 细胞培养 将鼻咽癌CNE2细胞培养于含10%胎牛血清的RPMI-1640培养液中,置于37 ℃、5% CO2、湿度饱和的恒温细胞培养箱内培养,细胞生长至70%~80%传代,取对数生长期细胞用于实验。
1.4.2 RTCA监测细胞增殖情况 取对数生长期CNE2细胞,消化重悬成单个细胞,调整浓度为每毫升5×104个细胞,接种到RTCA专用细胞增殖检测培养板,每个孔加入100 μL CNE2细胞悬液,等细胞指数(cell index, CI)达到1.0时,加入不同浓度0.125、0.250、0.500、1.000 mg/mL益气解毒方水提物(前期实验结果显示,此浓度范围药物对细胞无毒性),同时设空白对照组(Control组),每个组3个复孔,不同浓度组每孔加入药液200 μL,Control组每孔加入细胞培养液200 μL,采用RTCA动态监测,并用CI值表示CNE2细胞的增殖状况。
CI=(Rn-Rb)/15
Rn表示某个孔接种了细胞后的电极阻抗值,Rb表示某个孔中只有培养基时的背景阻抗值[12]。根据曲线分析水提物的药效随浓度及时间变化的特征,并用仪器自带的软件计算出合适时间点的半数抑制率浓度(half maximal inhibitory concentration,IC50) 。
1.4.3 CCK-8法检测细胞增殖 取对数生长期的CNE2细胞,按照每100 μL培养液中5×103个细胞种入96孔板,过夜,待CNE2细胞贴壁后,药物组每个孔分别加入不同浓度的200 μL含药培养液,Control组每孔加入细胞培养液200 μL,实验分组同“1.4.2”,每个组设置5个复孔,培养箱中培养一定时间。另外,设定只加细胞培养液、不加CNE2细胞的空白孔(用于A值校正)。药物作用24、48、72 h后,每个孔(包含空白孔)分别加100 μL现配的CCK-8溶液,继续培养2 h,实验重复3次。酶标仪检测450 nm波长的吸光度值(A值),记录实验结果,计算出细胞的增殖率及各时间点的IC50值。
细胞增殖率=(A值实验组-A 值空白孔)/(A值Control组-A值空白孔)×100%
1.4.4 高通量细胞成像多功能检测系统Cytation5监测细胞形态变化 取对数生长期的CNE2细胞,消化重悬成单个细胞,96孔板铺板,按照5×103个细胞每个孔,加100 μL体积细胞悬液到每个孔,过夜,待CNE2细胞贴壁后,根据“1.4.2”结果,确定水提物处理CNE2细胞的浓度,药物组每个孔分别加入不同浓度水提物0.25、0.50、1.00 mg/mL的含药培养液200 μL,Control组每孔加入细胞培养液200 μL,采用Cytation5监测细胞生长形态,并设定6 h拍摄一次细胞形态图像,并记录实验结果。
1.4.5 Western Blot检测细胞增殖相关蛋白的表达 根据“1.4.2”和“1.4.4”的结果确定水提物处理CNE2细胞的浓度和时间,待CNE2细胞生长至70%~80%,向培养皿中加入不同浓度水提物0.25、0.50、1.00 mg/mL的含药培养液3 mL,Control组加入细胞培养液3 mL,处理36 h后提取蛋白,用Western Blot检测细胞增殖相关蛋白Survivin、XIAP、PCNA的表达,采用荧光扫描成像系统分析相关蛋白的荧光信号值,并计算蛋白相对表达量。
蛋白相对表达量=蛋白荧光信号值/β-actin荧光信号值
1.5 统计学处理
采用SPSS 22.0统计软件处理,计量资料实验数据服从正态分布,用“x±s”表示,单因素设计,多组间计量资料比较采用单因素方差分析,满足方差齐性,多重比较用LSD检验,方差不齐用Dunnet T3检验。计量资料不服从正态分布的,则采用秩和检验。P<0.05为差异具有统计学意义。所有的结果分析图由GraphPad Prism 7.0软件制作完成。
2 结果
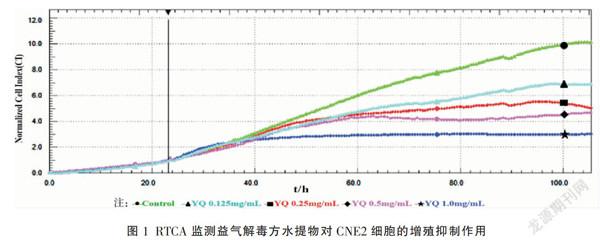
2.1 RTCA动态监测益气解毒方对鼻咽癌CNE2细胞增殖的影响
RTCA动态监测细胞生长情况,结果显示,Control组增殖较快,益气解毒方水提物组能够抑制CNE2细胞增殖,并計算出48 h IC50为0.5 mg/mL。见图1。2.2 CCK-8法检益气解毒方水提物对鼻咽癌CNE2细胞增殖的影响
CCK-8检测结果显示,与Control组比较,不同浓度0.125、0.250、0.500、1.000 mg/mL益气解毒方水提物分别处理CNE2细胞24、48、72 h后,均可以抑制CNE2细胞增殖,都具有统计学差异(P<0.05);且0.250、0.500、1.000 mg/mL各药物组在24、48、72 h 3个不同时间点之间均具有统计学差异(P值均<0.05),但0.125 mg/mL组在24、48、72 h 3个不同时间点之间差异无统计学意义(P>0.05)。随着药物浓度增加、作用时间延长,其抑制效果更加明显。见图2。
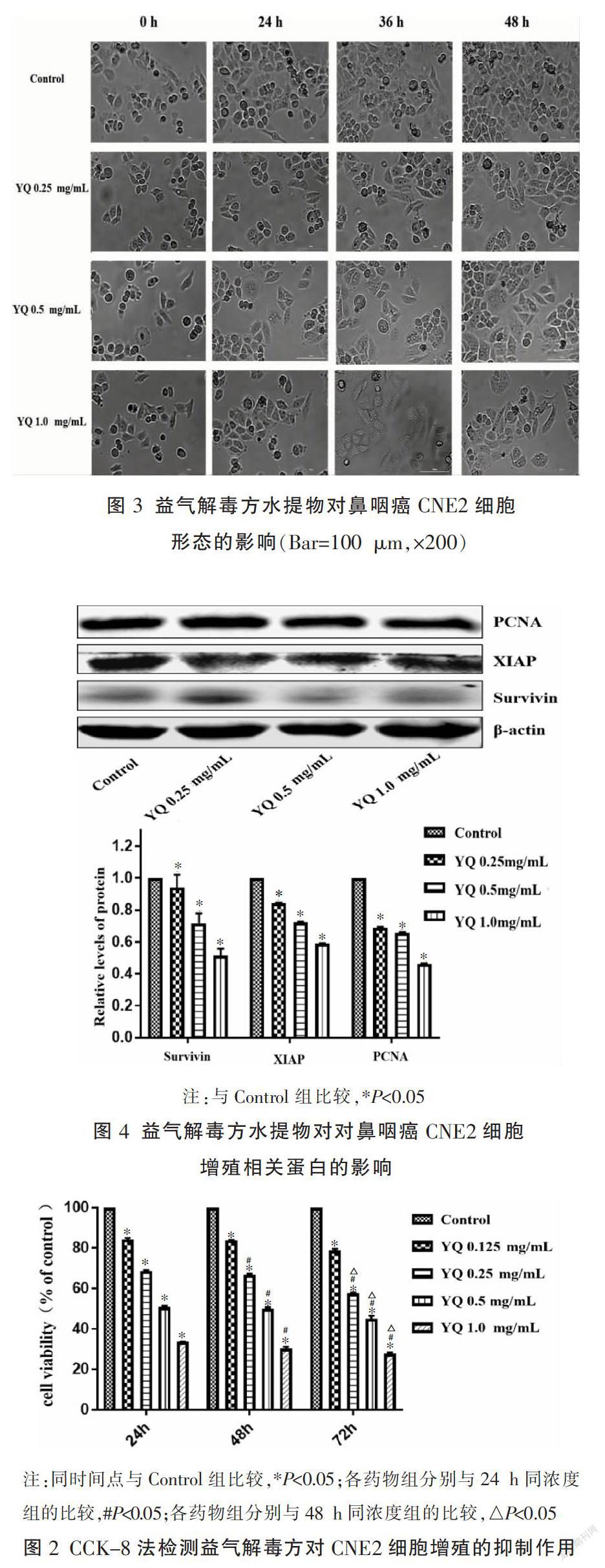
2.3 Cytation5动态监测益气解毒方水提物对鼻咽癌CNE2细胞形态的影响
根据RTCA和CCK-8的结果,选择0.25、0.50、1.00 mg/mL 3个浓度的益气解毒方水提物分别作用于CNE2细胞,采用Cytation5动态监测不同浓度组的细胞形态图像,由于72 h的CNE2细胞图像中,正常培养组细胞数太多,而不同浓度水提物组细胞数较少,且有部分细胞漂浮,故挑选加药处理0、24、36、48 h 4个时间点的细胞形态结果,结果显示,Control组细胞正常生长,细胞胞质形态均匀饱满,细胞的轮廓清晰,呈梭形,细胞结合率比较高,生长紧密,48 h左右拍照区域细胞基本长满。而不同浓度的水提物处理48 h后,不同浓度组细胞生长受到抑制,细胞间隙加大,细胞间的连接逐步消失,细胞数量明显减少,细胞形态不规则,细胞膜皱缩破裂,细胞核质出现浓缩、破碎、溶解。见图3。
2.4 Western Blot检测益气解毒方水提物对鼻咽癌CNE2细胞增殖相关蛋白的影响
结合RTCA和Cytation5的结果,在益气解毒方水提物处理CNE2细胞36 h左右,CNE2细胞生长受到明显抑制,故我们选取36 h作为干预时间点采用Western Blot检测相关蛋白Survivin、XIAP、PCNA的表达情况(以β-actin为内参照)。经不同浓度益气解毒方水提物处理36 h后,与Control组相比,不同浓度水提物组增殖相关蛋白Survivin、XIAP、PCNA的相对表达量均有下降,差异具有统计学意义(P<0.05)。见图4。
3 讨论
鼻咽癌是上皮源性恶性肿瘤,在我国头颈部肿瘤发病率中占据首位[13],患者在治疗后多易复发,如何有效减轻患者的复发率,降低临床患者的放化疗反应,是目前临床医生需要关注解决的问题。近年来的临床观察研究表明[14],配合使用中药复方能够明显减轻放疗过程中产生的不良反应。益气解毒方是田道法教授多年的经验用方,其改善鼻咽癌患者放化疗后的不良反应效果显著[15]。由黄芪、党参、天花粉、黄连、白花蛇舌草、茯苓、甘草组成,其作用主要是益气解毒,生津润燥,扶正祛邪,提升患者的免疫力,调节患者的气虚体质。
肿瘤细胞的生长情况取决于细胞增殖和细胞凋亡之间的动态平衡,而细胞的恶性增殖通常是肿瘤发生转化的关键因素。抑制肿瘤细胞的增殖可以在一定程度上抑制肿瘤的发生发展。课题组的前期结果显示,益气解毒方水提物可以抑制CNE2细胞增殖。在本次实验中,设置0.125、0.250、0.500、1.000 mg/mL不同浓度的水提物,采用RTCA、CCK-8、Cytation5分别监测不同浓度益气解毒方水提物对CNE2的细胞增殖的影响,结果初步表明,随着益气解毒方水提物浓度的增加,CNE2细胞形态发生改变,CNE2细胞的生长增殖受到抑制。
XIAP、Survivin是凋亡抑制蛋白家族的成员,都是重要的抗凋亡分子,有实验研究显示,Survivin在肿瘤组织中过度表达,会缩短患者的生存期、加速肿瘤复发等[16],能够直接抑制凋亡蛋白Caspase-3和Caspase-7的活性,也能够与细胞周期调控因子CDK4形成Survivin-CDK4复合体,使p21从CDK复合体中释放出来并异位到线粒体,间接抑制Caspase-3活性,发挥抑制细胞凋亡、相对促进细胞增殖的作用[17]。XIAP能够影响肿瘤细胞的增殖、迁移、侵袭[18],可以通过抑制Caspases 酶原的激活、降低成熟Caspases的催化活性,抑制肿瘤细胞凋亡[19]。PCNA则是细胞增殖核抗原,可反映细胞的增殖活跃程度,在DNA合成期,尤其在G1期到S期中发挥重要作用。PCNA的表达量影响到肿瘤细胞的活动过程,在恶性肿瘤的发生发展中发挥重要作用[20],本次实验显示,不同浓度益气解毒方水提物处理CNE2细胞36 h后,PCNA、Survivin、XIAP相关蛋白的相对表达量均有下降,初步判断益气解毒方水提物可以通过下调PCNA、Survivin、XIAP蛋白的表达,抑制人鼻咽癌CNE2细胞增殖,诱导细胞凋亡。
综上所述,本实验分别从增殖数量、增殖形态、相关蛋白的表达情况几方面进行研究,初步说明益气解毒方水提物能够抑制人鼻咽癌CNE2细胞增殖,其抑制作用可能与抑制相关蛋白Survivin、XIAP、PCNA的表达有关。课题组将继续深入探讨益气解毒方抑制CNE2细胞增殖的机制,为益气解毒方治疗鼻咽癌提供更充足的科学依据。
参考文献
[1] KAMRAN S C, RIAZ N, LEE N. Nasopharyngeal carcinoma[J]. Surgical Oncology Clinics of North America,2015,24(3):547-561.
[2] CHANG E T, ADAMI H O. The enigmatic epidemiology of nasopharyngeal carcinoma.[J]. Cancer Epidemiology, biomarkers & Prevention,2006,15(10):1765-1777.
[3] 尚学兰,谢志强,黄志碧.鼻咽癌的危险因素[J].现代预防医学,2008,35(2):206-207.
[4] KONG F, CAI B, LIN S, et al. Assessment of radiotherapy combined with adjuvant chemotherapy in the treatment of patients with advanced nasopharyngeal carcinoma: a prospective study[J]. Journal of buon,2015,20(1):206.
[5] 田道法,何迎春.鼻咽癌前病变“气虚染毒病机理论研究”[J].中医耳鼻喉科学研究杂志,2008,7(1):24-29.
[6] 尚云峰,田道法,YANG PC.益气解毒法不同组方对鼻咽癌CNE2Z细胞迁徙运动潜能及相关基因表达活性的影响[J].中国中西医结合耳鼻咽喉科杂志,2013,21(3):165-170,198.
[7] 江洁琼,贺安意,田道法,等.益气解毒方对TgN(p53mt-LMP1)/HT转基因小鼠鼻腔和鼻咽黏膜上皮细胞增殖及凋亡相关基因表达的影响[J].中国组织工程研究与临床康复,2008,12(42):8201-8205.
[8] 胡 梅,田道法,刘群良,等.益气解毒方提取物对CNE2细胞的体内外抑瘤作用[J].中国中医药信息杂志,2012,19(11):41-43.
[9] 何 丹.益气解毒方诱导鼻咽癌CNE2侧群细胞凋亡的研究[D]. 长沙:湖南中医药大学,2015.
[10] 罗晶婧.益气解毒方水提物联合盐霉素抑制鼻咽癌细胞增殖、迁移和诱导凋亡的效应[D].长沙:湖南中医药大学, 2016.
[11] 廖 雪,蔺 婷,罗晶婧,等.益气解毒方水提物对RAW264.7细胞免疫功能的影响[J].肿瘤基础与临床,2015,28(6):473-476.
[12] 严国俊,裴燕芳,朱贞宏,等.实时细胞电子分析技术的应用研究进展[J].中国药学杂志,2014,49(3):169-173.
[13] 王 兵,侯 炜.中医辨治鼻咽癌的几点认识[J].世界中西医结合杂志.2013,8(1):89-91.
[14] 王 磊,梁 杰,阿提坎·卡吾力,等.复方苦参注射液治療鼻咽癌放射性口腔黏膜损伤疗效观察[J].中草药,2015,46(6):875-877.
[15] 胡 梅,田道法,刘群良,等.益气解毒方提取物对CNE2细胞的体内外抑瘤作用[J].中国中医药信息杂志,2012,22(11):41-43.
[16] FUKUDA S, PELUS L M. Survivin,a cancer target with an emerging role in normal adult tissues[J]. Molecular Cancer Therapeutics,2006,5(5):1087-1098.
[17] UREN A G, WONG L, PAKUSCH M, et al. Survivin and the innercentromere protein INCENP show similar cell-cycle localization and gene knockout phenotype[J]. Current Biology,2000,10(21):501319-501328.
[18] ZHAO W J,DENG B Y,WANG X M, et al. XIAP associ ated factor 1 (XAF1) represses expression of X-linked inhib itor of apoptosis protein (XIAP) and regulates invasion, cell cycle, apoptosis, and cisplatin sensitivity of ovarian carcino ma cells[J]. Asian Pacific Journal of Cancer Prevention Apjcp,2015,16(6): 2453-2458.
[19] FINLAY D. Small-molecule IAP antagonists sensitize cancer cells to TRAIL-induced apoptosis: roles of XIAP and cIAPs.[J]. Molecular Cancer Therapeutics,2014,13(1):5-15.
[20] 刘志勇,易 坚,邹小明.PCNA、E2F-1、RASSF1A蛋白表达与胃癌生物学关系研究[J].黑龙江医药,2013,26(5):768-771.

