运用“一境法”进行化学教学设计的思考与实践
云磊
对于化学反应,我们首先研究物质变化,再去研究能量变化。而最常见的能量变化表现为热量的放出或者吸收,还可能有其他能量轉化形式,但我们通常更多的是考虑化学反应中的热量变化。
对于苏教版高中化学必修2专题2化学反应与能量转化的单元教学,我们要从学科知识的系统性、思想的整体性和认识的阶段性来把握。其中关于《化学反应中的热量变化》一课的教学,可通过设计氢气与氧气的反应这一条主线来全程贯穿,称之为“一境法”。在本节内容之前,教材已经从化学反应的种类、本质、化学反应速率和反应限度四个角度对化学反应进行了研究,不同的角度明显有阶段性的侧重。而本节内容是从另一个全新的视角即能量变化进一步认识化学反应。学生只有学好化学反应中的热量变化,对化学反应的认识才是全面的、深刻的。下面就结合课例,谈谈运用“一境法”进行化学教学设计的思考与实践。
一、通过对生活体验的回忆,从宏观角度感受化学变化中的热量变化
上课开始,围绕“研究化学反应的目的是什么”,师生开展对话与讨论,大部分学生都能想到目的是生成新的物质。教师系列追问“还有没有其他的目的呢”“烧烤的目的是什么呢”“燃烧木炭难道是为了得到二氧化碳气体”,显然不是,我们更主要的目的是为了获得热量来烤熟食物。由此启发学生,有的化学反应不仅是为了生成新物质,更是为了获得能量。在燃烧木炭的化学反应过程中,不仅有物质变化还有能量变化。这个过程中能量变化有热量变化,同时还有其他形式的变化,如发光等。
“为什么有的反应需要吸收热量,而有的需要放出热量呢?”在物理和生物课中我们知道了“能量守恒定律”,能量在自然界中是守恒的。通过今天的化学学习,我们还可进一步发现:在反应前后,能量的形式是可以改变的,但总能量保持不变。
以2H2+O2=2H2O为例,能量形式由化学能转变为热能和光能,但反应前后总能量不变。即2 mol H2和1 mol O2具有的总能量比2 mol H2O总能量要大,多余的能量以光能和热能的形式释放。从而得出有关吸热反应和放热的概念以及引起化学反应中热量变化的宏观原因,学生由此想到反应物和生成物能量的不同,导致了化学反应过程中表现为吸收热量或者放出热量。
此时,学生初步能够从宏观角度直观感受到吸热反应与放热反应,并了解吸热与放热产生的原因在于反应物和生成物总能量不同。
二、通过对化学反应本质的分析,从微观角度分析化学反应中的热量变化
通过前面的学习,学生已经知道化学反应的本质就是旧化学键的断裂和新化学键的形成。关于化学键,学生也知道,要想断裂化学键就必须要吸收能量,反之推导得出形成化学键必然会释放能量。进一步分析可知,断裂化学键需要吸收的热量大于形成化学键需要放出的热量,那么该反应就是吸热反应。反之,如果断裂化学键需要吸收的热量小于形成化学键需要放出的热量,那么该反应肯定就是放热反应。
仍然以2H2+O2=2H2O为例,“已知拆开1 mol 氢气中的化学键需要消耗436.4 kJ的能量,拆开1 mol 氧气中的化学键需要消耗498 kJ的能量,而形成水分子的1 mol H—O键能够释放462.8 kJ能量”。请计算说明该反应是吸热反应还是放热反应。通过计算,学生发现跟从反应物与生成物总能量角度判断是符合的。从微观角度分析,断开2 mol H2中的化学键和1 mol O2中的化学键吸收的总能量小于形成2 mol H2O中的化学键所释放出的能量,所以此反应表现为放热反应。
此处的计算,也为后面反应热的计算、热化学方程式的书写等做了一个很好的铺垫,让学生学会从定性到定量的角度来分析问题。
三、通过对实验现象的观察,从实验角度体验化学反应中的热量变化
初中氢气的爆鸣实验就已经充分说明氢气在氧气中燃烧是一个放热反应,我们还可以从其他几个实验进一步认识吸热反应和放热反应。
探究1:浓硫酸与水混合。
探究2:化学必修2课本P35实验1与实验2。
探究3:实验3盐酸与氢氧化钠溶液混合。
探究4:实验4氯化钡溶液与稀硫酸溶液混合。
以上四组探究实验,强调观察的重点是看温度的变化,实验过程中可以采用让学生用手触摸感受温度的变化,实验结束后给学生尽可能多的时间交流对实验中热量变化的看法。经过学生观察、讨论得出三个结论:一是有化学反应必然伴随能量变化,但有能量变化,不一定发生了化学反应;二是有些化学反应中的热量变化比较显著,也有些化学反应中的热量变化不明显;三是“许多化学反应中的能量变化主要表现为热量的放出和吸收”。
利用2H2+O2=2H2O的反应,还可以设计成氢氧燃料电池,将化学能转变为电能,即为后面电化学的学习埋下伏笔。
至此,学生能够切身体验到化学反应过程中能量的变化,不仅对概念的理解深入,对化学反应中能量变化的认识更加深刻。
四、通过对热化学方程式的书写,从符号角度表示化学反应中的热量变化
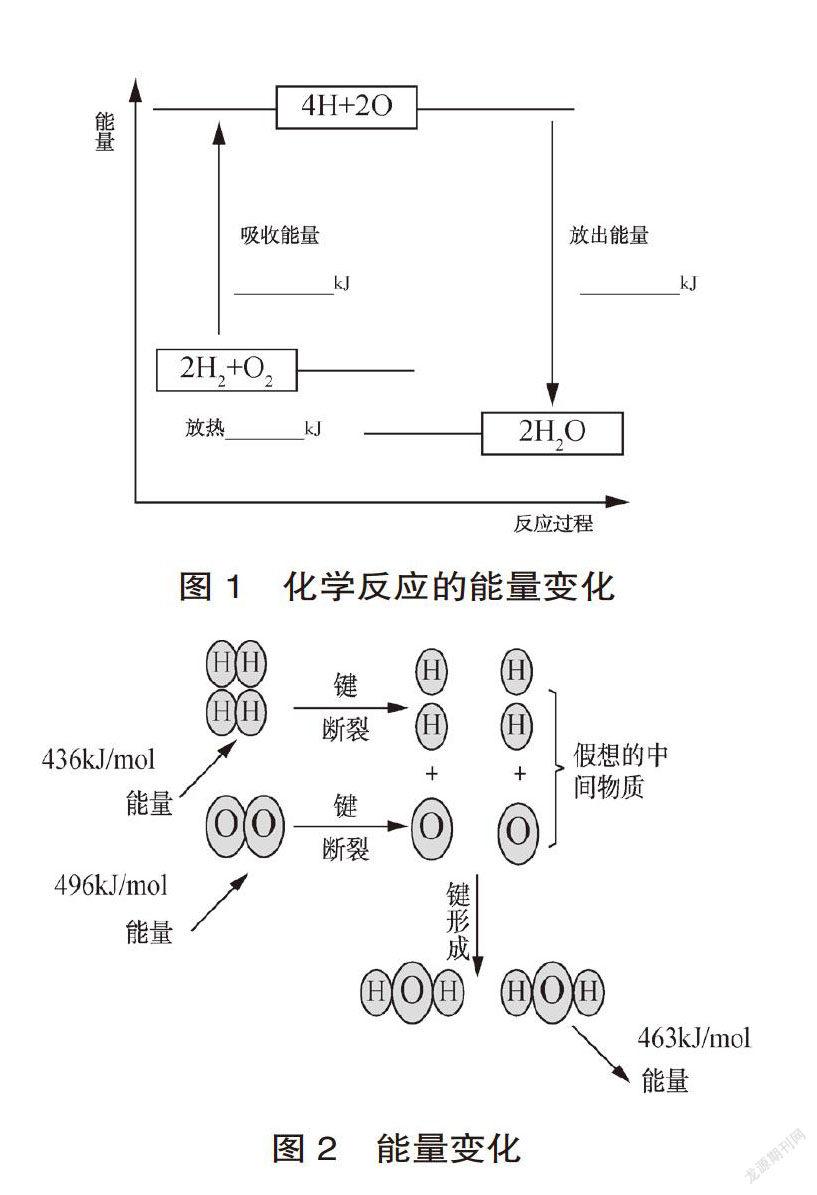
教材中的交流与讨论采用比较直角坐标图(见图1)粗略示意化学反应中的能量变化,也可以向学生简单介绍图2形式进行的能量变化过程。
但整体来看,两种表示方法都不够简洁。表示化学反应,学生最容易想到的就是化学方程式,但化学方程式只能表示化学反应前后物质的变化,而我们除了要表示物质变化,还需要表示反应前后能量变化,很自然提出热化学方程式的概念。
通过对氢气在氧气中燃烧断键吸收能量和成键放出能量可以计算出反应的ΔH,并书写出热化学方程式:2H2(g)+O2(g) =2H2O(g) ΔH=-480.4 kJ·mol-1,让学生将此与化学方程式对比,提出热化学方程式的书写规律和注意事项。首先要注明反应物和生成物的状态,原因在于物质呈现哪种聚集状态,与它们所具有的能量有关。其次,在热化学方程式中化学计量数可以是整数,也可以是分数。对于同一个反应来说,当化学计量数不同时,其ΔH也不同。
至此,对于化学反应中的热量变化,我们就可以通过氢气与氧气的反应这一条主线贯穿整个课堂的始终。运用“一境法”设计教学,有情节、有体验、有思考,在主线设定的情境中让学生体验学习中遇到的问题,感受所学知识如何应用于生产生活实际,激发学生带着兴趣进一步研究和学习化学。

