康柏西普对实验性脉络膜新生血管的作用机制研究
王爽 段素芳 牛秉轩 张轲 李晓鹏
脉络膜新生血管(choroidal neovascularization,CNV)是异常的新生毛细血管[1],这种异常的新生毛细血管来自眼球壁中层的脉络膜。突破色素毛细血管层的基底膜通过破损处的Bruch膜进入其视网膜色素上皮(retinal pigment epithelium,RPE)层下,同时视网膜神经上皮层与RPE 之间易出血和渗出的异常新生血管是眼内新生血管的主要表现形式之一[2],也是年龄相关性黄斑变性[3]、病理性近视[4]、糖尿病黄斑水肿[5]、视网膜静脉阻塞[6]、眼底血管样条纹感染[7]等疾病发展的共同环节与特征。康柏西普[8]目前主要用于治疗上述眼底新生血管形成疾病,同时对CNV也有一定的抑制作用。康柏西普是由人血管内皮生长因子(vascular endothelial growth factor,VEGF)中的免疫球蛋白样区域2和人VEGF-2中的免疫球蛋白样区域3、4及人免疫球蛋白IgG1的Fc片段融合而成。这种药物可以特异结合VEGF-A、VEGF-B等,并通过阻断由VEGF介导的信号转导有效抑制病理性新生血管的生长,且具有亲和力强、作用时间长等特点。本研究旨在研究康柏西普对实验性CNV的作用机制,从而为其治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物选取7周龄的雄性BN大鼠40只,体质量(200±30)g,由北京维通利华实验动物技术有限公司提供[动物许可证号SCXK(京)2017-0022,普通级],分8个笼子饲养,每个笼子5只。饲养于本院动物中心实验室。
1.1.2 主要试剂与仪器异硫氰酸荧光素购自南京探求生物公司;注射用吲哚菁绿(indocyanine green,ICG)购自丹东医创药业有限责任公司;盐酸氯胺酮注射液购自建古田药业有限公司;注射用盐酸赛拉嗪购自林华牧动物保健品有限公司;多波长氪激光机购自上海昊量光电设备有限公司;吲哚菁绿血管造影(indocyanine green angiography,ICGA)摄像机购自亿嘉博科创研究所;荧光倒置显微镜购自上海点应光学仪器有限公司。
1.2 方法
1.2.1 模型建立造模前给各组大鼠下肢肌肉注射35 mg·kg-1盐酸氯胺酮和5 mg·kg-1盐酸赛拉嗪混合麻醉液,使用复方托吡卡胺眼液散瞳,右眼前放置 120 D super field 前置镜,找到视盘后,在一个视野下使用波长为532 nm氪激光在视盘下方光凝2排,每排5个点,共10个点,激光时产生的气泡提示激光点Bruch膜破裂,若该点出血或 Bruch膜未破裂则为无效点,每眼共光凝10个有效点。激光功率为150 mW,直径为50 μm,曝光时间为0.1 s。造模成功标准参考李瑾等[9]研究。
1.2.2 分组及药物干预将上述大鼠分为空白对照组、模型组、低剂量康柏西普组和高剂量康柏西普组;其中低量康柏西普组在造模成功后7 d、14 d在大鼠玻璃体内注射康柏西普40 μL(10 g·L-1);高剂量康柏西普组在造模成功后7 d、14 d在大鼠玻璃体内注射康柏西普40 μL(20 g·L-1);空白对照组和模型组分别注射等量生理盐水。
1.2.3 检测方法
1.2.3.1 CNV发生率及渗漏面积检测造模后 21 d 对各组大鼠进行麻醉、散瞳,左眼拍摄眼底彩照。使用ICG(6 mg·kg-1)注射液自耳缘静脉注入,行ICGA检查,按照荧光充盈点数与有效激光点数的比值,计算CNV 发生率,并测量CNV渗漏面积。
1.2.3.2 病理组织切片 HE 染色各组大鼠选取视网膜及脉络膜结构完整连续的石蜡切片,放入 60 ℃ 恒温箱中烤片保持30 min;使用二甲苯液脱蜡,使用体积分数75%、90%、100%酒精脱水;漂洗后使用苏木精染色3 min,再次漂洗后使用10 g·L-1酸酒分色后氨水返蓝15 s;继续使用蒸馏水漂洗,伊红染色 3 min,蒸馏水漂洗;中性树脂封片并行显微镜观察。
1.2.3.3 Western blot 检测蛋白表达水平Western blot方法检测蛋白表达水平,使用蛋白质条带用扫描仪进行扫描,以β-actin为内参,应用Imagaquent 5.1软件对血管内皮生长因子(vascular endothelialgrowth factor,VEGF)、缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)、丝氨酸/苏氨酸激酶(serine/threonine kinase,AKT)蛋白质条带灰度进行相对定量分析。以目的蛋白条带与 β-actin 灰度比值表示蛋白相对表达水平。实验重复3次,取平均值。
1.3 统计学方法采用SPSS 20.0统计学软件和GraphPda Prism 5软件对数据进行处理和分析作图,整体比较采用单因素方差分析,组间两两比较采用SNK方法;检验水准:α=0.05。
2 结果
2.1 各组大鼠CNV的发生率相比模型组,低剂量康柏西普组和高剂量康柏西普组大鼠ICGA荧光点数和CNV发生率显著降低;且高剂量康柏西普组上述指标均低于低剂量康柏西普组,差异均有统计学意义(均为P<0.05,见表1)。
表1 各组大鼠CNV的发生率

组别眼数有效激光点数ICGA荧光点数CNV发生率/%空白对照组----模型组101007272低剂量康柏西普组101006060高剂量康柏西普组101005454
2.2 各组大鼠ICGA检查CNV渗透面积相比空白对照组,模型组大鼠CNV渗透面积显著增加(P<0.05,图1);相比模型组,低剂量康柏西普组和高剂量康柏西普组大鼠CNV渗透面积显著减小;且高剂量康柏西普组CNV渗透面积小于低剂量康柏西普组,差异均有统计学意义(均为P<0.05)。
2.3 各组大鼠眼底FFA检查结果空白对照组大鼠基本无荧光素渗漏(图2);模型组大鼠有较为严重的荧光素渗漏;低剂量康柏西普组有小部分的荧光素渗漏,且面积小于模型组;高剂量康柏西普组可见荧光着色,少量渗漏且不明显。
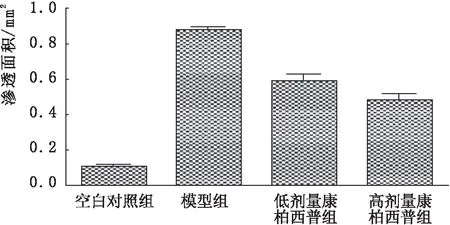
图1 各组大鼠ICGA检查CNV渗透面积比较
2.4 HE染色结果空白对照组大鼠RPE层、脉络膜结构清晰且完整(图3)。模型组大鼠脉络膜、Bruch膜和RPE层结构不连续,内、外核层处可见组织构造紊乱,并可见异常增生的细胞突破脉络膜血管网的基底膜。低剂量康柏西普组和高剂量康柏西普组视网膜及脉络膜被破坏的面积显著小于模型组,且高剂量康柏西普组视网膜损伤面积最小。
2.5 大鼠视网膜中HIF-1α、AKT、VEGF蛋白的表达相比空白对照组,模型组大鼠视网膜中HIF-1α、AKT和VEGF蛋白的表达均显著升高,且差异均有统计学意义(均为P<0.05,图4);相比模型组,低剂量康柏西普组和高剂量康柏西普组大鼠视网膜中HIF-1α、AKT和VEGF蛋白的表达均显著降低,且高剂量康柏西普组中上述指标显著均低于低剂量康柏西普组,差异均有统计学意义(均为P<0.05)。
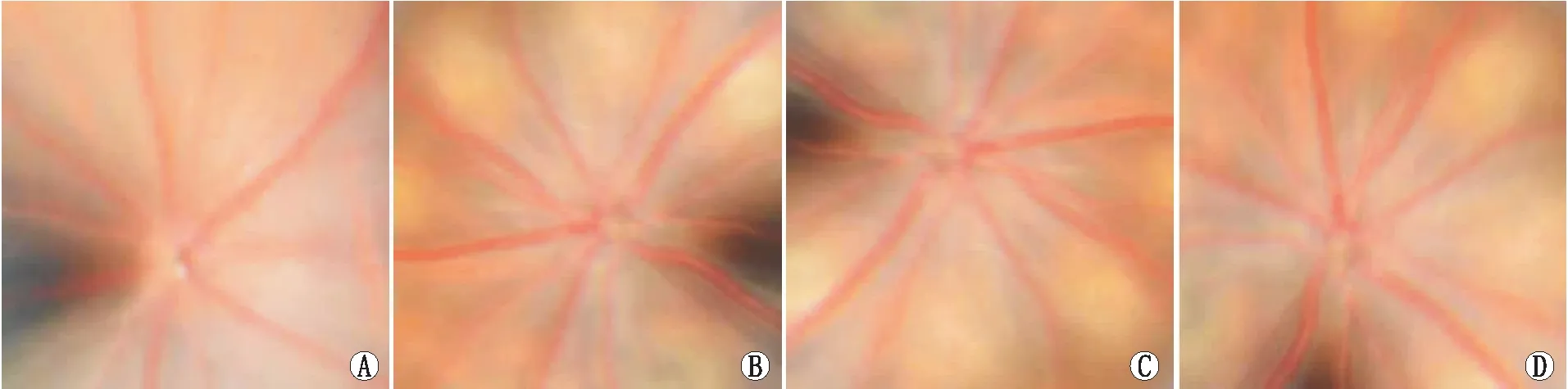
图2 各组大鼠眼底FFA检查结果。A:空白对照组;B:模型组;C:低剂量康柏西普组;D:高剂量康柏西普组
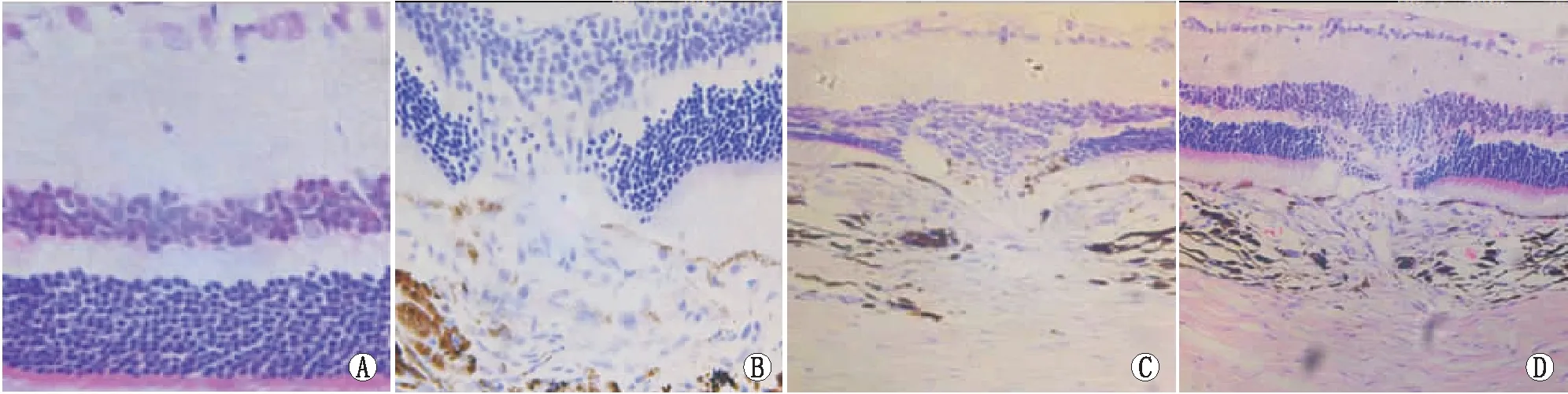
图3 HE染色结果。A:空白对照组;B:模型组;C:低剂量康柏西普组;D:高剂量康柏西普组
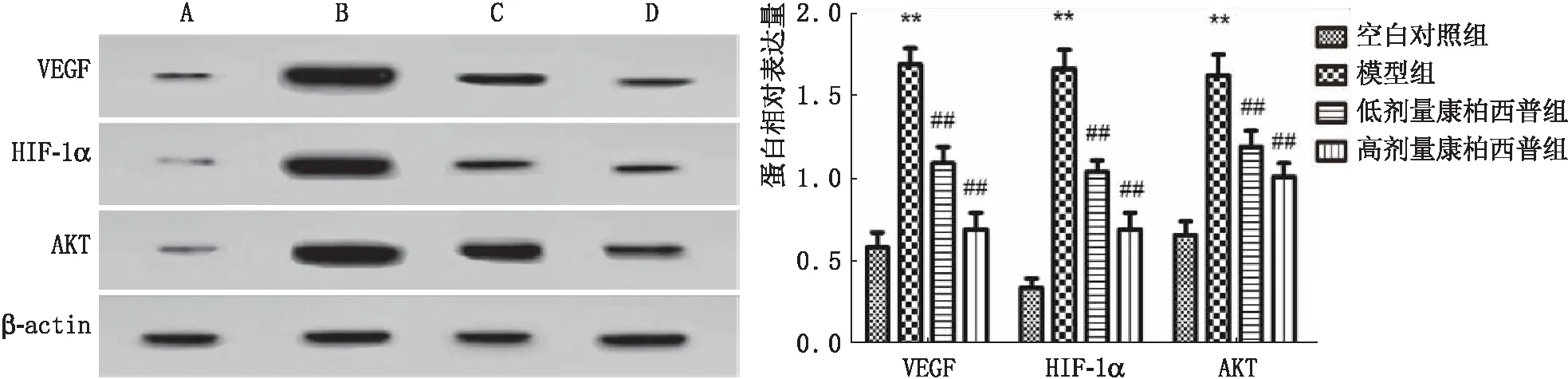
图4 大鼠视网膜中 HIF-1α、AKT和VEGF蛋白表达检测结果。A:空白对照组;B:模型组;C:低剂量康柏西普组;D:高剂量康柏西普组;与空白对照组比较,**P<0.01;与模型组比较,##P<0.01
3 讨论
新生血管目前主要治疗方法包括:玻璃体内注射抗VEGF药物和手术治疗等[10]。临床上使用的抗VEGF药物主要包括康柏西普、雷珠单抗、贝伐单抗等[11]。其中康柏西普不仅可以与VEGF特异性结合并且使VEGF 不能和受体结合,同时也可以阻断VEGF受体的来源使VEGF失去活性,促进新生的毛细血管逐渐萎缩,达到控制眼部新生血管继续生长的作用。
CNV在眼部的发生是多种因素共同作用的结果,王哲哲等[12]研究表明,VEGF是目前发现的功能最强的促血管生成因子,在CNV形成过程中VEGF起着主要的调控作用,且是新血管形成的必要条件。VEGF家族主要为VEGF-A和VEGF-B,VEGF-A主要负责新生血管形成生长,可以通过结合VEGFR-2受体诱导新生血管的形成,在新血管形成生长中VEGF-B主要通过增生以及分解毛细血管基底膜和细胞外基质而诱导新生血管的生成。杨琳红等[13]研究表明,HIF-1α通道是调控VEGF高表达的重要信号通道;AKT是调节其表达的主要上游因子。李悦等[14]研究表明,在正常条件下,细胞内HIF-1α会被胞质中的蛋白水解酶水解成小分子片段,失去生物学功能,处于一种不断合成与水解的动态平衡状态,且较少被检测到。在AKT转导信号通路中,AKT可以增加细胞内可用的HIF蛋白池,提高HIF-1α蛋白的合成速率达到调节HIF-1α活性的作用,同时HIF-1α可与VEGF基因的HIF对应点相契合,并促使VEGF转录,使其高表达;VEGF的浓度升高,促进CNV的生长。本研究结果表明,相比空白对照组,模型组大鼠视网膜中HIF-1α、VEGF和AKT蛋白表达显著增加,使用康柏西普后,大鼠视网膜内的HIF-1α、VEGF和AKT蛋白表达显著减少,康柏西普作为一种抗VEGF药物可以抑制大鼠的AKT信号转导通路,抑制VEGF的表达,减少CNV的生长,说明抑制AKT的表达可以显著降低CNV的发生。周小军[15]研究表明,降低VEGF、HIF-1α的表达可以抑制CNV的生长,与本研究结论一致。
综上所述,康柏西普可以减少实验性CNV的生成并对视网膜功能起到保护作用,其作用机制可能与抑制脉络膜视网膜中HIF-1α、AKT和VEGF的表达,从而抑制由氪激光光凝眼底而产生的实验性CNV生长有关。但因实验性CNV涉及到的蛋白表达和信号通路较为复杂,在后续的实验中可以进一步探讨其他蛋白表达及信号通路对实验性CNV的作用机制。

