同轴微切口与传统小切口超声乳化术的临床疗效及术后并发症对比分析
刘卫华 王军
近年来随着超声乳化技术的普及,人工晶状体材料和设计也在不断地改进,为患者提供了更高的生活质量。微创和减少手术源性角膜散光是目前白内障手术追求的目标[1]。本研究分析比较1.8 mm同轴微切口超声乳化术与传统同轴3.0 mm小切口超声乳化术的临床疗效及手术并发症情况,现报告如下。
1 资料与方法
1.1 一般资料收集2015年5月至10月北京同仁医院眼科收治的老年性白内障患者48例(48眼)。患者年龄均在50岁以上,除外角膜病变、青光眼、葡萄膜炎、年龄相关性黄斑变性、糖尿病视网膜病变、高度近视眼、眼外伤或手术史、视神经病变者。采用随机数字表法将患者分为2组,微切口组和小切口组。微切口组24例,其中男11例、女13例,年龄(65.5±8.5)岁。小切口组24例,其中男12例、女12例,年龄(67.4±6.6)岁。
1.2 手术方法所有患者手术均由一熟练的白内障手术医师完成。术前常规检查角膜地形图,人工晶状体度数计算采用SRK-T公式。爱尔凯因滴眼液局部表面麻醉3次,行同轴超声乳化白内障手术,主切口为透明角膜隧道切口,手术切口位于1100钟位,侧切口位于300钟位,切口宽1.1 mm。微切口组主切口长1.8 mm,前房内注入透明质酸钠,行直径约为5.0 mm的中央连续环形撕囊,水分离后用劈核钩劈核,扭动模式超声乳化吸出术,自动灌注系统吸出残留皮质。前房及囊袋内注入黏弹剂,用推助器将折叠式MI60人工晶状体植入囊袋内,清除黏弹剂,伤口密闭。小切口组角膜主切口大小为3.0 mm,术中植入常规折叠式人工晶状体。术后滴妥布霉素地塞米松滴眼液,每天4次持续2周,第3~4周改用普拉洛芬滴眼液滴眼,每天4次。
1.3 术前术后检查术前常规角膜曲率、A超+眼彩色超声检查,SRK-T公式计算人工晶状体屈光度,并行角膜地形图检查;术后行裂隙灯、眼底镜以及角膜地形图检查,电脑验光检查患者最佳矫正视力。
1.4 统计学处理采用SPSS 19.0统计软件进行数据分析,数据以均数±标准差表示。二组患者各项指标采用独立样本t检验进行分析。检验水准:α=0.05。
2 结果
2.1 术后最佳矫正视力术后1周、1个月、3个月两组患者最佳矫正视力比较,差异均无统计学意义(均为P>0.05),见表1。
2.2 术后两组患者手术源性散光和角膜厚度变化情况
2.2.1 两组患者手术源性散光情况微切口组术前散光为(0.87±0.51)D,小切口组为(0.79±0.55)D,
表1 术后两组患者最佳矫正视力(logMAR)比较
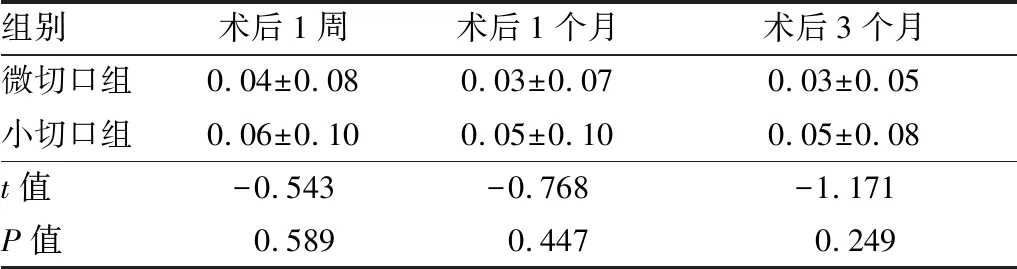
组别术后1周术后1个月术后3个月微切口组0.04±0.080.03±0.070.03±0.05小切口组0.06±0.100.05±0.100.05±0.08t值-0.543-0.768-1.171P值0.5890.4470.249
两组比较差异无统计学意义(P>0.05)。微切口组术前散光轴位为(95.09±31.99)°,小切口组为(97.18±32.79)°,两组比较差异无统计学意义(P>0.05)。术后1个月和3个月两组间手术源性散光比较,微切口组均明显低于小切口组,差异均有统计学意义(均为P<0.01)。在微切口组组内术后1个月和3个月手术源性散光无明显差异(P>0.05),微切口组手术源性散光在术后1个月保持稳定。在小切口组组内术后3个月手术源性散光明显低于术后1个月 (P<0.01)。见表2。
2.2.2 两组患者角膜厚度变化情况微切口组术前角膜厚度为(567±27)μm,小切口组为(564±25)μm,两组差异无统计学意义(P>0.05);术后1个月与3个月两组间角膜厚度变化差异亦均无统计学意义(均为P>0.05)。两组术后3个月角膜厚度均小于术后1个月,差异均有统计学意义(均为P<0.05)。见表2。
表2 术后两组患者手术源性散光和角膜厚度变化情况
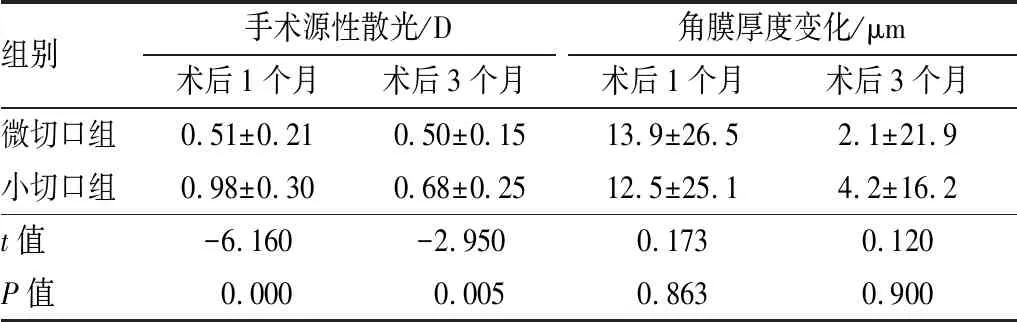
组别手术源性散光/D术后1个月术后3个月角膜厚度变化/μm术后1个月术后3个月微切口组0.51±0.210.50±0.1513.9±26.52.1±21.9小切口组0.98±0.300.68±0.2512.5±25.14.2±16.2t值-6.160-2.9500.1730.120 P值0.0000.0050.8630.900
2.3 手术中和术后并发症发生情况所有患者术中前房稳定,无后囊膜破裂、玻璃体脱出以及虹膜脱出等并发症。术中顺利植入折叠式人工晶状体。术后角膜密闭好,无人工晶状体偏位、瞳孔夹持并发症。在随访期间两组患者均未发生后发性白内障。
3 讨论
自从Kelman发明超声乳化仪以来,超声乳化术日趋完善,手术切口也渐趋微小。在眼球的屈光介质中,角膜的屈光力占3/4,而透明角膜切口会使角膜屈光力发生改变,从而影响术后裸眼视力的恢复[2],由于超声乳化针头对切口组织的热损伤和反复多次的移动,会造成切口组织轻度错位,切口所在子午线组织松弛,曲率变小,引起术后散光[3]。白内障术后角膜散光问题也越来越受到重视。角膜地形图不同于角膜曲率计,它能对整个角膜表面进行分析,可以发现白内障患者术前是否存在散光,准确地测量角膜屈光状态和屈光度差异。
术后角膜散光受手术中切口大小、形状、位置以及缝合技术等的影响[4],透明角膜切口超声乳化白内障摘出联合人工晶状体植入术对角膜的切开及术后切口的愈合情况,均会改变角膜曲率,使手术后产生散光,术后角膜散光度是术前散光与手术性散光的矢量之和,屈光稳定时间一般在术后3个月[5]。白内障手术切口的大小与手术源性角膜散光及屈光稳定时间具有相关性[6]。Alió等[7]通过1.8 mm微切口与2.75 mm小切口透明角膜同轴白内障超声乳化联合人工晶状体植入术术后1个月的对比研究结果显示,1.8 mm透明角膜切口能够提供更稳定的角膜生物学形态。
Nielsen[8]评价3.5 mm以及 5.2 mm的颞侧及上方透明角膜切口所致手术源性散光,并将其与上方3.5 mm、5.2 mm 的角巩膜切口进行了比较,颞侧或上方3.5 mm 的透明角膜切口大约会引起0.5 D的顺规或逆规散光。透明角膜切口越大,切口手术源性散光越大。Luo等[9]研究发现,术后1个月1.8 mm和2.2 mm切口的手术源性散光明显小于3.0 mm切口,而1.8 mm和2.2 mm切口的手术源性散光之间无明显差异。Kim等[10]应用23G玻璃体切割头进行玻璃体切割联合白内障超声乳化手术,发现透明角膜切口2.2 mm与2.8 mm相比较,2.2 mm切口引起的手术源性散光明显减少。Jain等[11]研究发现,术前散光小于1.0 D的患者采用2.2 mm和2.75 mm手术切口引起的术后手术源性散光、术后角膜曲率、对比敏感度均无差异。

