免疫检查点抑制剂治疗晚期肿瘤病人3例报告并文献复习
孙洋 安永恒 郭天行 郭彦君 张新文 刘华敏

[摘要] 免疫治疗是当今肿瘤治疗中最具有研究价值的方向之一,以程序性死亡分子1(PD-1)和程序性死亡分子1配体(PD-L1)为代表的免疫检查点在肿瘤的发生发展中起到重要作用。目前的研究证实,PD-1单抗(Opdivo、Pembrolizumab和Pidilizumab)通过阻断PD-1与PD-L1的结合恢复T细胞的活性,从而调动机体点免疫系统以识别并杀死某些肿瘤细胞,起到抗肿瘤作用。本文对3例晚期肿瘤病人应用免疫检查点抑制剂治疗效果、不良反应等进行回顾分析,并进一步复习相关文献。
[关键词] 免疫检查点抑制剂;肿瘤微环境;免疫治疗
[中图分类号] R730.3
[文献标志码] B
[文章编号] 2096-5532(2019)01-0121-03
近年来,越来越多的研究结果表明,恶性肿瘤细胞周围存在一个高度免疫抑制的微环境,肿瘤细胞可以通过肽-主要组织相容性复合体(MHC)的表达缺失[1]、分泌免疫抑制性的细胞因子和介导负性共刺激信号等途径逃避自身免疫反应[2]。肿瘤免疫治疗的目的是通过拮抗肿瘤微环境中的各种导致免疫抑制的因素,调动病人的免疫系统,增强其抗肿瘤免疫力,从而抑制和杀伤肿瘤细胞。免疫治疗已成为当今肿瘤治疗的第四大模式,尤其是对于免疫检查点抑制剂(ICB) 的研究已经取得了很大进步。临床研究显示,ICB在多种肿瘤如霍奇金淋巴瘤、错配修复缺失的结直肠癌、胃癌、肝细胞癌等治疗中均取得了显著效果[3]。然而,ICB在显著提高肿瘤治疗效果的同时也出现了药物不良反应,其中最为显著的就是免疫相关不良反应[4]。本文对3例晚期肿瘤病人应用ICB治疗的效果、不良反应进行回顾分析,并进一步复习相关文献。
1 病例報告
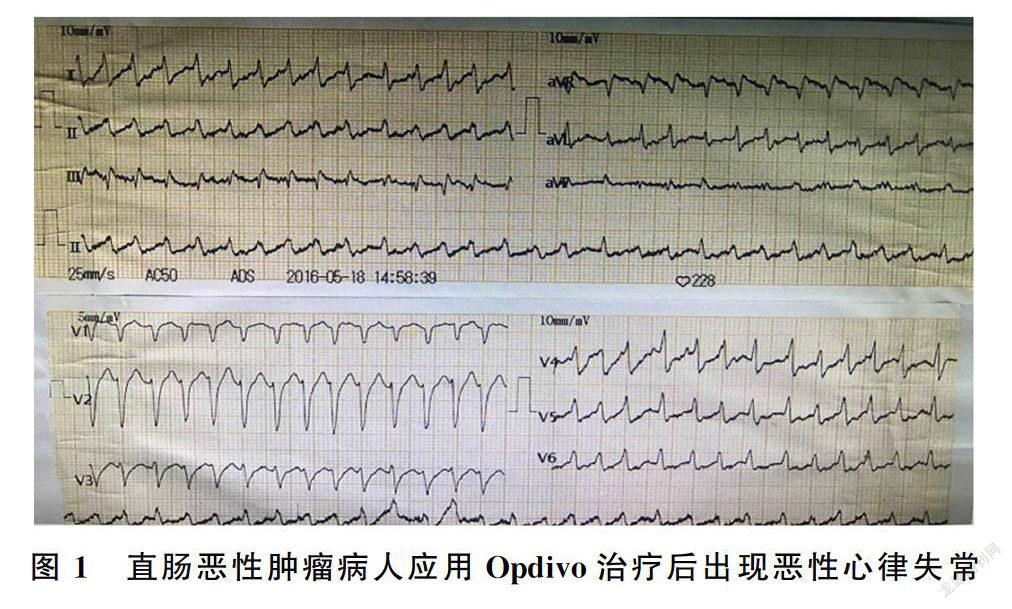
1.1 纳武单抗(Opdivo)治疗直肠恶性肿瘤
病人,男,56岁。因“直肠恶性肿瘤姑息术后8月余,腹痛腹胀2月余”于2016年5月13日入院。入院诊断为直肠恶性肿瘤姑息术后,肝脏、盆腔、肺、胸膜、腹膜多发转移,心房颤动。病人既往行多周期奥沙利铂联合卡培他滨、贝伐珠单抗及伊立替康、氟尿嘧啶联合左亚叶酸钙方案化疗及盆腔放疗,病情进展。5月12日应用Opdivo 200 mg静脉滴注。5月13日病人自诉泛酸、烧心及食欲下降,体力下降,于用药后第6天置胃管过程中突发室上性心动过速。查电解质:血钾正常,血钠、血氯降低;肌酐正常,肌红蛋白120 μg/L,肌酸激酶同工酶<1 μg/L,脑尿钠肽(BNP)104 ng/L。给予西地兰0.2 mg静脉推注,盐酸胺碘酮150 mg静脉滴注。2 h后病人突发腹痛加剧且伴有意识丧失,心电监护示心室颤动,反复给予肾上腺素静脉推注、心脏胸外按压、电除颤等措施抢救,最终病人因恶性心律失常死亡(图1)。
1.2 派姆单抗(Pembrolizumab)治疗胰腺恶性肿瘤
病人,男,63岁。入院诊断为:胰腺低分化腺癌并肝转移、2型糖尿病、高血压(Ⅲ级,很高危)、自身免疫性甲状腺炎。病人应用4个周期PS化疗(紫杉醇脂质体(力朴素)240 mg第1天;替吉奥每次60 mg每日2次,第1~14天)后,病情稳定(PD)。于2016年12月20日输注Pembrolizumab 0.2 g。2017年1月9日病人诉乏力、腹胀、视物模糊。查体:右侧眼睑不对称性下垂,右侧眼球运动较左侧差。考虑病人未合并肿瘤颅脑转移,推测眼部症状为应用Pembrolizumab药物后不良反应导致。给予肾上腺皮质激素0.5 mg/kg治疗,单侧眼睑下垂进行性发展为双侧,且双侧眼球运动受限,右侧为著;乏力症状加重,伴有明显胸闷、憋气。心电图检查示:房室传导阻滞(图2)。血常规:白细胞24.05×109/L;免疫球蛋白:IgG 17.6 g/L,IgE 183 kU/L,IgA 1.05 U/L,IgM 0.69 U/L,高敏肌钙蛋白0.650 μg/L,肌红蛋白1 497 μg/L;肝功能:谷丙转氨酶231.39 U/L,谷草转氨酶 83.12 U/L;心肌酶谱:肌酸激酶1 600.83 U/L,肌酸激酶同工酶107.00 U/L,乳酸脱氢酶761.64 U/L。综合各项指标考虑病人可能由于应用ICB引起的肌肉、肝脏以及心脏免疫性损伤。于2017年1月20日开始给予血浆置换3 d、甲泼尼龙琥珀酸钠(每日80 mg,共5 d)及免疫球蛋白(10 g/d,共4 d)等对症支持治疗后,病人双侧眼睑下垂较前有所改善,但仍诉伴干涩、复视,乏力明显,伴有心慌、腹胀、胸闷憋气。复查相关血液指标显示:白细胞15.74×109/L,谷丙转氨酶151.36 U/L,谷草转氨酶78.35 U/L,肌酸激酶1 039.17 U/L,肌酸激酶同工酶78.90 U/L,乳酸脱氢酶445.29 U/L。心电图示:Ⅲ度房室传导阻滞,室性逸搏。考虑病人尽管仍存在肌无力、双侧眼睑下垂,但均有所改善,且肌酸激酶呈下降趋势。
2017年1月26日给予甲泼尼龙琥珀酸钠(40 mg/d,共7 d)、丙种球蛋白(10 g/d,共3 d)以及保肝等对症治疗。2017年2月2日各项实验室检查指标好转,病人恢复窦性心率(图2)。2017年2月3日病人甲泼尼龙琥珀酸钠剂量减至8 mg/d,出院。2017年2月8日及2017年2月13日门诊复查,病人自诉乏力症状改善,查体肌力、肌张力均较前恢复,双眼睑下垂症状缓解,双眼球运动可;复查心肌酶谱、免疫球蛋白均较前下降,改为甲泼尼龙琥珀酸钠4 mg/d维持治疗。2017年2月24日随访,病人诉乏力症状好转;双眼活动好,双眼睑对称,四肢肌力可;复查血液指标:白细胞10.93×109/L,谷丙转氨酶30 U/L,谷草转氨酶19 U/L,肌酸激酶同工酶36.09 U/L。其后病人终止随访。
1.3 派姆单抗(Pembrolizumab)治疗鼻咽恶性肿瘤
病人,男,43岁。入院诊断为:鼻咽恶性肿瘤(鳞癌,Ⅳ期)多周期综合治疗后,多发骨转移、肝转移。病人2015年3月17日开始应用6周期TP方案化疗:多西他赛100 mg第1天+顺铂45 mg第1~3天,并行31次放射治疗;同时应用8周期尼妥珠单抗治疗(每周200 mg)。2、4周期治疗后评估病情为PD,6周期后复查腰椎磁共振示腰椎转移。于2015年10月13日行腰椎放疗14次,2015年10月20日开始口服卡培他滨片1.5 g,每日2次,共服用14 d。2周期后复查PET-CT示:腰椎L3、骶骨、髂骨、胸骨多处骨转移,肝囊肿,代谢增高,不除外恶变。2016年1月17日开始行2周期TP+卡培他滨方案化疗:多西他赛40 mg第1、8天+顺铂30 mg第1、8天+卡培他滨1 g第1~14天。2周期后复查腹部磁共振示肝转移。2016年3月27日开始行4周期GP方案化疗:吉西他滨1.6 g第1、8天+卡铂600 mg第1天。2、4周期后复查,肝转移灶较前缩小(由13.0 mm×8.0 mm缩小至5.5 mm×4.5 mm)。后病人因化疗后骨髓抑制停止化疗。2016年7月27日开始注射Pembrolizumab 200 mg/d,每21 d用药1次。2周期后复查腹部磁共振示肝转移灶较前进展(9.0 mm×6.0 mm);应用4周期后病人出
[CM(25*2]现心悸。实验室检查:FT4 32.31 pmol/L,FT3 15.47 pmol/
L,TSH 0.164 mU/L。服用琥珀酸美托洛尔缓释片47.5 mg每日1次,心悸症状缓解。治疗9周后病人自诉乏力明显,四肢肌力明显降低,伴腹胀、厌食。复查甲状腺功能:FT4 7.14 pmol/L,FT3 1.61 pmol/L,TSH 7.537 mU/L。肝功能:总胆红素9.6 μmol/L,谷草转氨酶210 U/L。心肌酶谱:乳酸脱氢酶2 609 U/L,肌酸激酶76 U/L。血常规:T细胞总数0.43,自然杀伤细胞0.43,活化T细胞0.13。考虑应用Pembrolizumab后导致免疫反应可能,遂应用醋酸泼尼松片每次10 mg、每日2次,左甲狀腺素钠片125 μg每日1次以及保肝等对症处理。治疗4个月后病人出现体温增高,多于午后发热,体温最高38.8 ℃,伴畏寒、寒战,同时乏力、腹胀、食欲下降症状较前加重。查体可见:病人双手震颤,手部肌肉轻微非自主性抽搐。遂改醋酸泼尼松片40 mg每日2次治疗。Pembrolizumab治疗8月后病人乏力及腹胀明显加重,无法持久站立、行走,进食吞咽较前困难。复查肝功能:谷丙转氨酶112.00 U/L,谷草转氨酶418.00 U/L,总胆红素71.97 μmol/L,直接胆红素48.93 μmol/L;心肌酶谱:肌酸激酶112.00 U/L,肌酸激酶同工酶78.0 U/L。CD4绝对计数141×106/L。免疫球蛋白:IgG 18.60 g/L,IgA 6.68 g/L。考虑不排除Pembrolizumab应用后导致免疫损伤的可能,遂给予甲泼尼龙琥珀酸钠40 mg/d,丙种免疫球蛋白20 g/d,共3 d。治疗效果不佳,病人腹胀进行性加重,食欲差,卧床状态。应病人及家属要求出院,失访。
2 讨 论
研究表明,PD-1主要存在两种配体,分别是PD-L1和程序性死亡配体-2(PD-L2)。研究显示,PD-L1 mRNA既可分布于淋巴器官(如胸腺、骨髓、脾、淋巴结),也可在非淋巴器官(如心脏、骨骼肌、胎盘、肺、肾脏、肝脏)上表达[5],但其在正常人体中只表达于抗原提呈细胞(巨噬细胞和树突状细胞),只有当与干扰素(IFN)相互作用后,经诱导PD-L1才在其他组织和细胞上表达,包括上皮细胞和内皮细胞等;而PD-L2只在巨噬细胞和树突状细胞上表达,因此PD-1在外周的抑制性功能主要通过PD-L1而非PD-L2来调节。PD-1通过与配体结合抑制T淋巴细胞的功能,促进调节性T细胞的功能,从而抑制自身免疫应答,防止自身免疫性疾病的发生[6-8]。
人类多种肿瘤细胞均可表达PD-L1,肿瘤细胞浸润的淋巴细胞可表达PD-1,二者相互结合从而抑制T淋巴细胞的功能,促进调节性T细胞的功能,导致CD8+T细胞介导的肿瘤免疫应答受抑制[9]。研究显示,肿瘤微环境中PD-1/PD-L1相互作用可以抑制淋巴细胞增殖和活化,诱导抗原特异性T细胞凋亡,促进CD4+T细胞向Foxp3+调节性T细胞分化,导致T细胞功能障碍;也可以抑制调节性T细胞的功能,介导免疫抑制,从而削弱机体的抗肿瘤免疫应答,最终导致肿瘤免疫逃逸的发生。抗PD-1及抗PD-L1单抗可通过阻断PD-1受体与其配体PD-L1和PD-L2相结合,从而解除T细胞活性受抑制的状态,促进活化T细胞对肿瘤细胞的攻击。因此,阻断PD-1/PD-L1信号通路的激活有抑制肿瘤免疫微环境形成的作用,上调T细胞免疫杀伤及监测功能使机体抗肿瘤的免疫作用提高[10-11]。国外研究同样显示,PD-1抗体在多种小鼠肿瘤模型中能促进细胞毒性T淋巴细胞增殖,加速肿瘤退化[12-13]。目前,随着抗PD-1抗体应用越来越广泛,人们观察到病人产生了自身免疫反应相关的症状,如免疫相关肺炎、肠炎、肝炎和皮肤红斑等。另一方面,越来越多的研究显示,PD-1/PD-L1也与自身免疫性疾病如系统性红斑狼疮、特发性血小板减少性紫癜、多发性硬化症、重症肌无力等密切相关[14]。夏媛媛等[15]研究显示,ICB的主要不良反应为消化道反应、骨髓抑制、发热、皮疹、肝功能损害等,主要为Ⅰ~Ⅱ度反应,病人耐受良好;但考虑大部分病人ICB与化疗及靶向治疗联合进行,不良反应率存在一定偏倚。本文3例病人在应用PD-1单抗治疗后均出现了不同程度的消化道反应,主要表现为泛酸、腹胀、食欲下降;第2和第3例病人均发生了不同程度的乏力、心肌损伤、心律失常及肝功能损害,第1例病人由于心脏意外发生突然,无法查明有无肌肉及肝功能损伤。国外曾有应用Pembrolizumab治疗病人出现心包填塞、重症肌无力、骨关节炎和腱鞘炎等相关不良反应的报道;还有报道2例病人应用Pembrolizumab治疗后引起上睑下垂、眼部重症肌无力,应用糖皮质激素治疗后症状好转[16-17]。本文第2例病人既往有自身免疫性甲状腺炎病史,在进行第1周期Pembrolizumab治疗后21 d出现急性重症肌无力,并侵犯多个系统,尤其是心肌、肝脏、消化系统等,在应用血浆置换、输注免疫球蛋白及糖皮质激素治疗后,病人免疫反应得以控制;第3例病人在应用4周期Pembrolizumab后出现了自身免疫性甲状腺炎的临床表现以及进行性加重的消化系统反应、肝功能损害以及骨骼肌损伤,在应用糖皮质激素及免疫球蛋白治疗后,其乏力、腹胀和肝脏损伤症状并无明显控制,但不排除病人由于多发肝脏转移对肝脏损伤产生的影响。因此推测,存在自身免疫性疾病的病人全身其他组织及细胞上可能高表达PD-L1,应用Pembrolizumab治疗后更易出现全身多系统免疫损伤,其具体机制还有待进一步研究。
ICB的应用为实体瘤的治疗提供了更好的前景,但是其副作用并不完全清楚。在使用ICB之前,应对病人进行严格的检查,明确病人有无自身免疫性甲状腺炎、自身免疫性肝炎、风湿、类风湿、系统性红斑狼疮等免疫系统疾病,对于患有自身免疫性疾病的病人,应谨慎应用;应用过程中要密切观察有无新发生的肝功能异常、肌肉损伤症状、心率异常等,从而避免ICB导致机体产生自身免疫性损伤。
[参考文献]
[1]SABBATINO F, VILLANI V, YEARLEY J H, et al. PD-L1 and HLA class Ⅰ antigen expression and clinical course of the disease in intrahepatic cholangiocarcinoma[J]. Clinical Cancer Research, 2016,22(2):470-478.
[2]CHEN D S, MELLMAN I. Oncology meets immunology: the cancer-immunity cycle[J]. Immunity, 2013,39(1):1-10.
[3]LINARDOU H, GOGAS H. Toxicity management of immunotherapy for patients with metastatic melanoma[J]. Annals of Translational Medicine, 2016,4(14):272-277.
[4]WOLCHOK J D, KLUGER H, CALLAHAN M K, et al. Nivolumab plus ipilimumab in advanced melanoma[J]. The New England Journal of Medicine, 2013,369(2):122-133.
[5]DONG H, ZHU G, TAMADA K, et al. B7-H1, a third member of the B7 family, co-stimulates T-cell proliferation and interleukin-10 secretion[J]. Nature Medicine, 1999,5(12):1365-1369.
[6]TARHINI A A, ZAHOOR H, YEARLEY J H, et al. Tumor associated PD-L1 expression pattern in microscopically tumor positive sentinel lymph nodes in patients with melanoma[J]. Journal of Translational Medicine, 2015,13(1):319-326.
[7]MEZACHE L, PANICCIA B, NYINAWABERA A A. Enhanced expression of PD L1 in cervical intraepithelial neoplasia and cervical cancers[J]. Modern Pathology, 2015,28(12):1594-1602.
[8]吳介恒,杨安钢,温伟红. PD-1/PD-L1参与肿瘤免疫逃逸的研究进展[J]. 细胞与分子免疫学杂志, 2014,30(7):777-780.
[9]WAUGH K A, LEACH S M, SLANSKY J E. Targeting transcriptional regulators of CD8+ T cell dysfunction to boost anti-tumor immunity[J]. Vaccines, 2015,3(3):771-802.
[10]PARDOLL D M. The blockade of immune checkpoints in cancer immunotherapy[J]. Nature Reviews Cancer, 2012,12(4):252-264.
[11]AMARNATH S, MANGUS C W, WANG J C, et al. The PDL1-PD1 axis converts human T(H)1 cells into regulatory T cells[J].
Science Translational Medicine, 2011,3(111):111-120.
[12]TOPALIAN S L, DRAKE C G, PARDOLL D M. Targeting the PD-1/B7-H1(PD-L1) pathway to activate anti-tumor immunity[J]. Current Opinion in Immunology, 2012,24(2):207-212.
[13]LOTE H, CAFFERKEY C, CHAU I. PD-1 and PD-L1 blo-ckade in gastrointestinal malignancies[J]. Cancer Treatment Reviews, 2015,41(10):893-903.
[14]GIANCHECCHI E, DELFINO D V, FIERABRACCI A. Recent insights into the role of the PD-1/PD-L1 pathway in immunological tolerance and autoimmunity[J]. Autoimmunity Reviews, 2013,12(11):1091-1100.
[15]夏媛媛,张国庆,胡毅. PD-1单抗治疗晚期肿瘤的临床疗效[J]. 现代肿瘤医学, 2016,24(23):3783-3786.
[16]KUSHNIR I, WOLF I. Nivolumab-Induced pericardial tamponade: a case report and discussion[J]. Cardiology, 2017,136(1):49-51.
[17]NGUYEN B H, KUO J, BUDIMAN A, et al. Two cases of clinical myasthenia gravis associated with pembrolizumab use in responding melanoma patients[J]. Melanoma Research, 2017,27(2):152-154.

