广西北部湾近海产胞外多糖细菌多样性及其抗氧化活性分析
禤金彩 刘红全 何秀苗 陈博文 成鑫花 廖秋妮 陈艳艳 李尚泉 吴家法 龙寒



摘要:【目的】鑒定广西北部湾近海产胞外多糖(EPS)的海洋细菌种类多样性,并测定其EPS生物学活性,为后续研究EPS活性及其开发利用打下基础。【方法】采用黏液比色法、乙醇沉法和苯酚硫酸法初筛产EPS细菌,通过16S rDNA序列鉴定细菌种属并进行遗传进化分析,以1,1-二苯基-2-三硝基苯肼(DPPH)测定EPS的抗氧化活性。【结果】从广西北部湾近海海水、沙粒和红树林泥土中共分离出205株产EPS细菌,结合分离株的菌落特征和形态观察结果可将所分离获得的细菌归为28种细菌。对28株代表细菌株进行鉴定,结果显示分属于2个纲(芽孢杆菌纲和γ-变形菌纲)、4个目(芽孢杆菌目、假单胞菌目、弧菌目和肠杆菌目)、4个科(芽孢杆菌科、莫拉菌科、弧菌科和肠杆菌科)、6个属(芽孢杆菌属、葡萄球菌属、弧菌属、发光杆菌属、变形杆菌属和不动杆菌属)、15个种;优势菌属为芽孢杆菌属,占所鉴定菌株的71.43%,其次为葡萄球菌属、弧菌属、发光杆菌属、变形杆菌属和不动杆菌属。EPS活性检测结果显示,不同种属细菌所产EPS均具有一定的DPPH清除作用,但不同菌株间差异明显,清除率为9.43%~71.10%。【结论】从广西北部湾近海地区共分离鉴定出2纲4目4科6属15种产EPS的海洋细菌,以芽孢杆菌属为主,存在种类多样性,且各类细菌分泌产生的EPS均具有一定抗氧化活性。
关键词: 海洋细菌;胞外多糖;16S rDNA;多样性;抗氧化活性;广西北部湾
中图分类号: S917.1 文献标志码: A 文章编号:2095-1191(2019)10-2335-08
Diversities and antioxidant activities of exopolysaccharide-producing marine bacteria isolated from
Beibu Gulf Coast in Guangxi
CHEN Bo-wen 1, CHENG Xin-hua1, LIAO Qiu-ni1, CHEN Yan-yan1, LI Shang-quan1, WU Jia-fa1, LONG Han1, XUAN Jin-cai1, LIU Hong-quan1, HE Xiu-miao1,2*
(1 School of Marine Sciences and Biotechnology, Guangxi University for Nationalities/Guangxi Colleges and Universities Key Laboratory of Utilization of Microbial and Botanical Resources, Nanning 530006, China; 2Guangxi University for Nationalities/Guangxi Key Laboratory Cultivation Base for Polysaccharide Materials and Modifications, Nanning 530006, China)
Abstract:【Objective】The present study identified the diversity of exopolysaccharide-producing marine bacterial species isolated from Beibu Gulf area of Guangxi and determined the biological activities of exopolysaccharide(EPS), which would provide references for further study of its activity and development. 【Method】The EPS-producing bacteria were screened by using mucilage colorimetry, ethanol precipitation and phenol sulfuric acid. The bacterial species were identified by 16S rDNA sequence, as well as their genetic evolution analysis. Finally, the antioxidant activities of bacterial EPS was determined by 1,1-diphenyl-2-trinitrophenyl hydrazine(DPPH) method. 【Result】As a result, 205 strains of EPS-producing bacteria were isolated from the seawater, sea mud and sand samples of Beibu Gulf in Guangxi. Based on the colony characteristics and morphological observation, all the bacteria isolated were classified into 28 strains. The 28 representative strains were selected and further identified by 16S rDNA sequencing, and the results showed that 28 strains belonged to 2 classes (Bacilli and γ-Proteobacteria), 4 orders(Bacillales, Pseudomonadales, Vibrionales and Enterobacteriales), 4 families (Bacillaceae, Moraxellaceae, Vibrionaceae and Enterobacteriaceae), 6 genera (Bacillus, Staphylococcus, Acinetobacter, Vibrios, Photobacterium and Proteus), and 15 species. The dominant genus was Bacillus, accounting for 71.43% of the identified strains, followed by Staphylococcus, Vibrios, Photobacterium, and finally Proteus and Acinetobacter. The antioxidant activity test results showed that, the EPS from different species of identified bacteria showed a certain DPPH scavenging effects, however, the effect varied greatly among different strains, and the scaven-ging rates varied between 9.43%-71.10%. 【Conclusion】Fifteen species of EPS-producing marine bacteria, which belong to 6 genera, 4 families, 4 orders, 2 classes, are isolated and identified from mangrove soil samples in Beibu Gulf of Guangxi. The dominant genus is Bacillus. And species diversity exists among the EPS-producing marine bacteria. The EPS secreted by these identified bacterial strains has certain antioxidant activity.
Key words: marine bacteria; exopolysaccharide(EPS); 16S rDNA ; diversity; antioxidant activity; Beibu Gulf of Guangxi
0 引言
【研究意义】胞外多糖(Exopolysaccharide,EPS)是微生物分泌到细胞壁外、易与细菌菌体分离的水溶性多糖化合物,是微生物适应环境的产物,因具有抗肿瘤、抗氧化、抗细菌、抗病毒、免疫调节等生物活性及乳化活性、重金属吸附能力等非生物学活性(黄晓波和赵良启,2006;梁宁等,2011)而备受关注。海洋微生物物种丰富,且很多海洋细菌都是潜在的EPS生产者。广西北部湾气候条件独特,尤其是微生物种质资源非常丰富,因此,研究分析广西北部湾海洋产EPS细菌多样性及其生物学活性,对开发利用广西北部湾微生物资源具有重要意义。【前人研究进展】近年来,国内外学者对不同近岸海域产EPS微生物进行了大量研究。李京宝(2007)从青岛近海样品中筛选到一株产活性EPS的海洋弧菌,并证实其分泌产生的EPS不仅可抑制生物膜形成,还能破坏已形成的生物膜,对铜绿假单胞菌、金黄色葡萄球菌和表皮葡萄球菌等常见菌株的生物膜具有良好抑制作用。汤城(2007)从黄海潮间带分离获得一株产EPS的枯草芽孢杆菌LN54,并证实分泌产生的EPS具有良好的体内抑瘤活性,且对小鼠安全无毒,可开发成一种免疫增强型抗肿瘤药物。房耀维等(2010)从连云港海域样品中筛选获得一株产抗氧化活性较强EPS的细菌菌株,通过形态学、生理生化及16S rRNA分析,鉴定为枯草芽孢杆菌,其分泌的EPS对 ·OH和[O][2] 有较好的清除效果,具有潜在的食品及医药应用价值。此外,Roca等(2016)在马拉群岛近海岸海域分离到一株产黏性EPS的假交替单胞菌,Brian-Jaisson等(2016)在法国土伦湾海域分离出一株产EPS的海洋假交替单胞菌,且证实所产的EPS具有抗生物膜形成活性。上述研究结果表明,不同地理环境的近岸海域具有丰富而多样的产EPS菌株,且这些EPS具有独特的生物活性。在广西北部湾海域,梁静娟等(2006)从北部湾红树林泥土中分离获得一株产EPS而具有抗肿瘤活性的芽孢杆菌;陈佳(2015)、龙寒等(2016)在北部湾红树林中分离获得产EPS的芽孢杆菌和弧菌,且证实这两株菌株分泌产生的EPS均具有明显的免疫增强活性和抗肿瘤细胞生长活性。【本研究切入点】广西北部湾海域细菌具有产各种活性EPS的潜能,但目前针对该海域产EPS细菌多样性的研究鲜见报道。【擬解决的关键问题】通过16S rDNA序列鉴定分析广西北部湾近海产EPS细菌的多样性,更好地利用该海域丰富的微生物资源,筛选分离获得生物学活性独特的EPS,为后续研究EPS活性及其开发利用打下基础。
1 材料与方法
1. 1 样品采集
于广西北部湾钦州(东经108°60′~108°76′,北纬21°61′~21°83′)、防城港(东经108°06′~108°18′,北纬21°52′~21°53′)、北海(东经109°12′~109°28′,北纬21°25′~21°35′)等近海地区,以无菌采样器采集海水、海沙、红树林根际泥土等样品分别装入50 mL的无菌离心管中,并放置在4 ℃保温箱内带回实验室处理。
1. 2 试验材料
微生物裂解液和1,1-二苯基-2-三硝基苯肼(DPPH)购自康为世纪生物科技有限公司,其他化学试剂均为国产分析纯试剂。16S rDNA扩增引物GM5F/907R(GM5F:5'-CCTACGGGAGGCAGCA G-3';907R:5'-CCGTCAATTCCTTTGAGTTT-3')参照Clarke等(2004)的方法合成,委托生工生物工程(上海)股份有限公司设计,预期扩增目的片段长度为590 bp。LB固体培养基(g/L):酵母粉5.0 g,氯化钠5.0 g,蛋白胨10.0 g,琼脂18.0~20.0 g,蒸馏水500.0 mL,人工海水500.0 mL,pH 7.4~7.6;LB液体培养基(g/L):酵母粉5.0 g,氯化钠5.0 g,蛋白胨10.0 g,蒸馏水500.0 mL,人工海水500.0 mL,pH 7.4~7.6;摇瓶发酵培养基(g/L):蔗糖4.0 g,酵母膏3.0 g,CaCO3 0.1 g,蒸馏水500.0 mL,海水500.0 mL,pH 7.4~7.6。
1. 3 样品中细菌筛选及分离纯化
按5%比例将采集样品装入盛有LB液体培养基的锥形瓶中,28 ℃下摇床(180 r/min)培养24 h。取上层培养液按10-6~10-9稀释后,分别涂布在LB固体培养基上,28 ℃培养24 h。根据黏液比色法,初步挑取具有黏性的单菌落接种到装有10.0 mL发酵培养基的摇瓶中,28 ℃下摇床(150 r/min)发酵培养48 h。取2.0 mL发酵液,6000 r/min离心10 min,吸取上清液并加入4倍体积的无水乙醇,置于4 ℃冰箱中醇沉8 h后以7000 r/min离心并收集沉淀、干燥沉淀。以去离子水溶解沉淀,利用苯酚硫酸法测定溶解液OD(490 nm),最终筛选出产EPS的海洋细菌。
1. 4 16S rDNA序列扩增及测序分析
取分离的菌株种子液50.0 μL加入EP管中,12000 r/min离心5 min后去除上清液,再加入100.0 μL微生物裂解液并置于80 ℃水浴中作用20 min。裂解后以10000 r/min离心,取4.0 μL上清液进行PCR扩增。PCR反应体系25.0 µL,包括2×Taq Mix 12.5 µL,DNA模板4.0 µL,上、下游引物各2.0 µL,双蒸水4.5 µL。扩增程序:94 ℃预变性3 min;94 ℃ l min,50 ℃ 1.5 min,72 ℃ 3 min,进行30个循环;72 ℃延伸6 min。PCR扩增产物在80 V电压下,以10.0 g/L琼脂糖凝胶电泳30 min,通过凝胶成像仪观察目的条带。阳性PCR扩增产物送至广州天一辉远基因科技有限公司测序。
测序结果先用SeqMan进行序列拼接,获得的序列输入EzBioCloud网站(www.ezbiocloud.net)上的16S-based ID进行序列比对分析,与模式菌株进行比较,对待测菌株进行分子鉴定;同时采用MEGA 5.1中的非加权组平均法(UPGMA),构建基于16S rDNA序列相似度的系统发育进化树,根据Kimura-2-parameter进行评估矩阵分析。
1. 5 DPPH清除能力测定
将7.9 mg DPPH溶于100.0 mL无水乙醇,混匀,待用。分别向1.0 mL DPPH乙醇溶液中加入1.0 mL不同浓度的EPS样品,常温下避光静置30 min;另取1.0 mL DPPH乙醇溶液和1.0 mL蒸馏水作为对照组,以1.0 mL乙醇和1.0 mL不同浓度的EPS样品作为空白组;收集上清液并在517 nm处测定其吸光值(A),每个样品3次重复,并依据下列公式计算EPS的DPPH清除率。
清除率(%)=[1-(Ai-Aj/A0)]×100
式中,Ai为试验组OD,Aj为空白组OD,A0为对照组OD。
2 结果与分析
2. 1 细菌筛选结果
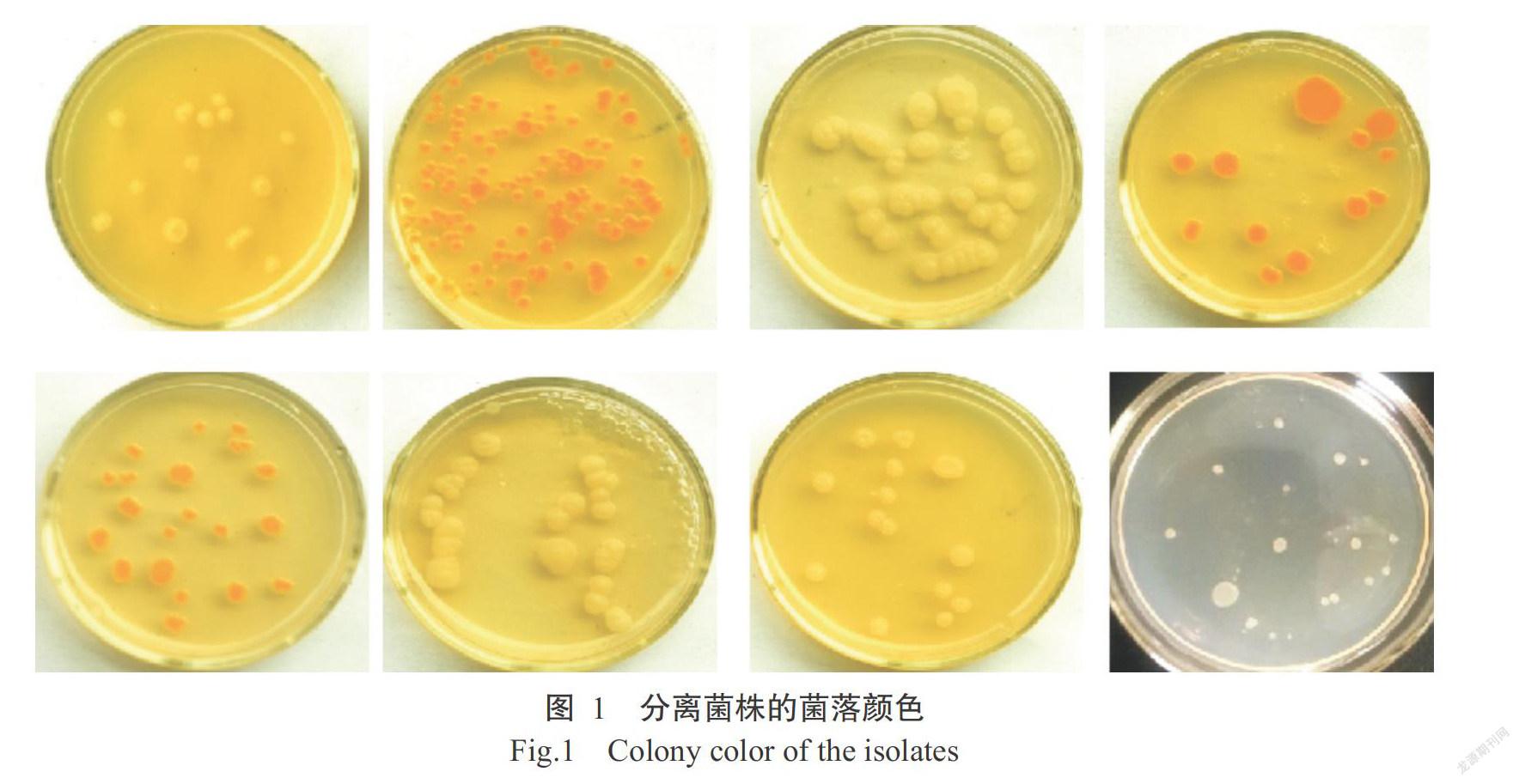
通过菌落黏性和苯酚硫酸法,从广西北部湾近海地区海水、沙子和红树林泥土样品中共筛选出205株产EPS海洋细菌。依据菌落颜色(图1)进行分类,分离菌株主要以乳白色为主,其中,乳白色菌株122株,乳黄色菌株30株,浅黄色菌株11株,中间橙外透明菌株1株,白色菌株18株,橙黄菌株18株,中间黄色外白色菌株2株,橙红色菌株3株。根据细菌形态(图2)进行分类,分离菌株以杆状菌株为主,其中,杆状菌株65株,长杆状菌株36株,点状菌株32株,短杆状菌株45株,球状菌株19株,弧状菌株27株。此外,分离菌株中革兰氏染色阳性菌株156株、阴性菌株49株。结合分离株的菌落特征和形态观察结果,可将所分离获得的细菌归为28种细菌,并从中选出28株作为代表株进行后续分子鉴定。
2. 2 分离菌株16S rDNA序列扩增结果
以引物GM5F/907R对获得的28株代表菌株进行16S rDNA序列PCR扩增及电泳检测,结果显示,所有代表菌株均扩增获得590 bp的目的条带(图3),与预期结果相符。
2. 3 基于16S rDNA序列的细菌分类结果
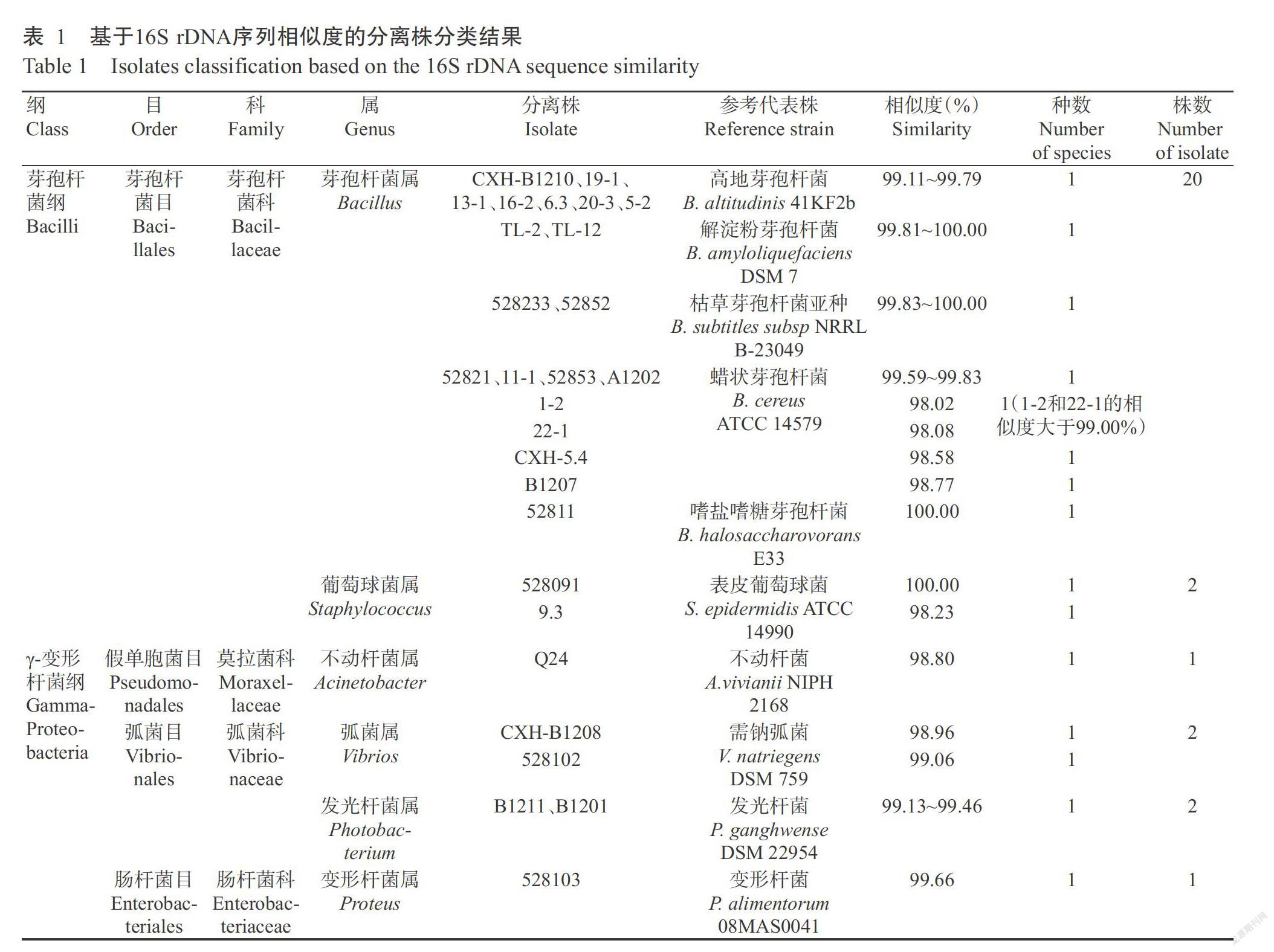
分离菌株16S rDNA序列在EzBioCloud网站上进行统计分析,结果如表1所示,28株代表菌株分属于芽孢杆菌纲(22株)和γ-变形杆菌纲(6株)两大纲。在芽孢杆菌纲中,20株隶属于芽孢杆菌目/芽孢杆菌科/芽孢杆菌属,2株隶属于葡萄球菌属;γ-变形杆菌纲中,1株隶属于假单胞菌目/莫拉菌科/不动杆菌属,2株隶属于弧菌目/弧菌科/弧菌屬,2株隶属于弧菌科/发光杆菌属,1株隶属于肠杆菌目/肠杆菌科/变形杆菌属。可见,优势菌属为芽孢杆菌属,占所鉴定菌株的71.43%,其次为葡萄球菌属、弧菌属、发光杆菌属、变形杆菌属和不动杆菌属。
在获得所有代表菌株的纲目科属分类后,将代表菌株的16S rDNA序列与模式菌株的相应序列进行进一步比对分析,一般认为16S rDNA序列相似度超过99.00%即视为同种,相似度在95.00%~99.00%视为相同属不同种,相似度低于95.00%的视为不同属不同种。根据这一判定标准,28株代表菌株分属于15个不同菌种(表1)。其中,CXH-B1210等7株代表菌株与高地芽孢杆菌(41KF2b)的相似度大于99.00%,属于同一种;TL-2和TL-12株与解淀粉芽孢杆菌(DSM 7)的相似度超过99.00%,为同一种;同理,528233和52852株与枯草芽孢杆菌亚种(NRRL B-23049)属于同一种;52821等8株代表菌株均属于蜡状芽孢杆菌(ATCC 14579)亚种,但只有4株(52821、11-1、52853和A1202株)与蜡状芽孢杆菌(ATCC 14579)的相似度大于99.00%,属于同一种;另外4株代表菌株经比对分析,分属于3个种;52811株与嗜盐嗜糖芽孢杆菌(E33)属于同一种;528091和9.3株与表皮葡萄球菌(ATCC 14990)属于同一种;Q24株与不动杆菌(NIPH 2168)属于同一种;CXH-B1208和528102株与需钠弧菌(DSM 759)属于同一种;B1201和B1211株与发光杆菌(DSM 22954)属于同一种;528103株与变形杆菌(08MAS0041)属于同一种。
2. 4 分离菌株的遗传进化分析结果
代表菌株的16S rDNA序列与模式菌株的相应序列通过MEGA 5.1进行序列分析,构建系统发育进化树,结果显示28株代表菌株可分为两大分支,分属于两个纲(图4),且在遗传距离为0.022处又进一步被分为6个小分支,即分别与6个不同属(弧菌属、发光杆菌属、变形杆菌属、不动杆菌属、葡萄球菌属和芽孢杆菌属)聚类。在芽孢杆菌属中,CXH-B1210等7株代表菌株与高地芽孢杆菌(41KF2b)同属于一个分支,TL-2和TL-12株与解淀粉芽孢杆菌(DSM 7)同属于一个分支,528233和52852株与枯草芽孢杆菌亚种(NRRL B-23049)属于一个分支,52821等8株代表菌株与蜡状芽孢杆菌(ATCC 14579)同属于一个分支,遗传进化树中的分支情况与细菌分类和序列相似度比对分析结果一致。
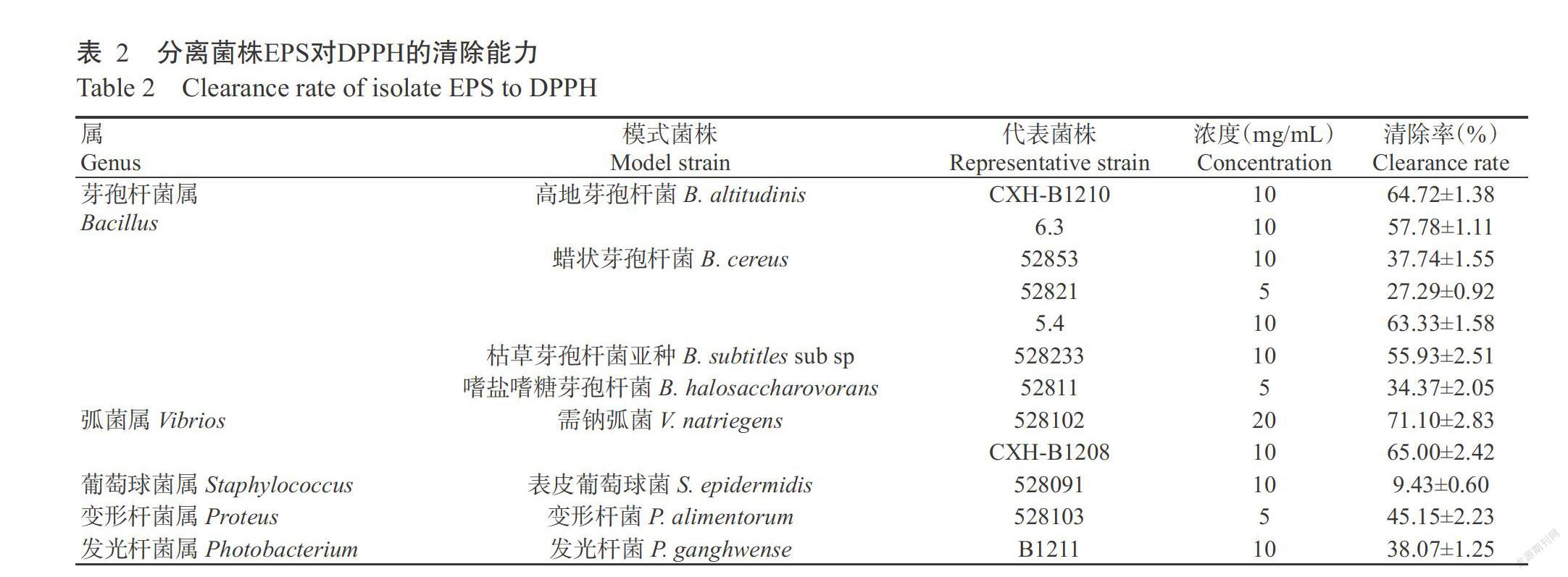
2. 5 分离菌株EPS对DPPH的清除能力结果
各分离菌株EPS对DPPH的清除能力测定结果如表2所示,2株高地芽孢杆菌(CXH-B1210和6.3株)EPS对DPPH的清除能力为57.78%~64.72%,3株蜡状芽孢杆菌EPS对DPPH的清除能力为27.29%~63.33%,枯草芽孢杆菌亚种528233株EPS的DPPH清除能力为55.93%,嗜盐嗜糖芽孢杆菌(52811株)EPS的DPPH清除能力为34.37%,2株需钠弧菌(CXH-B1208和528102株)EPS的DPPH清除能力分别为65.00%和71.10%,表皮葡萄球菌(528091株)EPS的DPPH清除能力为9.43%,变形杆菌(528103株)EPS的DPPH清除能力为45.15%,发光杆菌(B1211株)EPS的DPPH清除能力为38.07%。在EPS浓度为20.0 mg/mL时,需钠弧菌528102株EPS的DPPH清除能力最高,达71.10%;在EPS浓度为10.0 mg/mL时,需钠弧菌CXH-B1208株的清除能力也最高,达65.00%,最低的是表皮葡萄球菌528091株。综上所述,不同种属、不同菌株EPS的DPPH清除能力差异明显。
3 讨论
特殊的海洋环境蕴藏着丰富的功能性微生物资源,而产EPS海洋细菌的筛选及EPS活性分析已成为当前海洋微生物资源利用的一个重要研究内容。本研究从广西北部湾钦州、北海防城港等近岸海水、沙粒和红树林根际泥土等样品中共分离出205株产EPS的海洋细菌,经过初步分类及代表株的16S rDNA序列测定分析,發现分离获得的细菌分属于2个纲、4个目、4个科、6个属、15个种,其中以芽孢杆菌纲/芽孢杆菌目/芽孢杆菌属细菌为主,其次是葡萄球菌属、弧菌属、发光杆菌属,最后是变形杆菌属和不动杆菌属,表明广西北部湾近岸海域产EPS细菌以芽孢杆菌为主,并存在种类多样性。不同种类菌株EPS的DPPH清除率检测结果表明,不同种属细菌所产EPS均具有一定的DPPH清除作用,但清除效果在不同菌株间存在明显差异,此研究结果为广西北部湾海洋微生物资源利用,特别是产EPS细菌的深入研究打下了坚实基础。
对于广西北部湾近岸海域产EPS细菌收集与分离,王松柏(2005)在北部湾红树林泥样中筛选获得具有抗肿瘤活性的产EPS海洋细菌,并鉴定该产EPS细菌属于芽孢杆菌属;马波(2006)在北部湾涠洲岛附近海水样品中也筛选获得EPS产量较高的海洋细菌,并鉴定为芽孢杆菌属;陈佳(2015)、龙寒等(2016)在北部湾钦州近海海水、红树林泥样中利用苯胺蓝培养基筛选出具有免疫调节活性的产EPS细菌,鉴定证实该分离菌株隶属于弧菌属和芽孢杆菌属。结合上述报道的研究结果及本研究结果,进一步证实广西北部湾近岸海域产EPS细菌存在种属多样性,且以各类芽孢杆菌为主。本研究结果初步探究了广西北部湾近岸海域功能性微生物的多样性,但该海域是否还存在其他种类的产EPS细菌,有待于扩大样品采集范围和分季节采样等进行深入分离鉴定。此外,对于其他海域,如威海近海(刘天华等,2011)、山东荣成海域(张晓飞,2012)、天津入海口(杨波等,2017)和黄海沉积物(曹若冰,2018)的产EPS分离菌株也是以芽孢杆菌属细菌为主,与本研究结果一致。各地分离菌株均以芽孢杆菌属细菌为优势菌株,可能与该菌属细菌对外界因子的极强抵抗力有关。
目前,关于海洋细菌EPS活性研究已有较多报道,包括抗氧化活性和免疫调节活性等。有研究表明,植物茶叶多糖的抗氧化能力与多糖中的糖醛酸具有一定线性关系(申明月等,2007),但在细菌EPS方面,Sun等(2015)、El-Newary等(2017)发现极乐杆菌属、芽孢杆菌属细菌含有醛糖酸的EPS对DPPH清除率表现不一,分别为55.40%和99.30%;Guo等(2010)、Ye等(2012)、张曲(2013)发现嗜冷杆菌属、爱德华氏属和假单胞菌属海洋菌株无醛糖酸EPS对DPPH的清除率均超过50.00%。因此,细菌EPS抗氧化能力是否与醛糖酸有关还有待进一步研究。本研究获得的分离菌株产EPS均具有一定DPPH清除能力,但不同种属菌株EPS的DPPH清除能力各不相同,清除率为9.43%~71.10%,与前人的研究结果(Guo et al.,2010;Ye et al.,2012;张曲,2013;Sun et al.,2015;El-Newary et al.,2017)相似,表明不同海洋属细菌EPS的DPPH清除能力有差异,因此今后需对产EPS清除能力强、抗氧化能力高的分离菌株开展扩大筛选研究,并对此类细菌产EPS的其他生物学活性进行深入探究,为获得具有高产EPS并具高抗氧化能力的海洋微生物菌株提供参考依据。
4 结论
从广西北部湾近海地区共分离鉴定出2纲4目4科6属15种产EPS的海洋细菌,以芽孢杆菌属为主,存在种类多样性,且各类细菌产的EPS均具有一定抗氧化活性。
参考文献:
陈佳. 2015. 海洋产胞外多糖菌的筛选、发酵条件优化及其多糖免疫学活性初步探究[D]. 南宁:广西民族大学. [Chen J. 2015. Screening and isolation of marine bacteria secreted exopolysaccharide,optimization of fermentation conditions and the research on the immune activity of the polysaccharide[D]. Nanning: Guangxi University for Nationalities.]
曹若冰. 2018. 一种海洋芽孢杆菌胞外多糖的纯化鉴定及抗肿瘤机制研究[D]. 北京:中国科学院大学. [Cao R B. 2018. Purification,identification and antitumor mechanism studies of a marine polysaccharide isolated from a marine bacillus[D]. Beijing:University of Chinese Aca-demy of Sciences.]
房耀维,吕明生,徐炜枫,刘姝,焦豫良,王淑军. 2010. 产抗氧化胞外多糖海洋细菌的筛选及发酵产糖培养基优化[J]. 食品科学,31(23):276-280. [Fang Y W,Lü M S,Xu Y F,Liu W,Jiao Y L,Wang S J. 2010. Screening and optimization of fermentation medium of an antioxidant exopolysaccharide-producing marine strain[J]. Food Science,31(23):276-280.]
黄晓波,赵良启. 2006. 细菌胞外多糖的研究和应用[J]. 山西化工,26(1):10-13. [Huang X B,Zhao L Q. 2006. Research and application of the exopolysaccharides (EPS) from bacteria[J]. Shanxi Chemical Industry,26(1):10-13.]
龙寒,陈盛峰,陈佳,杨迪,李晓燕,黄玉油,何秀苗,禤金彩. 2016. 一株产胞外多糖海洋弧菌的分离鉴定及其多糖抗肿瘤活性初步研究[J]. 生物技术通报,32(12):166-171. [Long H,Chen S F,Chen J,Yang D,Li X Y,Huang Y Y,He X M,Xuan J C. 2016. Isolation and identification of marine Vibrio producing extracellular polysaccharide(EPS) and the preliminary study on anti-tumor activity of the EPS[J]. Biotechnology Bulletin,32(12):166-171.]
李京宝. 2007. 一种海洋的弧菌胞外多糖A101的抗生物膜作用研究[D]. 青岛:中国海洋大学. [Li J B. 2007. Anti-biofilm effect of a novel exopolysaccharide from marine Vibrio sp QY101[D]. Qingdao:Ocean University of China.]
梁静娟,庞宗文,詹萍. 2006. 红树林海洋细菌的分离鉴定及其活性物質初步分析[J]. 热带海洋学报,25(6):47-51. [Liang J J,Pang Z W,Zhan P. 2006. Isolation and identification of mangroves marine bacteria and analysis of their bioactive products[J]. Journal of Tropical Oceanography,25(6):47-51.]
梁宁,杨磊,李静. 2011. 多糖研究进展[J]. 吉林农业(学术版),(5):321-321. [Liang N,Yang L,Li J. 2011. Progress in polysaccharide research[J]. Jilin Agriculture(Academic Edition),(5):321- 321.]
刘天华,李乐乐,乔梦. 2011. 产胞外多糖海洋细菌的筛选及鉴定[J]. 山东师范大学学报(自然科学版),26(2):122-124. [Liu T H,Li L L,Qiao M. 2011. Screening and identification of marine bacteria with exocellular polysaccharide[J]. Journal of Shandong Normal University(Natural Science Edition),26(2):122-124.]
马波. 2006. 产多糖海洋菌的筛选与发酵动力学研究[D]. 南宁:广西大学. [Ma B. 2006. Screening of exopolysaccharide-producing strain from marine bacterial and fermentation kinetics study[D]. Nanning:Guangxi University.]
申明月,聂少平,谢明勇,罗珍. 2007. 茶叶多糖的糖醛酸含量测定及抗氧化活性研究[J]. 天然产物研究与开发,19(5):830-833. [Shen M Y,Nie S P,Xie M Y,Luo Z. 2007. Studies on the content of uronic acid in tea polysaccharides and its antioxidantive activity[J]. Natural Product Research and Development,19(5):830-833.]
汤城. 2007. 枯草芽孢杆菌抗肿瘤活性物质的研究[D]. 南京:南京大学. [Tang C. 2007. Study on anti-tumor active substances of Bacillus subtilis[D]. Nanjing:Nanjing University.]
王松柏. 2005. 海洋细菌Bacillus pumilus PLM4抗肿瘤胞外多糖的研究[D]. 南宁:广西大学. [Wang S B. 2005. Study on the primary research of antitumor exopolysaccharide of marine Bacillus pumilus PLM4[D]. Nanning:Guangxi University.]
杨波,司晓光,郝建安,张爱君,姜天翔,杜瑾,王静. 2017. 海洋地衣芽孢杆菌的絮凝活性研究及机理探讨[J]. 化学与生物工程,34(10):40-43. [Yang B,Si X G,Hao J A,Zhang A J,Jiang T X,Du F,Wang J. 2017. Flocculation activity and mechanism of marine Bacillus licheniformis[J]. Chemistry & Bioengineering,34(10):40 -43.]
张曲. 2013. 南极菌Psychrobacter sp. B-3胞外低聚糖的结构及其抗氧化活性研究[D]. 青岛:青岛科技大学. [Zhang Q. 2013. Study on structure and antioxidant activity of extracellular oligosaccharides of Antarctic bacteria Psychrobacter sp.B-3[D]. Qingdao:Qingdao University of Science & Technology.]
张晓飞. 2012. 海洋产多糖细菌的筛选及多糖发酵的研究[D]. 济南:山东轻工业学院. [Zhang X F. 2012. The screen of a polysaccharide-producing marine bacteria and the study of its polysaccharide fermentation[D]. Jinan:Shandong Institute of Light Industry.]
Clarke A M,Kirby R,Rose P D. 2004. Molecular microbial ecology of lignocellulose mobilization as a carbon source in mine drainage wastewater treatment[J]. Water SA,30(5):658-661.
Brian-Jaisson F,Molmeret M,Fahs A,Guentas-Dombrowsky L,Culioli G,Blache Y,Cérantola S,Ortalo-Magné A. 2016. Characterization and anti-biofilm activity of extracellular polymeric substances produced by the marine biofilm-forming bacterium Pseudoalteromonas ulvae strain TC14[J]. Biofouling,32(5):547-560.
El-Newary S A,Ibrahim A Y,Asker M S,Mahmoud M G,ElAwady M E. 2017. Production,characterization and biological activities of acidic exopolysaccharide from marine Bacillus amyloliquefaciens 3MS 2017[J]. Asian Pacific Journal of Tropical Medicine,10(7):715-725.
Guo S,Mao W,Han Y,Zhang X H,Yang C L,Chen Y,Chen Y L,Xu J,Li H Y,Qi X H,Xu J C. 2010. Structural characteristics and antioxidant activities of the extracellular polysaccharides produced by marine bacterium Edwardsiella tarda[J]. Bioresource Technology,101(12):4729-4732.
Roca C,Lehmann M,Torres C A V,Baptista S,Gaudêncio S P,Freitas F,Reis M A. 2016. Exopolysaccharide production by a marine Pseudoalteromonas sp. strain isolated from Madeira Archipelago ocean sediments[J]. New Biotechnology,33(4):460-466.
Sun M L,Zhao F,Shi M,Zhang X Y,Zhou B C,Zhang Y Z,Chen X L. 2015. Characterization and biotechnological potential analysis of a new exopolysaccharide from the Arctic Marine Bacterium Polaribacter sp. SM1127[J]. Scientific Reports,5:18435-18447.
Ye S H,Liu F,Wang J H,Wang H,Zhang M P. 2012. Antioxidant activities of an exopolysaccharide isolated and purified from marine Pseudomonas PF-6[J]. Carbohydrate Po-lymers,87(1):764-770.
(責任编辑 兰宗宝)

