木薯NOX基因家族成员的生物信息学及其表达分析
胡 广 梁大成







摘要:【目的】搜索鑒定木薯还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶(NOX)基因家族成员,分析其生物学信息及在不同组织和非生物胁迫下的表达模式,为深入研究该家族基因对木薯块根发育的调控机理及提高木薯抗逆性提供理论参考。【方法】从JGI数据库下载木薯的基因组序列,由pfam数据库下载4个NOX蛋白结构域相关的HMM文件,通过HMMER程序筛选NOX基因家族成员,利用生物信息学分析软件对该家族蛋白的理化性质、氨基酸序列和结构特征进行分析。基于GEO数据库的转录组测序(RNA-Seq)数据,对木薯NOX基因家族成员在不同组织和干旱胁迫下的表达模式进行分析。【结果】从木薯基因组中共鉴定到15个NOX基因家族成员,包括9个NOX基因和6个FRO基因(NOX祖先基因)。FRO基因的外显子数(6~9个)明显少于NOX基因的外显子数(11~14个),且FRO基因的内含子序列较NOX基因短,NOX基因的第一个外显子相对保守。15个NOX基因家族成员分布在木薯的9条染色体和1个结构支架上,且均被定位在染色体末端,除6号染色体有4个基因、8号和14号染色体有2个基因外,其他染色体均只有1个基因。木薯NOX蛋白的分子量和氨基酸数明显高于FRO蛋白,而理论等电点(pI)差异不明显。FRO蛋白含6~9个保守跨膜结构域,而NOX蛋白均只含4个跨膜螺旋区,且均位于第350~750位氨基酸残基。木薯NOX家族蛋白有10个保守结构域,其中Motif1和Motif8存在于所有的NOX和FRO蛋白中,Motif6为NOX蛋白所特有,Motif3只独立存在于FRO蛋白中。NOX蛋白均具有典型的保守结构域和相似的蛋白质结构,其脱氢酶结构域明显折叠成催化域裂缝结构,且C末端氨基酸极度保守。由RNA-Seq数据的基因表达谱可知,NOX基因家族成员在不同木薯叶片、中静脉、叶柄、茎、侧芽、茎尖分生组织、根尖分生组织、易碎胚性愈伤组织、胚性愈伤组织(OES)和贮藏根中均有表达,但呈不同的表达模式,其中,Manes.14G042600和Manes.S089900在储藏根中高表达,Manes.06G128700和Manes.09G172500在须根和根尖分生组织中高表达。在木薯品种KU50和新选048的叶片中,Manes.14G042600基因在干旱胁迫下呈上调表达,推测NOX基因在特定组织及响应非生物胁迫过程中扮演重要角色。【结论】木薯NOX基因家族成员具有保守基因结构,其编码蛋白具有保守的功能域,尤其是C端氨基酸序列;NOX基因表达具有组织特异性,部分成员的表达受非生物胁迫的影响。FRO蛋白和NOX蛋白具有较明显的共进化关系。
关键词: 木薯;还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶(NOX);基因家族成员;生物信息学;干旱胁迫
中图分类号: S533.035.3 文献标志码: A 文章编号:2095-1191(2019)10-2178-10
Bioinformatics of cassava NOX gene family and
its expression analysis
HU Guang1,2, LIANG Da-cheng1,2*
(1Engineering Research Center of Ecology and Agricultural Use of Wetland, Ministry of Education/Hubei Key Laboratory of Waterlogging Disaster and Wetland Agriculture, Jingzhou, Hubei 434025, China;
2Hubei Collaborative Innovation Center for Grain Industry,Jingzhou, Hubei 434025, China)
Abstract:【Objective】Gene family members of reduced nicotinamide adenine dinucleotide phosphate oxidase(NOX) in cassava were identified through bioinformatic mining of publicly available data,and gene expression profiles in di-fferent tissues and under various abiotic stresses were also analyzed,which laid theoretical references for further studies on the regulation mechanism of NOX genes on cassava tuberization and improvement of stress resistance of cassava. 【Method】Cassava genome sequences were downloaded from GJI database and four NOX domain-related HMM files were downloaded from the pfam protein database,then the HMMER program was performed to characterize the NOX family members. The physical and chemical properties,amino acid sequence and structural characteristics of the family protein were analyzed by bioinformatics software. Based on transcriptome sequencing(RNA-Seq) data at GEO database,the expression profiles of cassava NOX gene family members was further analyzed in various tissues and under drought stress. 【Result】A total of 15 members of the NOX gene family were identified from the cassava genome,including 9 NOX genes,6 FRO genes (or the ancestral NOX genes). The exons of NOX(11-14) gene greatly outnumbered that of the FRO family(6-9). The intron sequence of FRO gene was shorter than that of NOX gene and the first exon of NOX gene was relatively conserved. Fifteen members of the NOX gene family were distributed on 9 different chromosomes and 1 scaffold of cassava,all of them were anchored near the endpoints of chromosomes. Except for chromosome 6(4 genes) and chromosome 14(2 genes),there was only one NOX gene in each chromosome. The molecular weight and amino acid number of NOX protein in cassava were lower than FRO protein, but the theoretical isoelectric point(pI) difference was not obvious. FRO proteins harbored 6 to 9 conserved transmembrane domains,whereas all the NOX proteins had only 4 transmembrane domains. There are 10 conserved domains of NOX family proteins in cassava, with Motif1 and Motif8 in all NOX and FRO proteins, Motif6 only in NOX proteins, and Motif3 only in FRO proteins. Three-dimension homologous modeling further revealed that all NOX proteins had typical conserved domains and similar protein structures. The dehydrogenase domain folded obviously into the catalytic domain fissure structure and the C-terminal sequence appeared as an extremely conserved motif. The expression profile of the NOX genes using RNA-Seq data displayed different expression patterns across different tissues,including leaves,mid vein,petiole,stem,lateral bud, shoot apical meristem(SAM), root apical meristem(RAM), friable embryogenic callus(FEC), organized embryogenic structures(OES) and storage roots. Some of them were highly enriched in storage root,for example Manes.14G042600 and Manes.S089900,however,Manes.06G128700 and Manes.09G172500 were highly expressed in fibrous root and RAM. Notably,in the leaves of varieties cv. KU50 and Xinxuan 048,Manes.14G042600 was upregulated under drought stress,implying a potential role of NOX gene in respon-ding to abiotic stress. 【Conclusion】Cassava NOX gene family members contain conserved gene structure and their encoded proteins also contain conserved functional domains,particularly in their C-terminal regions,suggesting the underlying co-evolutionary relationship between FRO protein and NOX protein. The NOX genes are tissue specific,and some of them are responsive to abiotic stress.
Key words: cassava; reduced nicotinamide adenine dinucleotide phosphate oxidase(NOX); gene family members;bioinformatics; drought stress
0 引言
【研究意义】木薯(Manihot esculenta Crantz)是一种重要的块根粮食作物,主要种植于热带和亚热带地区,其块茎中淀粉含量较高(70%~90%),约是水稻光合速率的2倍(Ihemere et al.,2006;Santa Brígida et al.,2014;Oyelakin et al.,2015)。研究发现,块茎的发育和储藏根采后生理退化与活性氧(Reactive oxygen species,ROS)的产生密切相关,活性氧能诱导超氧化物离子引起非生物胁迫,在响应多种与植物氧化还原反应相关的生物学过程中发挥重要作用(Xu et al.,2013;Liu et al.,2017);而还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶(NOX)是生成活性氧的主要催化酶(Bedard and Krause,2007;Lambeth and Neish,2014)。因此,利用生物信息学方法研究木薯NOX基因家族,揭示其成员数量、理化特性、染色体位置分布、基因结构、进化关系、蛋白三维结构和时空表达特征等,对研究木薯块茎的发育生物学特性具有重要意义。【前人研究进展】NOX普遍存在于植物、动物和真菌中(Bedard and Krause,2007)。在动物细胞中,NOX是一种面向细胞外空间的酶复合物,包含膜结合异质二聚体即黄细胞色素b558(由gp91phox和p22phox组成)及吞噬细胞的4种胞质成分即p47phox、p67phox、p40phox和小分子蛋白GTPase Rac(Vignais,2002;Quinn and Gauss,2004)。当细胞受到刺激后,胞质成分与黄酮细胞色素b558相互作用,激活NOX,催化发生化学反应,最终产生过氧化氢(H2O2)和羟基自由基(OH)等活性氧(Vignais,2002;Quinn and Gauss,2004;Mizrahi et al.,2006)。在植物细胞中,NOX被称为呼吸爆发氧化酶同源物(Rbohs),也是哺乳动物吞噬细胞gp91phox的同源物,调控活性氧的生成(Sagi and Fluhr,2006)。活性氧在植物生长调控和次生代谢反应中发挥重要作用,不仅破坏由氧化代谢产生有害因子的细胞并导致其程序性细胞死亡,还作为植物的信号分子响应非生物胁迫(Mittler et al.,2011;Dietz et al.,2016)。近年来,已有大量研究表明,NOX基因参与植物的发育调控和逆境胁迫反应。在水稻中,已有9个NOX基因家族成员被分离鉴定出来,其中,OsNOX1、OsNOX2和OsNOX3基因在干旱和盐胁迫下过表达能明显提高水稻的抗逆性和耐受性(Nagano et al.,2016);OsNOX9基因高效表达能促进根的形成(Yamauchi et al.,2017)。在拟南芥中,NOX基因家族成员AtRbohD在低氧胁迫下通过H2O2介导的乙烯信号释放途径而抑制根系伸长(Kaya et al.,2014),在叶片中,AtRbohD基因通过响应脱落酸激素的信号传导而控制气孔开合(Chaouch et al.,2012)。在小麦中,NOX基因家族成员在不同组织中均有特异表达,其中,TaNOX3和TaNOX13基因在小麦叶片中高效表达,TaNOX11基因主要在茎中表达,TaNOX12基因则主要在幼穗中表达,TaNOX8基因在冷害和热害胁迫下均呈下调表达(李日和陈坤明,2015;Hu et al.,2018),说明这些基因在调控小麦的生长发育和抗逆反应方面发挥重要作用。在番茄中,SlRboh1基因高表达促使活性氧积累,以适应更高的二氧化碳浓度和油菜素类固醇含量(Xia et al.,2014)。在草莓中,NOX基因过表达可明显提高植株的冷害耐受性,抑制NOX基因表达会减少活性氧生成量导致细胞程序性死亡,耐受性降低(Zhang et al.,2018)。【本研究切入点】迄今,有关NOX基因家族的研究主要集中于温带禾本科植物或模式植物等,而鲜见针对木薯NOX基因家族的生物学信息及时空表达特征的研究报道,对不同逆境条件下该基因家族的分子调控机制尚不清楚。【拟解决的关键问题】从木薯基因组中鉴定出NOX基因家族成员,分析其基因结构、系统发育进化关系、染色体位置分布、编码蛋白的保守结构域和三维结构及不同组织和非生物胁迫下的表达情况,为深入研究该家族基因对木薯块根发育的调控机理及提高木薯抗逆性提供理论参考。
1 材料与方法
1. 1 木薯NOX基因家族成员检索及鉴定
从JGI数据库(https://genome.jgi.doe.gov/)下载木薯的基因组序列,包括编码区(CDS)序列和基因组GFF3注释文件。利用pfam数据库下载NOX蛋白结构域相关的4个HMM文件,即NADPH_Ox、Ferric_reduct、NAD_Binding6和FAD_Binding8,并使用HMMER程序筛选NOX基因家族成员,E阈值设为10-E5,并在CDD数据库进行验证(Eddy,2011;Marchler-Bauer et al.,2017)。
1. 2 木薯NOX基因家族成員基因结构分析及染色体定位
将NOX基因cDNA序列与木薯基因组数据库(http://www.phyzome.net/cassava)中相应的基因组DNA序列进行比对,分析NOX基因中内含子和外显子的结构特点,并利用GSDS对基因结构进行可视化(Guo et al.,2007)。从木薯基因组数据中获得NOX基因的染色体位置和每条染色体的总长度,利用MapGene2Chrom(http://mg2c.iask.in/mg2c_v2.0/)在线工具绘制NOX基因的染色体位置分布图。
1. 3 蛋白理化性质及保守结构域预测
利用ExPASy预测NOX基因家族成员编码蛋白的理化性质(Gasteiger et al.,2003);使用HMMER在线预测蛋白的跨膜结构域;利用MEME在线预测蛋白的保守基序,基序最大数目设置为10,基序长度设为6~50个氨基酸(Bailey et al.,2009),并将预测的保守基序和蛋白结构域进行对应分析。
1. 4 蛋白三维结构预测
利用SWISS-MODEL预测木薯NOX蛋白的三维结构。同源建模模板为NOX5蛋白(Protein Databank ID 5o0x.1.A),并利用PyMOL显示NOX蛋白脱氢酶结构域的保守末端。
1. 5 系统发育进化树构建
利用ClusterW进行多重序列比对,采用MEGA 7.0以最大似然法(Maximum-Likelihood)构建系统发育进化树,并利用自举重采样法,设置1000次自举重复对分支的可靠性进行评估(Kumar et al.,2009)。
1. 6 木薯转录组测序(RNA-Seq)数据获取及表达特性分析
从GEO数据库下载11个木薯组织的RNA-Seq数据(GSE82279)及干旱胁迫下叶片组织的RNA-Seq数据(GSE98537)(Wislon et al.,2017)。利用R语言,基于FPKM值绘制基因表达谱,以Log2Fold Change(Log2FC)值绘制差异表达热图。
2 结果与分析
2. 1 木薯NOX基因家族成员鉴定及基因结构分析结果
从木薯基因组中共鉴定获得15个NOX基因家族成员,包括9个NOX基因和6个FRO基因(NOX祖先基因),根据基因外显子位置分布可将其明显划分为两个类群(NOX基因和FRO基因),如图1所示。FRO基因的外显子个数明显少于NOX基因,其中Manes.06G16800基因最少,仅含有6个外显子,其他FRO基因含7~9个,且相对于NOX基因,FRO基因的内含子序列较短。NOX基因的外显子数为11~14个,平均为13个,但Manes.02G016200、Manes.08G057200和Manes.S089900基因的内含子区域较其他基因长,且NOX基因的第一个外显子相对保守,推测是其编码蛋白重要的功能域。
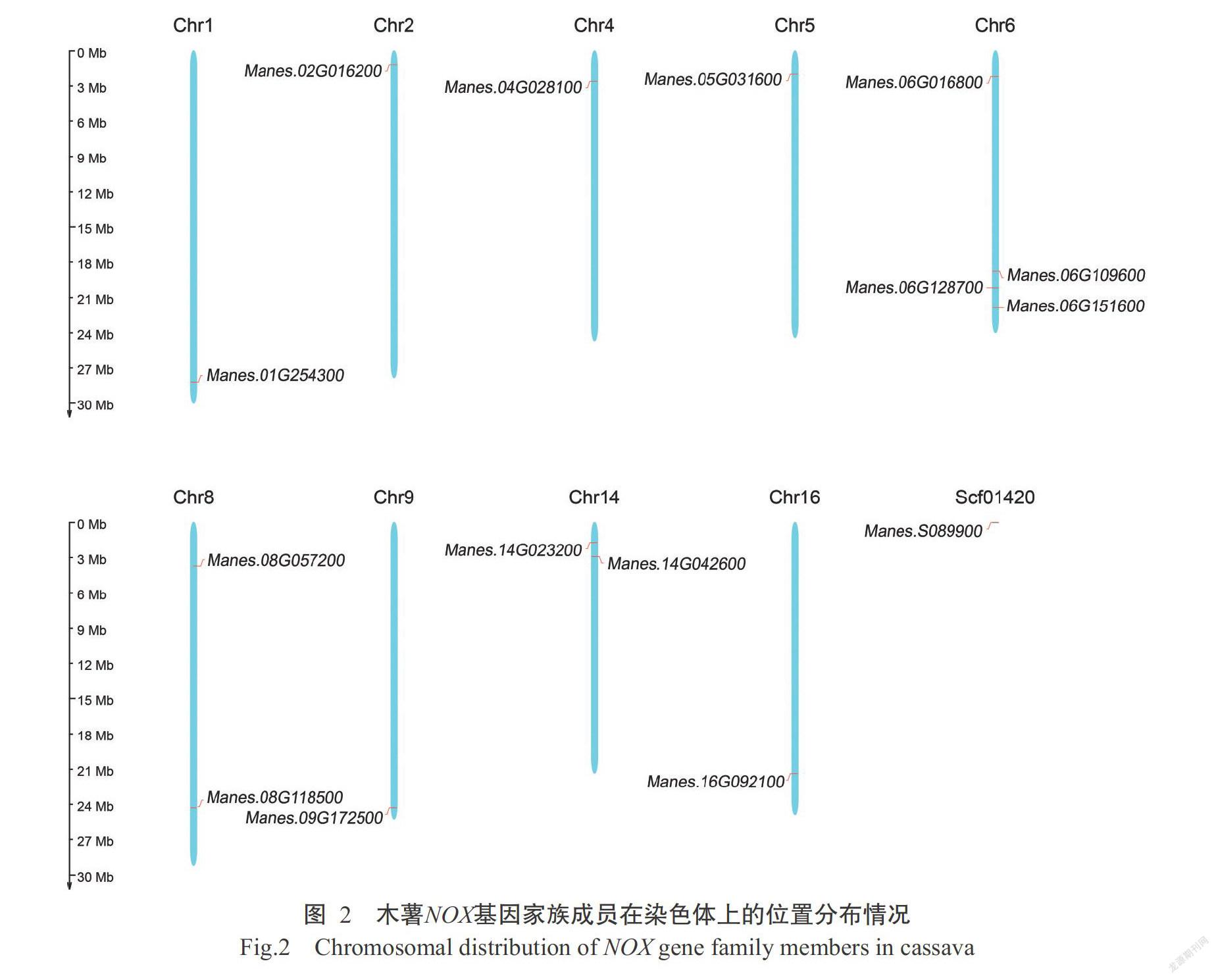
2. 2 木薯NOX基因家族成员的染色体位置分布情况
利用MapGene2Chrom绘制木薯NOX基因家族成员在木薯染色体上的位置,结果如图2所示。这些基因分布在木薯的9条染色体和1个结构支架上,且均被定位在染色体末端,除6号染色体、8号染色体和14号染色体外,其他染色体均只有1个基因。其中,6号染色体上分布的NOX基因和FRO基因最多,且NOX基因Manes.06G128700与2个FRO基因Manes.06G109600和Manes.06G151600的距离较近;14号染色体上分布的NOX基因Manes.14G042600与FRO基因Manes. 14G023200相距也较近(图2),说明上述FRO基因和NOX基因可能存在连锁关系。
2. 3 木薯NOX家族蛋白的理化性质及跨膜结构域预测结果
木薯NOX家族蛋白(NOX蛋白和FRO蛋白,下同)的理化性质如表1所示。NOX蛋白的氨基酸殘基数757~950个,平均为897个;相对分子量87.2~107.9 kD;平均为101.9 kD;理论等电点(pI)8.90~9.74,平均为9.49。FRO蛋白的氨基酸残基数556~722个,平均为649;相对分子量63.3~81.6 kD,平均为73.1;pI 7.72~10.06,平均为9.07。可见,木薯NOX蛋白的分子量和氨基酸数明显高于FRO蛋白。FRO蛋白包含有6~9个保守跨膜结构域,而NOX蛋白均只含4个跨膜螺旋区,且均位于第350~750位氨基酸残基,说明NOX蛋白氨基酸序列极度保守,以保证NOX蛋白的跨膜功能。
2. 4 木薯NOX家族蛋白的结构域分析结果
利用MEME共鉴定出木薯NOX家族蛋白的10个保守结构域(Motif1~Motif10),如图3和图4所示。其中,Motif6属于EF_hand结构域,是NOX蛋白特有的保守序列;Motif5、Motif9和Motif10属于Ferric_reductase结构域;Motif2属于FAD_Binding8结构域;Motif1、Motif4、Motif7和Motif8属于NAD_Binding6结构域。Motif1和Motif8存在于所有的NOX和FRO蛋白中,表明这些保守结构域是连接FRO和NOX蛋白的桥梁,是进化过程中保留下来的重要结构。在FRO蛋白中,Manes.06G151600.3.p和Manes.06G151600.4.p缺失Motif2,可能是Manes. 06G151600基因选择性剪接的结果,且只有Manes. 01G254300.1.p含有Motif9,而Motif9是NOX蛋白特有的保守序列,说明FRO和NOX基因间存在进化关系;Motif3只独立存在于FRO蛋白中,说明其是FRO蛋白独立行使功能的必要位点。在NOX蛋白中,各结构域相对稳定,只有Manes.04G28100.1.p的N端重复1个Motif10。
2. 5 系统发育进化分析结果
由图5可知,不同物种的NOX家族蛋白可分为两大分支(NOXs和FROs),其中,NOXs分支是含NOX蛋白结构域的蛋白,FROs分支则只含有FRO蛋白。NOXs分支包括5个苔藓植物小立碗藓(Physcomitrella patens)NOX蛋白、9个木薯NOX蛋白和10个拟南芥NOX蛋白,说明随着物种的进化,NOX蛋白逐渐增加,其中,Manes.09G172500.1.P与拟南芥AT5G47910.1、Manes.08G118500.1.P与拟南芥AT1G09090.1、Manes.16G092100.1.P与拟南芥AT1G19230.1亲缘关系较近,推测其具有相似的功能;5个苔藓植物小立碗藓NOX蛋白独立聚为一个分支,仅存在于低等苔藓植物中,可能是由于环境和生物的选择压力,植物在从水生到陆地进化过程中NOX基因家族经历了较剧烈的演化过程。FROs分支又可被分为2个小分支(FROs1和FROs2),可能对应2个不同的FRO蛋白亚型。
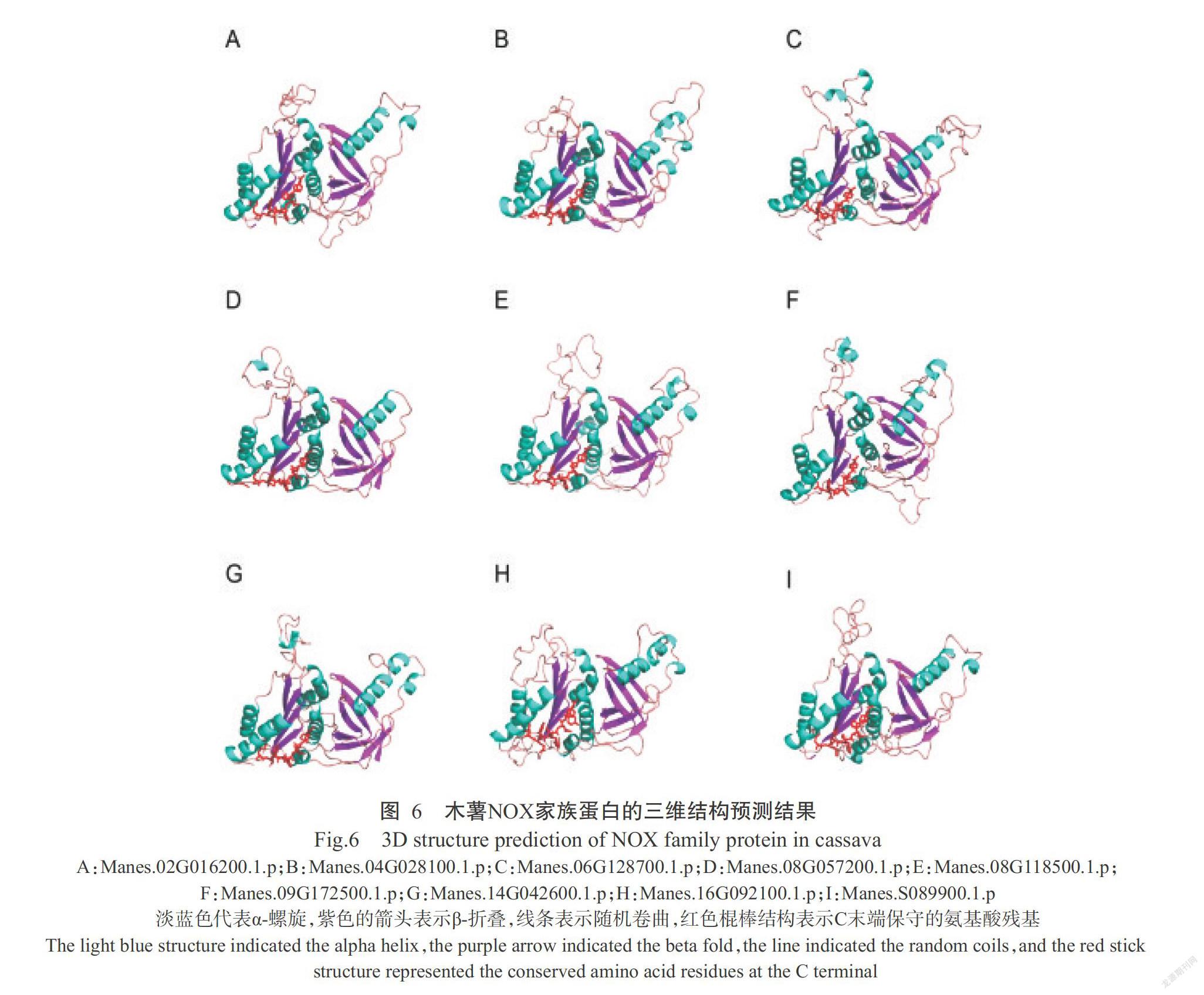
2. 6 木薯NOX蛋白的三维结构预测结果
利用SWISS-MODEL构建木薯NOX蛋白的三维结构模型(图6)。木薯NOX蛋白三维模型与模板的相似度为0.32~0.37,且不同NOX蛋白的三维结构也较相似,说明NOX蛋白的三维结构预测结果较可靠。木薯NOX蛋白的脱氢酶结构域明显折叠成催化域裂缝结构,且C端保守结构可能参与其中,这种结构多以FDFHKENF出现,推测其对FAD和NADPH的结合和反应发挥重要作用(Magnani et al.,2017)。
2. 7 木薯NOX基因家族成员的表达谱分析结果
由图7知,NOX基因家族成员在不同木薯组织中均有差异表达。其中,Manes.06G109600和Manes. 06G151600在叶和中脉中存在特异性表达,Manes. 06G128700和Manes.09G172500在须根和根尖分生组织中均呈高表达,Manes.08G118500和Manes.S089900在脆性胚性愈伤组织中也存在特异性表达。值得注意的是,Manes.14G042600、Manes.S089900、Manes.01G254300和Manes.06G168000在葉、中脉、叶柄和茎中均呈高表达,而在木薯的重要器官储藏根中,仅Manes.14G042600和Manes.S089900高表达,推测二者是活性氧信号通路中的负向调控基因,其高表达有利于延缓木薯储藏根的劣化(Zidenga et al.,2012;Xu et al.,2013)。
2. 8 干旱胁迫条件下木薯叶中NOX基因家族成员差异表达分析结果
由于木薯NOX和FRO基因在叶中有明显表达,选取两个代表性的木薯品种KU50和新选048,探究木薯叶中NOX基因在干旱胁迫下的差异表达,结果如图8所示。在KU50的9个NOX基因中有3个在干旱胁迫后存在明显的差异表达(基于log2FC>1折叠变化),即Manes.06G128700下调表达,Manes. 08G057200和Manes.14G042600则明显上调表达。在新选048的9个NOX基因,仅Manes.02G016200、Manes.09G172500、Manes.14G023200、Manes.14G0-42600和Manes.16G092100在叶中上调表达,表明其在响应干旱胁迫下发挥作用。另外,Manes.14G 042600在KU50和新选048中均呈明显上调表达。
3 讨论
至今,已报道了若干个不同类型的NOX家族蛋白,包括早期的NOX蛋白雏形铁还原酶(FREs)或铁还原氧化酶(FROs)、NOX1~NOX5、DUOX1和DUOX2,其中,NOX5为植物所特有(Bedard et al.,2007)。在植物中,NOX被称为Rbohs,主要结构包括6个保守的跨膜结构域,即C端的FAD和NADPH结合结构域、2个血红素辅基基团和2个N端Ca2+结合的EF手性基序,根据这些结构基序可知Ca2+的调控方式(Geiszt,2006;Sagi and Fluhr,2006)。本研究发现,木薯NOX蛋白C端具有保守的氨基酸残基,与上述前人结果一致,但其氨基酸残基基序FDFHKENF不同于其他物种,推测其为木薯所特有。
前人研究表明,早期藻类植物基因组中只含极少数的FRO基因,不含NOX基因,如团藻和衣藻中分别含有1个和3个FRO基因(Chang et al.,2016);苔藓植物小立碗藓基因组含有5个NOX基因和6个FRO基因,卷柏中含有9个NOX基因和8个FRO基因(Chang et al.,2016);拟南芥基因组中含有10个NOX基因和8个FRO基因;水稻基因组含有9个NOX基因和2个FRO基因,玉米基因组含有14个NOX基因和2个FRO基因,小麦基因组中含有36个NOX基因和10个FRO基因(Hu et al.,2018)。本研究发现木薯基因组含有15个NOX基因家族成员,包括9个NOX基因和6个FRO基因。可见,从数量上来看,随着生物的进化,NOX蛋白从无到有,数量逐渐增多,所占比例也逐渐增大。本研究还发现,木薯NOX蛋白的平均相对分子量和氨基酸数明显高于FRO蛋白,与Hu等(2018)对小麦NOX基因家族成员的研究结果一致,推测在进化过程中FRO基因发生基因扩张和重排,逐渐进化为NOX基因。在基因结构方面,拟南芥、水稻和大麦的多数NOX基因含有10~14个外显子,仅有少数NOX基因如拟南芥的AtRbohD含有8个外显子(Kaya et al.,2014)。本研究中,木薯NOX基因的外显子数为11~14个,平均为13个,与水稻、拟南芥和大麦基本一致,表明NOX基因结构在进化过程中保持相对稳定,其原因可能是木薯与拟南芥、水稻和大麦等物种处在同一进化梯度。NOX家族蛋白均属于跨膜蛋白,大多数物种如水稻和草莓等含6个跨膜结构域(Sagi and Fluhr,2006;Zhang et al.,2018)。但本研究发现木薯NOX蛋白均只含4个跨膜结构域,而FRO蛋白含6~9个跨膜结构域,少于水稻和草莓。另外,FRO作为NOX的祖先蛋白,还保留其自有的结构功能域,如Motif3是木薯FRO蛋白所特有,不存在于NOX蛋白中,由此推测木薯FRO蛋白除进化为NOX蛋白外还具有其他功能,有待进一步挖掘。
在水稻中过表达OsNOX9基因能介导根的形成(Yamauchi et al.,2017),在玉米中ZmNOX13和ZmNOX7基因参与调控根发育(Rajhi et al.,2011)。因此,推测木薯储藏根中高表达的基因Manes.14G04- 2600和Manes.S089900具有类似的功能,参与调控木薯储藏根的发育。在拟南芥叶片中,AtRbohD基因通过响应脱落酸激素的信号传导而控制气孔开合(Chaouch et al.,2012),推测木薯叶片中差异表达的NOX基因Manes.02G016200、Manes.06G128700、Manes.08G057200、Manes.09G172500、Manes.14G0-42600和Manes.16G092100与AtRbohD基因具有类似功能,参与到活性氧的信号通路中。由于植物在生长发育过程中面临各种环境胁迫,包括生物性胁迫和非生物胁迫(Mittler et al.,2011;Dietz et al.,2016),而活性氧作为重要的信号分子参与组织间及细胞间的信息运输,是响应胁迫激发生理变化的重要物质(Liang et al.,2018)。至今尚未清楚木薯NOX基因家族成员的功能及调控机制,为此,本研究采用生物信息学方法分析木薯NOX基因家族成员的特征,发现木薯NOX基因家族成员均具有其特定的表达模式,有利于今后深入研究该家族成员对木薯块根发育的调控功能及提高植株抗非生物胁迫的能力。此外,在后续研究中,将对NOX基因家族成员进行转基因试验,分析其对木薯块根发育的具体表型效应影响。
4 結论
木薯NOX基因家族成员具有保守基因结构,其编码蛋白具有保守的功能域,尤其是C末端氨基酸序列;NOX基因的表达具有组织特异性,且部分成员的表达受非生物胁迫影响。FRO蛋白和NOX蛋白具有较明显的共进化关系。
参考文献:
李日,陈坤明. 2015. 小麦NOX家族基因鉴定及TaNOX12基因的克隆[D]. 杨凌:西北农林科技大学. [Li R,Chen K M. 2015. Identification of NOX gene family and cloning of TaNOX12 gene in wheat[D]. Yangling:Northwest A & F University.]
Bailey T L,Boden M,Buske F A,Frith M,Grant C E,Cle-menti L,Ren J,Li W W,Noble W S. 2009. Meme suite:Tools for motif discovery and searching[J]. Nucleic Acids Research,37(2):202-208.
Bedard K,Krause K H. 2007. The NOX family of ROS-gene-rating NADPH oxidases:Physiology and pathophysiology[J]. Physiological Reviews,87(1):245-313.
Bedard K,Lardy B,Krause K H. 2007. NOX family NADPH oxidases:Not just in mammals[J]. Biochimie,89(9):1107-1112.
Chang Y L,Li W Y,Miao H,Yang S Q,Li R,Wang X,Li W Q,Chen K M. 2016. Comprehensive genomic analysis and expression profiling of the NOX gene families under abiotic stresses and hormones in plants[J]. Genome Bio-logy and Evolution,8(3):791-810.
Chaouch S,Queval G,Noctor G. 2012. AtRbohF is a crucial modulator of defence-associated metabolism and a key actor in the interplay between intracellular oxidative stress and pathogenesis responses in Arabidopsis[J]. The Plant Journal,69(4):613-627.
Dietz K J,Mittler R,Noctor G. 2016. Recent progress in understanding the role of reactive oxygen species in plant cell signaling[J]. Plant Physiology,171(3):1535-1539.
Eddy S R. 2011. Accelerated profile HMM searches[J]. PLoS Computational Biology,7(10):e1002195.
Gasteiger E,Gattiker A,Hoogland C,Ivanyi I,Appel R D,Bairoch A. 2003. Expasy:The proteomics server for in-depth protein knowledge and analysis[J]. Nucleic Acids Research,31(13):3784-3788.
Geiszt M. 2006. NADPH oxidases:New kids on the block[J]. Cardiovascular Research,71(2):289-299.
Guo A Y,Zhu Q H,Chen X,Luo J C. 2007. GSDS:A gene structure display server[J]. Hereditas,29(8):1023-1026.
Hu C H,Wei X Y,Yuan B,Yao L B,Ma T T,Zhang P P,Wang X,Wang P Q,Liu W T,Li W Q,Meng L S,Chen K M. 2018. Genome-wide identification and functional analysis of NADPH oxidase family genes in wheat during development and environmental stress responses[J]. Frontiers in Plant Science,9:906.
Ihemere U,Arias G D,Lawrence S,Sayre R. 2006. Genetic modification of cassava for enhanced starch production[J]. Plant Biotechnology,4(4):453-465.
Kaya H,Nakajima R,Iwano M,Kanaoka M M,Kimura S,Takeda S,Kawarazaki T,Senzaki E,Hamamura Y,Higashiyama T,Takayama S,Abe M,Kuchitsu K. 2014. Ca2+-activated reactive oxygen species production by Arabidopsis RbohH and RbohJ is essential for proper pollen tube tip growth[J]. Plant Cell,26(3):1069-1080.
Kumar S,Stecher G,Tamura K. 2009. Mega7:Molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Molecular. Biology and Evolution,33(7):1870-1874.
Lambeth J D,Neish A S. 2014. Nox enzymes and new thin-king on reactive oxygen:A double-edged sword revisited[J]. Annual Review of Pathology,9:119-145.
Liang D C. 2018. A salutary role of reactive oxygen species in intercellular tunnel-mediated communication[J]. Frontiers in Cell and Development Biology,6(2):1-24.
Liu B L,Zhao S,Tan F,Zhao H,Wang D D,Si H J,Chen Q. 2017. Changes in ROS production and antioxidant capa-city during tuber sprouting in potato[J]. Food Chemistry,237(15):205-213.
Magnani F,Nenci S,Millana Fananas E,Ceccon M,Romero E,Fraaije M W,Mattevi A. 2017. Crystal structures and atomic model of NADPH oxidase[J]. Proceeding of the National Academic of Science,114(26):6764-6769.
Marchler-Bauer A,Bo Y,Han L,He J,Lanczycki C J,Lu S,Chitsaz F,Derbyshire M K,Geer R C,Gonzales N R,Gwadz M,Hurwitz D I,Lu F,Marchler G H,Song J S,Thanki N,Wang Z,Yamashita R A,Zhang D,Zheng C,Geer L Y,Bryant S H. 2017. CDD/SPARCLE:Functional classification of proteins via subfamily domain architectures[J]. Nucleic Acids Research,45(1):200-203.
Mittler R,Vanderauwera S,Suzuki N,Miller G,Tognetti V B,Vandepoele,Klaas V,Gollery M,Shulaev V,Breusegem F V. 2011. ROS signaling:The new wave?[J]. Trends in Plant Science,16(6):300-309.
Mizrahi A,Berdichevsky Y,Ugolev Y,Molshanski-Mor S,Nakash Y,Dahan I,Alloul N,Gorzalczany Y,Sarfstein R,Hirshberg M,Pick E. 2006. Assembly of the phagocyte NADPH oxidase complex chimeric constructs derived from the cytosolic components as tools for exploring structure-function relationships[J]. Journal of Leukocyte Biology,79(5):881-895.
Nagano M,Ishikawa T,Fujiwara M,Fukao Y,Kawano Y,Kawai-Yamada M,Shimamoto K. 2016. Plasma membrane microdomains are essential for Rac1-RbohB/H-mediated immunity in rice[J]. Plant Cell,28(8):1966-1983.
Oyelakin O O,Opabode J T,Raji A A,Ingelbrecht I L. 2015. A cassava vein mosaic virus promoter cassette induces high and stable gene expression in clonally propagated transgenic cassava(Manihot esculenta crantz)[J]. South African Journal of Botany,97(5):184-190.
Quinn M T,Gauss K A. 2004. Structure and regulation of the neutrophil respiratory burst oxidase:Comparison with nonphagocyte oxidases[J]. Journal of Leukocyte Biology,76(4):760-781.
Rajhi I,Yamauchi T,Takahashi H,Nishiuchi S,Shiono K,Watanabe R,Mliki A,Nagamura Y,Tsutsumi N,Nishizawa N K,Nakazono M. 2011. Identification of genes expressed in maize root cortical cells during lysigenous aere-nchyma formation using laser microdissection and microa-rray analyses[J]. New Phytologist,190(2),351-368.
Sagi M,Fluhr R. 2006. Production of reactive oxygen species by plant NADPH oxidases[J]. Plant Physiology,141(2),336-340.
Santa Brígida A B,dos Reis S P,Costa C N,Cardoso C M,Lima A M,de Souza C R. 2014. Molecular cloning and characterization of a cassava translationally controlled tumor protein gene potentially related to salt stress response[J]. Molecular Biology Reports,41(3):1787-1797.
Vignais P V. 2002. The superoxide-generating NADPH oxidase:Structural aspects and activation mechanism[J]. Ce-llular Molecular Life Sciences,59(9):1428-1459.
Wilson M C,Mutka A M,Hummel A W,Berry J,Chauhan R D,Vijayaraghavan A,Taylor N J,Voytas D F,Chitwood D H,Bart R S. 2017. Gene expression atlas for the food security crop cassava[J]. New Phytologist,213(4):1632-1641.
Xia X J,Gao C J,Song L X,Zhou Y H,Shi K,Yu J Q. 2014. Role of H2O2 dynamics in brassinosteroid-induced stomatal closure and opening in Solanum lycopersicum[J]. Plant Cell Environment,37(9):2036-2050.
Xu J,Duan X,Yang J,Beeching J R,Zhang P. 2013. Enhanced reactive oxygen species scavenging by overproduction of superoxide dismutase and catalase delays postharvest physiological deterioration of cassava storage roots[J]. Plant Physiology,161(3):1517-1528.
Yamauchi T,Yoshioka M,Fukazawa A,Mori H,Nishizawa N K,Tsutsumi N,Yoshioka H,Nakazono M. 2017. An NADPH oxidase RBOH functions in rice roots during lysigenous aerenchyma formation under oxygen-deficient conditions[J]. Plant Cell,29(4):775-790.
Zhang Y T,Li Y L,He Y W,Hu W J,Zhang Y,Wang X R,Tang H R. 2018. Identification of NADPH oxidase family members associated with cold stress in strawberry[J]. Fe-deration of European Biochemical Societies Open Bio,8(4):593-605.
Zidenga T,Leyva-Guerrero E,Moon H,Siritunga D,Sayre R. 2012. Extending cassava root shelf life via reduction of reactive oxygen species production[J]. Plant Physiology,159(4):1396-1407.
(責任编辑 陈 燕)

