BmNPV对家蚕抗氧化酶基因表达及其酶活性的影响
唐芬芬 杨伟克 朱峰 邵榆岚 张永红 白兴荣

摘要:【目的】探究喂食家蠶核型多角体病毒(BmNPV)后家蚕血淋巴和中肠组织抗氧化酶[超氧化物歧化酶(SOD)和过氧化氢酶(CAT)]的活性及其基因表达变化规律,明确BmNPV侵染对家蚕抗氧化系统的影响,为解析BmNPV的致病机理提供理论依据。【方法】以五龄家蚕为研究对象,经口喂食BmNPV,分别于添食后6、12、18、24、30、36、42和48 h采集家蚕的血淋巴和中肠组织,采用实时荧光定量PCR检测两种抗氧化酶基因(Bmsod和Bmcat)的表达水平,同时以抗氧化酶活性测试盒测定SOD和CAT的活性变化情况。【结果】BmNPV侵染五龄家蚕能引起典型的血液型脓病,主要表现为蚕体环节肿胀,狂躁爬行,体壁易破,体液呈乳白色等。家蚕血淋巴和中肠组织中Bmsod和Bmcat基因均在感染BmNPV中期开始上调表达,在感染后期呈下调表达趋势,其相对表达量也呈先增加后急剧减少的变化趋势。添食BmNPV后,家蚕血淋巴和中肠组织的SOD活性在感染18和24 h时极显著高于对照组(添食等量灭菌水)家蚕(P<0.01,下同),但从感染30 h起SOD活性开始急剧下降,至感染48 h时降至最低值。家蚕血淋巴和中肠组织的CAT活性在感染早期(6 h)略有下降,从感染12 h起CAT活性开始呈上升趋势,血淋巴CAT活性在感染18~30 h极显著高于对照组,随后急剧下降且显著低于对照组家蚕(P<0.05,下同);中肠组织CAT活性仅在感染18和24 h时显著或极显著高于对照组家蚕,从感染30 h起开始持续下降,至感染48 h时降至最低值,约为对照组家蚕的18%。【结论】BmNPV侵染能影响家蚕机体相关保护酶活性及其基因转录水平,SOD和CAT活性及其基因表达量在感染中期增加,感染后期则急剧降低,提示抗氧化酶SOD和CAT在家蚕的抗病毒过程中发挥重要作用。
关键词: 家蚕;家蚕核型多角体病毒(BmNPV);SOD;CAT;酶活性;基因表达
中图分类号: S884.51 文献标志码: A 文章编号:2095-1191(2019)10-2308-06
Effects of BmNPV on the antioxidant enzyme gene expression and enzyme activity of Bombyx mori
TANG Fen-fen, YANG Wei-ke, ZHU Feng, SHAO Yu-lan,
ZHANG Yong-hong, BAI Xing-rong*
(Institute of Sericulture and Apiculture, Yunnan Academy of Agricultural Sciences, Mengzi, Yunnan 661101, China)
Abstract:【Objective】In order to provide references for further study on the infection and pathogenesis of BmNPV, this study was explored change rules of the hemolymph and mesenteron antioxidant enzyme activities[superoxide dismutase(SOD), catalase(CAT)] and the gene expression in silkworm larvae infected with Bombyx mori nuclear polyhedrovirus(BmNPV), and the effects of BmNPV infection on B. mori antioxidant system were also analyzed. 【Method】The real-time fluorescent quantitative PCR was applied to analyze the expression of two kinds of antioxidant enzyme genes Bmsod and Bmcat, meanwhile the activity of the SOD and CAT were determined in heamolymph and midgut of 5th instar silkworm larvae after feeding BmNPV at 6, 12, 18, 24, 30, 36, 42 and 48 h. 【Result】BmNPV infection of silkworm in the fifth instar could cause typical blood pyogenic disease, mainly manifested as swollen silkworm body parts, manic crawling, body wall easily broken, body fluid milky liquid. The Bmsod and Bmcat genes were up-regulated since the mi-ddle of BmNPV infection, and down-regulated in the end of infection, their relative expression also showed increase-sharp decrease trend. The activities of SOD in hemolymph and midgut of B. mori was extremely higher than the control group (feeding the same amount of sterilized water) at 18 and 24 h after infection with BmNPV(P<0.01, the same below), but it started to decrease sharply at 30 h, and dropped to the lowest value at 48 h. The activities of CAT in hemolymph and midgut of silkworm decreased slightly at the early stage after infection(at 6 h), and increased from 12 h. In hemolymph, the CAT activity was extremely higher than the control group from 18 h to 30 h after infection, but decreased sharply and was significantly lower than the control group(P<0.05, the same below). In midgut, the CAT activity was only significantly or extremely significantly higher than the control group at 18 and 24 h after infection, and continued to decline from 30 h to the lowest value at 48 h, which was about 18% of the control group. 【Conclusion】BmNPV infection can affect the activity of related protective enzymes and its gene transcription level in silkworm.The expression levels of activities of SOD and CAT and Bmsod and Bmcat genes all increase first and then decrease sharply in the midgut and heamolymph of silkworm after infection with BmNPV. It suggests that the antioxidant enzymes SOD and CAT play an important role in the antiviral process of silkworm.
Key words: Bombyx mori; Bombyx mori nuclear polyhedrovirus(BmNPV); SOD; CAT; enzyme activity; gene expression
0 引言
【研究意义】家蚕是一种重要的经济昆虫,同时是鳞翅目昆虫的模式生物,加之遗传背景清晰且饲育简单,已发展成为研究宿主—病原互作机制的理想材料(Geng et al.,2016a,2016b)。超氧化物歧化酶(Superoxide dismutase,SOD)和过氧化氢酶(Catalase,CAT)在维持生物体内自由基代谢平衡的过程中发挥重要作用,在一定程度上能反映生物的抗逆能力(Lesser,2006;方允中和郑荣梁,2008)。因此,研究抗氧化酶活性及其基因表达在家蚕抵抗病原微生物侵染过程中的变化规律,尤其是明确其在家蚕抵抗家蚕核型多角体病毒(Bombyx mori nucleopolyhedrovirus,BmNPV)时的功能和作用,可为揭示BmNPV侵染及其致病机理提供理论依据。【前人研究进展】BmNPV感染主要引发家蚕血液型脓病,传染性强,危害严重,每年给桑蚕产业带来巨大经济损失(邵榆岚等,2017)。据家蚕流行病学调查发现,BmNPV是云南蚕区发生较广且危害严重的主要病原(白兴荣等,2010),生产上多在三龄蚕后感染发病,且一旦发病即迅速蔓延。虽然关于家蚕抵抗病毒的研究已有大量报道,但抗病机制至今尚未完全明确。昆虫遭受外源病原菌侵染时,其机体内正常的代谢平衡被打破,诱发活性氧(ROS)过度积累,进而损伤宿主细胞(Kumar et al.,2003)。抗氧化酶CAT和SOD在消除昆虫体内过量氧自由基方面发挥着重要作用,其中,CAT能催化H2O2分解為H2O和O2,减少羟自由基的产生,防止过量羟自由基损伤机体(Zhao and Shi,2009);SOD能催化超氧阴离子自由基([O2] )发生歧化反应,生成H2O2和O2,H2O2再经CAT作用转化为H2O和O2,进而维持机体的正常生理代谢过程(Wang et al.,2001)。李世广等(2016)研究发现,菜青虫感染金龟子绿僵菌后其体内SOD和CAT活性呈先上升后下降的变化趋势,表明虫体在侵染初期防御能力增强,但后期防御能力降低。张仙红等(2006)研究证实,菜青虫感染玫烟色拟青霉后体内SOD和CAT活性迅速提高,随后急剧下降并显著低于未感染组,同时出现感病症状,说明昆虫SOD和CAT等保护酶系统与病原菌对宿主的侵染存在一定关联,但具体作用机制尚未明确。王树昌等(2017)研究发现,家蚕感染球孢白僵菌后其血淋巴、中肠等组织的总抗氧化活力、SOD和CAT活性均显著降低,Bmsod和Bmcat基因表达水平显著下调,而添加外源SOD和CAT等抗氧化剂能有效延长家蚕存活时间,故推测球孢白僵菌的致病机制主要是通过破坏家蚕抗氧化系统平衡,损伤组织器官,降低宿主的免疫防御功能,最终导致虫体发病死亡。【本研究切入点】家蚕抵抗BmNPV涉及的防御反应极其复杂,BmNPV侵染不仅诱导家蚕中肠相关抗菌肽基因的表达,还能上调血淋巴中酚氧化酶原基因表达,进而提高酚氧化酶活性(唐芬芬等,2015,2016)。目前,有关家蚕对BmNPV的免疫防御及免疫相关因子研究已较深入,但遭受BmNPV侵染时蚕体抗氧化酶活性及其基因表达变化规律的研究鲜见报道。【拟解决的关键问题】以五龄家蚕为研究对象,探究添食BmNPV后家蚕血淋巴和中肠组织抗氧化酶SOD和CAT的活性及其基因表达变化规律,明确BmNPV侵染对家蚕抗氧化系统的影响,为解析BmNPV的致病机理提供理论依据。
1 材料与方法
1. 1 试验材料
家蚕品系菁松×皓月和BmNPV均由云南省农业科学院蚕桑蜜蜂研究所家蚕病害防控研究室提供。Total RNA提取试剂盒(OMEGA公司,货号R6834-02)、反转录试剂盒PrimeScript RT Reagent Kit with gDNA Eraser(TaKaRa公司,货号RR047A)、FastStart SYBR Green Master(Roche公司,货号04673484001)、SOD活性测试盒(货号A001-1)和CAT活性测试盒(货号A007-1)均购自南京建成生物工程研究所。
1. 2 添食处理及样品采集
家蚕按常规方法饲养至五龄起蚕,取体型和体重相近的家蚕随机分为两组(试验组和对照组),试验组每头家蚕经口添食10 µL预先制备好的病毒悬液(5.35×108个/mL),对照组添食等量灭菌水,添食后在同等条件下进行饲育。于添食后6、12、18、24、30、36、42和48 h采集家蚕的血淋巴和中肠组织,每次取样均分成两份,一份用于抽提RNA,另一份用于制备酶液。每次取样设4个重复,每个重复5头家蚕,样品收集后-80.0 ℃保存备用。
1. 3 总RNA提取及反转录
按照Total RNA提取试剂盒操作说明提取各组织RNA,以紫外分光光度计测定RNA样品浓度,取OD260/OD280为1.80~2.00的样品,根据反转录试剂盒说明将RNA反转录合成cDNA。
1. 4 实时荧光定量PCR检测
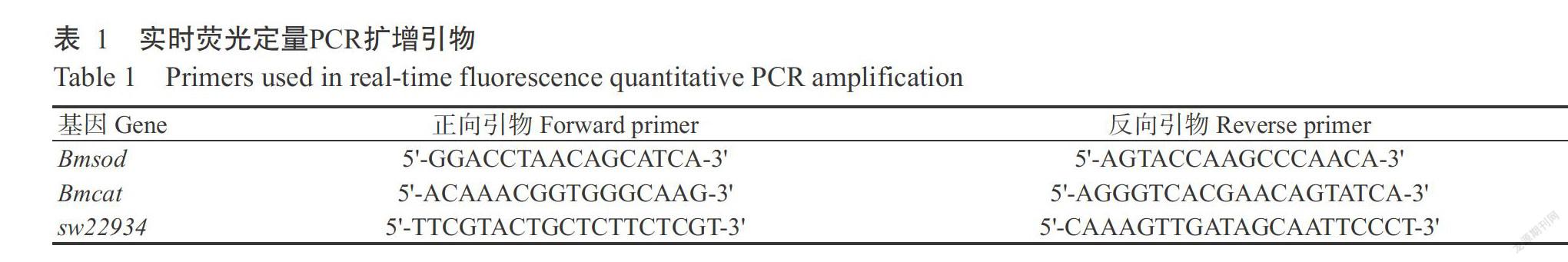
以真核翻译起始因子4A基因(家蚕芯片探针ID:sw22934)为内参基因、酚氧化酶原基因Bmsod(NCBI登录号NM_001043619.1)和Bmcat(NCBI登录号NM_001043447.1)为靶标基因。利用Primer Premier 5.0设计引物(表1)。参照FastStart SYBR Green Master试剂盒操作说明进行实时荧光定量PCR检测,扩增程序:95.0 ℃预变性30 s;95.0 ℃ 5 s,60.0 ℃ 30 s,进行40个循环;65.0 ℃ 5 s(每次加0.5 ℃,直至95.0 ℃)。以CFX-96实时荧光定量PCR检测仪记录试验数据,根据2-△△Ct法计算目的基因相对表达量(Livak and Schmittgen,2001)。
1. 5 抗氧化酶活性测定
酶液制备:取家蚕幼虫各组织样品,分别加入1.2 mL预冷的磷酸盐缓冲液(0.1 mol/L,pH 7.0),在冰上进行研磨,使样品充分破碎,于4 ℃下2500 r/min离心15 min,收集上清液,即为待测酶液。按照SOD活性测试盒和CAT活性测试盒使用说明,分别测定SOD和CAT的活性。
1. 6 统计分析
采用Excel 2016进行数据处理及作图,同时利用SPSS 19.0进行统计分析。
2 结果与分析
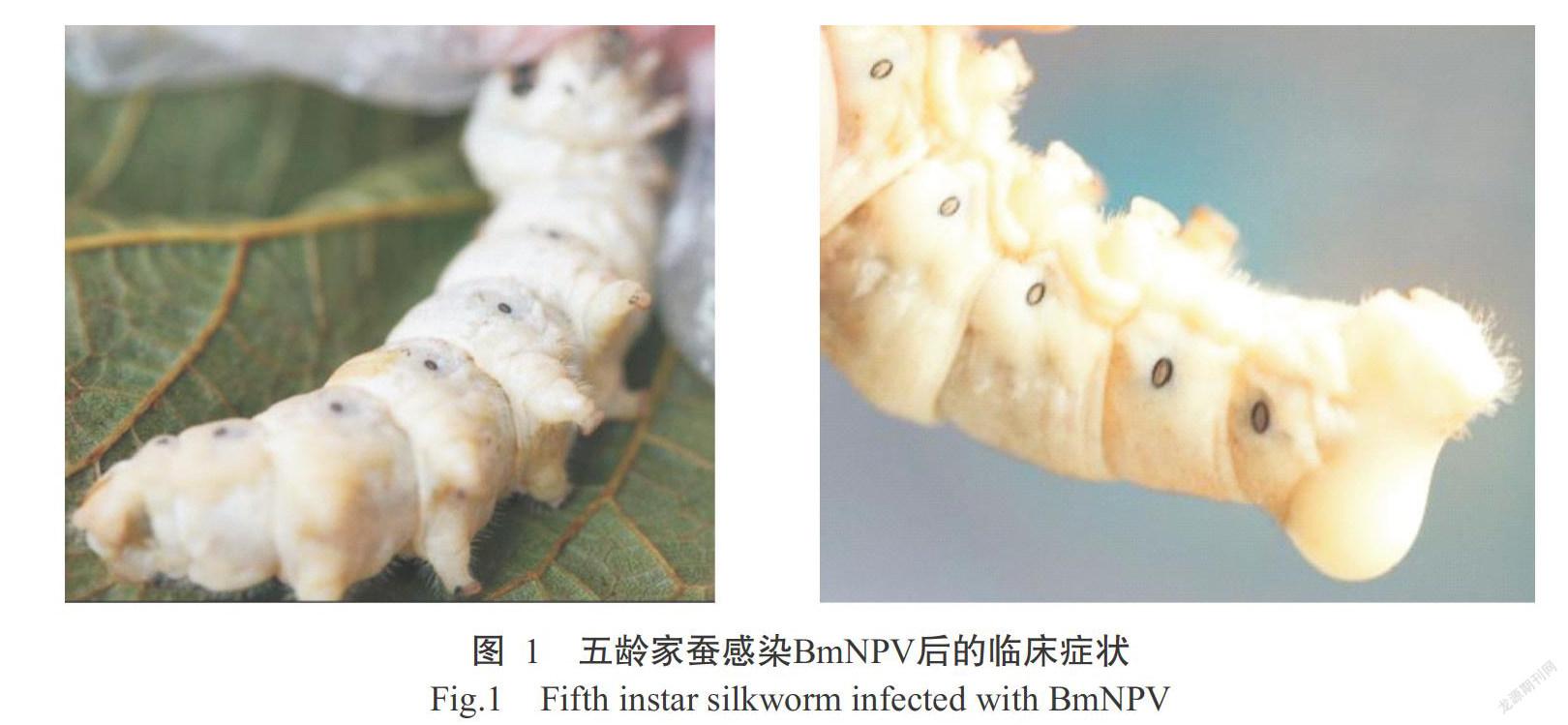
2. 1 家蚕感染BmNPV后的主要临床症状
BmNPV侵染五龄家蚕能引起典型的血液型脓病,从感染后第4 d起开始发病,其临床症状主要表现为蚕体环节肿胀,狂躁爬行,体壁易破,体液呈乳白色等(图1)。
2. 2 家蚕感染BmNPV后Bmsod和Bmcat基因的表达变化
采用实时荧光定量PCR测定添食BmNPV后家蚕血淋巴和中肠组织中Bmsod和Bmcat基因的相对表达量,将对照组家蚕目的基因的相对表达量设定为1.0,当试验组家蚕目的基因的相对表达量大于1.0时,表明该基因上调表达,反之则下调表达。由图2可看出,家蚕血淋巴Bmsod基因在感染BmNPV前期(6~12 h)的相对表达量接近于1.0,至感染18 h时开始上调表达,其相对表达量逐渐增加,于感染30 h时达最高值,随后家蚕血淋巴Bmsod基因相对表达量急剧下降,呈下调表达趋势。在家蚕中肠组织中,Bmsod基因在感染BmNPV后12~24 h呈持续上调表达趋势,且在感染24 h时达最高值,至感染后期(30~48 h)Bmsod基因呈下调表达。
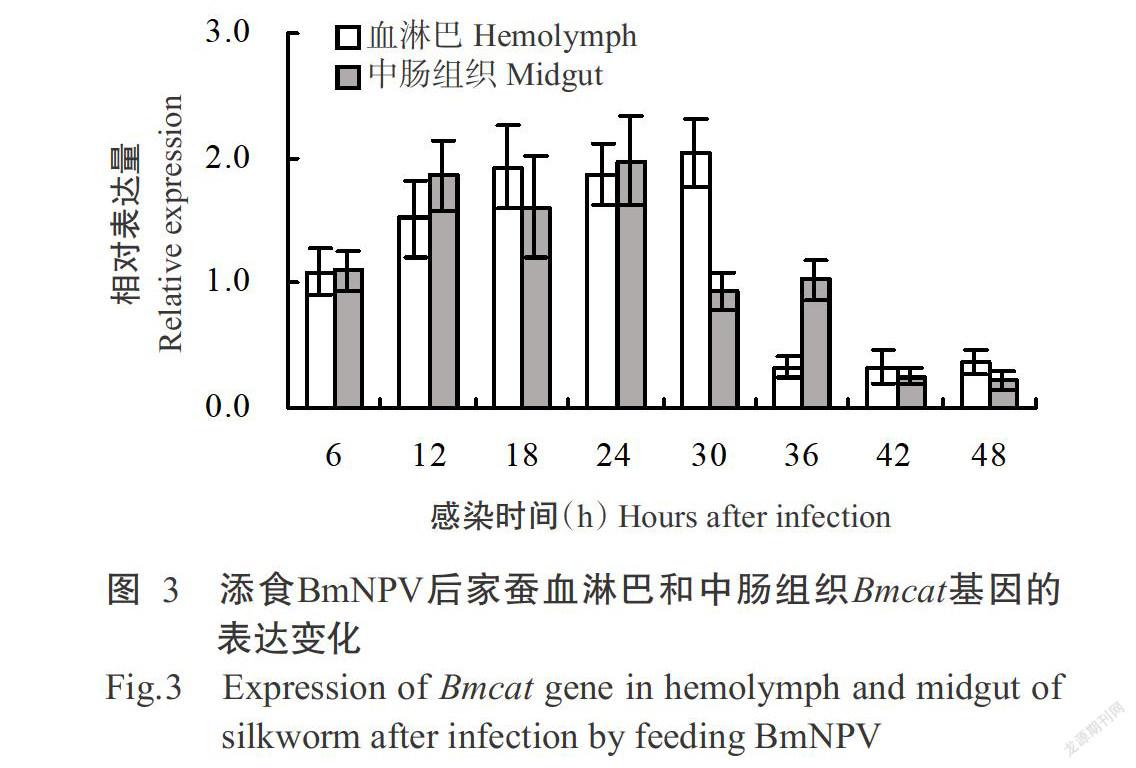
由图3可看出,在BmNPV侵染前6 h,家蚕血淋巴和中肠组织中的Bmcat基因相对表达量均无明显变化,但从感染12 h起开始上调表达,其中,血淋巴Bmcat基因约上调1.5倍,中肠组织Bmcat基因约上调1.8倍。家蚕血淋巴Bmcat基因在感染BmNPV后12~30 h均呈上调表达趋势,在感染36~48 h呈持续下调表达趋势;中肠组织Bmcat基因在感染12~24 h呈上调表达,从感染30 h起开始下调表达,至感染42和48 h其相对表达量降至最低值。
综上所述,家蚕血淋巴和中肠组织中的Bmsod和Bmcat基因均在感染BmNPV中期开始上调表达,至感染后期则下调表达,其相对表达量也呈先增加后急剧减少的变化趋势。
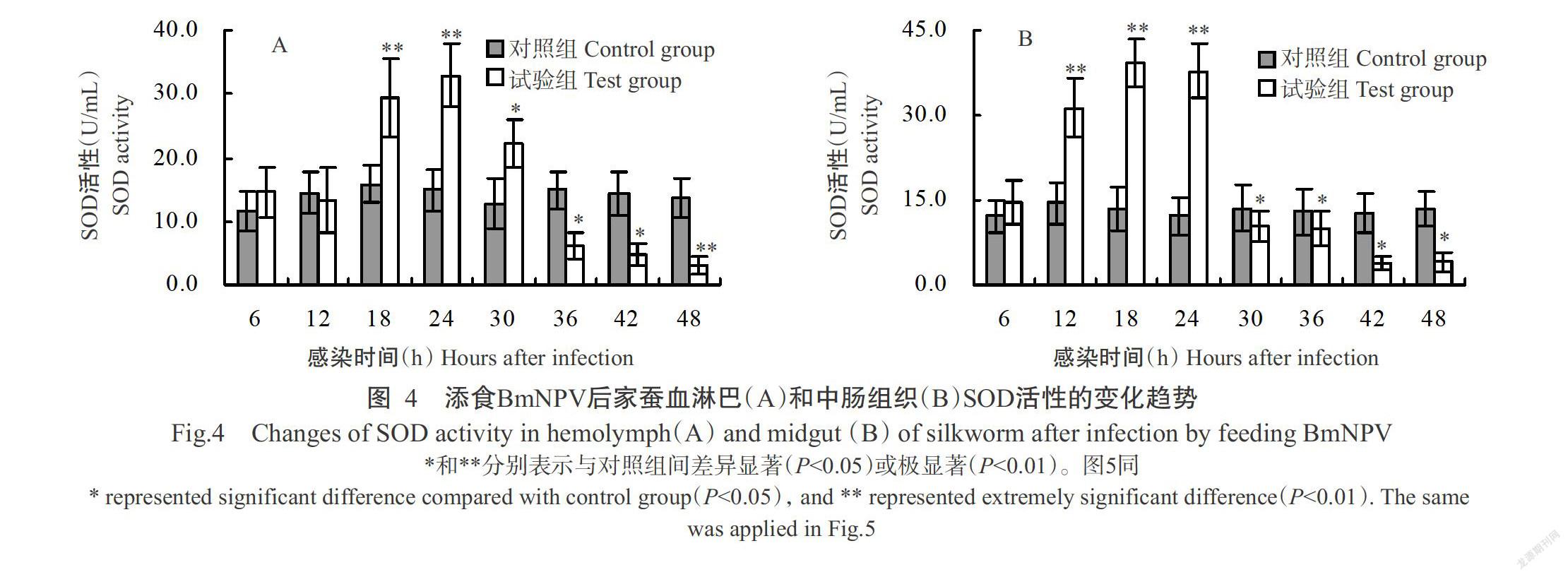
2. 3 家蚕感染BmNPV后血淋巴和中肠组织SOD活性的变化
添食BmNPV后,家蚕血淋巴和中肠组织的SOD活性变化如图4所示。其中,家蚕血淋巴SOD活性在感染初期(6~12 h)与对照组家蚕间无显著差异(P>0.05,下同),感染中期(18~30 h)SOD活性则显著高于对照组家蚕(P<0.05,下同),尤其在感染18和24 h时酶活性分别是对照组家蚕的1.9和2.3倍,其差异达极显著水平(P<0.01,下同),但感染后期(36~48 h)SOD活性显著或极显著低于对照组家蚕(图4-A);家蚕中肠组织SOD活性在感染12、18和24 h分别是对照组家蚕的2.2、2.9和3.1倍,其差异均达极显著水平,从感染30 h起SOD活性开始急剧下降,至感染42和48 h时酶活性最低,约为对照组家蚕的30%(图4-B)。
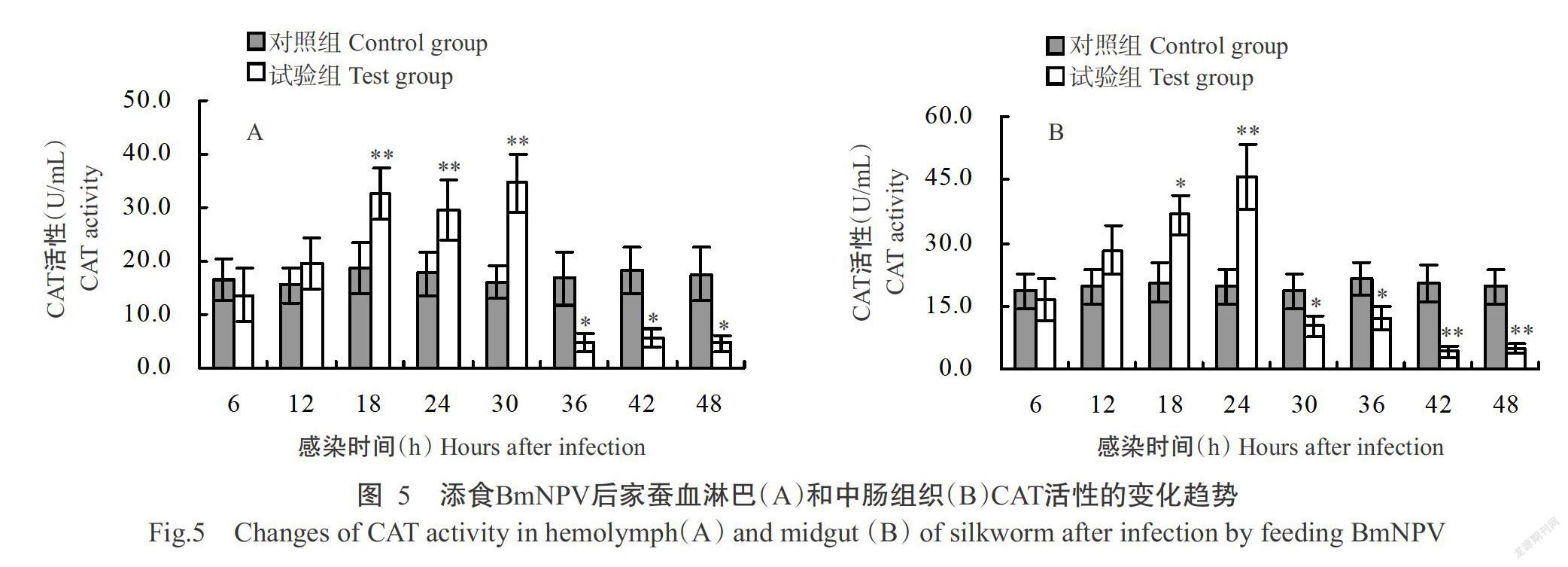
2. 4 家蚕感染BmNPV后血淋巴和中肠组织CAT活性的变化
家蚕感染BmNPV后6 h内,其血淋巴和中肠组织CAT活性略有下降,从感染12 h起CAT活性开始呈上升趋势(图5)。其中,家蚕血淋巴CAT活性在感染中期(18~30 h)持续高于对照组家蚕,且差异达极显著水平,至感染后期(36~48 h)则显著低于对照组家蚕(图5-A);家蚕中肠组织CAT活性仅在感染18和24 h时显著或极显著高于对照组家蚕,从感染30 h起开始持续下降,至感染48 h降至最低值,约为对照组家蚕的18%,其差异达极显著水平(图5-B)。
3 讨论
当昆虫遭受外源病原微生物侵染时,一方面其先天性免疫防御通路被激活,产生抗菌物质或其他免疫活性因子,以保护机体免受伤害(Xia et al.,2017);另一方面,虫体正常生理代谢过程被扰乱,活性氧平衡系统被破坏,自由基浓度升高,而机体保护酶SOD和CAT在消除过量氧自由基方面发挥重要作用(Kumar et al.,2003)。已有研究表明,高温或低温胁迫均会引起家蚕、柞蚕及琥珀蚕的血淋巴SOD和CAT活性在一定时间范围内出现先升高后降低的变化趋势(夏润玺等,2009;袁燕萍等,2010;杨伟克等,2017)。此外,在真菌侵染早期,昆虫体内的SOD和CAT活性呈上升趋势,即自身防御能力增强;而在侵染后期,抗氧化能力急剧减弱并出现明显的感病症状(张仙红等,2006;李世广等,2016;王树昌等,2017)。
本研究结果显示,家蚕中肠组织Bmsod和Bmcat基因的表达及SOD和CAT活性从感染BmNPV后12 h开始增加,而在血淋巴中Bmsod和Bmcat基因表达及SOD和CAT活性的增加相对滞后。中肠是家蚕阻止外源病原微生物及其他毒素等物质侵入的第一道屏障,而血淋巴处于一个相对封闭的循环流动状态,贯穿于整个蚕体,其中含有许多免疫活性物质和抗氧化酶类,以维持机体正常的生理代谢(冯丽春和沈卫德,2015)。经口感染BmNPV,病毒首先攻击家蚕的中肠,破坏其抗氧化防御系统的平衡,进而侵染血淋巴系统,诱发抗氧化反应应答,即家蚕中肠的抗氧化响应略早于血淋巴。
添食BmNPV后,家蚕血淋巴和中肠组织的Bmcat和Bmsod基因表达均在感染中期上调表达、感染后期下调表达,SOD和CAT活性也呈先增加后急剧降低的变化趋势,与BmNPV侵染家蚕的生理进程一致,说明在病毒感染早期,病毒粒子相对较少,不足以打破家蠶抗氧化系统的平衡,抗氧化酶活性仍维持在正常水平;随着感染时间的延长,病毒不断增殖,机体抗氧化系统开始受损,此时抗氧化酶相关基因被诱导表达,SOD和CAT活性迅速增强以消除活性氧自由基;至病毒感染后期,病毒已大量增殖,产生的毒素等突破蚕体免疫防线,其抗氧化系统严重紊乱,Bmcat和Bmsod基因及其酶活性急剧下降,最终呈现发病症状甚至死亡。
4 結论
BmNPV侵染能影响家蚕机体相关保护酶活性及其基因转录水平,SOD和CAT活性及其基因表达量在感染中期增加,感染后期则急剧降低,提示抗氧化酶SOD和CAT在家蚕抗病毒过程中发挥重要作用。
参考文献:
白兴荣,冉瑞法,董占鹏,董家红,黄平. 2010. 云南不同地区BmNPV对家蚕致病力的研究[J]. 西南农业学报,23(6):2098-2101. [Bai X R,Ran R F,Dong Z P,Dong J H,Huang P. 2010. Study on virulence of BmNPV to Bombyx mori in different areas of Yunnan[J]. Southwest China Journal of Agricultural Sciences,23(6):2098-2101.]
方允中,郑荣梁. 2008. 自由基生物学的理论与应用[M]. 北京:科学出版社. [Fang Y Z,Zheng R L. 2008. Theory and application of free radical biology[M]. Beijing:Science Press.]
冯丽春,沈卫德. 2015. 蚕体解剖生理学[M]. 北京:高等教育出版社. [Feng L C,Shen W D. 2015. Anatomy and physio-logy of silkworm[M]. Beijing:Higher Education Press.]
李世广,窦婷婷,付小伶,刘祝琴,何超. 2016. 菜青虫感染金龟子绿僵菌后体内几种保护酶活性的变化[J]. 植物保护,42(3):133-136. [Li S G,Dou T T,Fu X L,Liu Z Q,He C. 2016. Changes of protective enzyme activities in Pieris rapae infection by Metarhizium anisopliae[J]. Plant Protection,42(3):133-136.]
邵榆岚,唐芬芬,张一川,张永红,朱峰,白兴荣. 2017. 云南蚕区家蚕品种资源对家蚕核型多角体病毒的抗性评价分析[J]. 南方农业学报,48(3):517-523. [Shao Y L,Tang F F,Zhang Y C,Zhang Y H,Zhu F,Bai X R. 2017. Resistance of silkworm variety resources from Yunnan sericultural areas to Bombyx mori nucleopolyhedrovirus(BmNPV)[J]. Journal of Southern Agriculture,48(3):517-523.]
唐芬芬,杨伟克,张永红,朱峰,邵榆岚,白兴荣. 2015. 喂食家蚕核型多角体病毒诱导家蚕抗菌肽基因表达[J]. 南方农业学报,46(12):2191-2195. [Tang F F,Yang W K,Zhang Y H,Zhu F,Shao Y L,Bai X R. 2015. Expression of antimicrobial peptide genes in Bombyx mori induced by feeding B. mori nucleopolyhedrovirus[J]. Journal of Southern Agriculture,46(12):2191-2195.]
唐芬芬,杨伟克,朱峰,邵榆岚,张永红,白兴荣. 2016. 家蚕核型多角体病毒对家蚕酚氧化酶活性及其基因表达的影响[J]. 中国农学通报,32(32):25-28. [Tang F F,Yang W K,Zhu F,Shao Y L,Zhang Y H,Bai X R. 2016. BmNPV affecting the activity and gene expression of phenoloxidase in Bombyx mori[J]. Chinese Agricultural Science Bulletin,32(32):25-28.]
王树昌,赫荣帆,陆敏泉,黄华平,王娜玉,郭锡杰,耿涛. 2017. 球孢白僵菌侵染对家蚕抗氧化水平的影响[J]. 热带作物学报,38(11):2136-2144. [Wang S C,He R F,Lu M Q,Huang H P,Wang N Y,Guo X J,Geng T. 2017. Effects on antioxidant levels of silkworm larvae infected with Beauveria bassiana[J]. Chinese Journal of Tropical Crops,38(11):2136-2144.]
夏润玺,曹慧颖,刘限,杨瑞生,刘彦群,秦利,王学英. 2009. 高温条件下柞蚕血淋巴过氧化氢酶活性的变化[J]. 蚕业科学,35(2):415-417. [Xia R X,Cao H Y,Liu X,Yang R S,Liu Y Q,Qin L,Wang X Y. 2009. Change of catalase activity in haemolymph of Antheraea pernyi under high temperature[J]. Science of Sericulture,35(2):415-417.]
杨伟克,唐芬芬,刘增虎,董占鹏,钟键. 2017. 高温和低温条件下琥珀蚕血淋巴SOD及CAT活性的变化[J]. 江苏农业科学,45(1):153-155. [Yang W K,Tang F F,Liu Z H,Dong Z P,Zhong J. 2017. Changes of the CAT and SOD activities in the haemolymph of Antheraea assamensis under low and high temperature[J]. Jiangsu Agricultural Sciences,45(1):153-155.]
袁燕萍,赵林川,魏广卫,王丽,张彩霞,鲍忠赞,司马杨虎. 2010. 家蚕品种7532和大造在高温冲击下中肠抗氧化酶活性的变化[J]. 蚕业科学,36(4):692-696. [Yuan Y P,Zhao L C,Wei G W,Wang L,Zhang C X,Bao Z Z,Sima Y H. 2010. Activity variations of antioxidant enzymes in midguts of Bombyx mori strians 7532 and Dazao under high temperature shock[J]. Science of Sericulture,36(4):692-696.]
張仙红,王宏民,李文英,贺运春,郝赤. 2006. 菜青虫感染玫烟色拟青霉后血淋巴蛋白质含量及几种保护酶活力的变化[J]. 昆虫学报,49(2):230-234. [Zhang X H,Wang H M,Li W Y,He Y C,Hao C. 2006. Changes in the protein content in haemolymph and activities of protective enzymes of Pieris rapae infented by Paecilomyces fumo-soroseus(Deuteromycotina:Hyphomycetes)[J]. Acta Entomologica Sinica,49(2):230-234.]
Geng T,Huang Y X,Hou C X,Qin G X,Lü D D,Guo X J. 2016a. Inductive expression patterns of genes related to Toll signaling pathway in silkworm(Bombyx mori) upon Beauveria bassiana infection[J]. Journal of Asia-Pacific Entomology,19(3):861-868.
Geng T,Lv D D,Huang Y X,Hou C X,Qin G X,Guo X J. 2016b. JAK/STAT signaling pathway-mediated immune response in silkworm(Bombyx mori) challenged by Beauveria bassiana[J]. Gene,595(1):69-76.
Kumar S,Christophides G K,Cantera R,Charles B,Han Y S,Meister S,Dimopoulos G,Kafatos F C,Barillas-Mury C. 2003. The role of reactive oxygen species on Plasmodium melanotic encapsulation in Anopheles gambiae[J]. Procee-dings of the National Academy of Sciences of the United States of America,100(24):14139-14144.
Lesser M P. 2006. Oxidative stress in marine environments:Biochemistry and physiological ecology[J]. Annual Re-
view of Physiology,68(1):253-278.
Livak K J,Schmittgen T D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods,25(4):402-408.
Wang Y,Oberley L W,Murhammer D W. 2001. Antioxidant defense systems of two lipidopteran insect cell lines[J]. Free Radical Biology and Medicine,30(11):1254-1262.
Xia X F,You M S,Rao X J,Yu X Q. 2017. Insect C-type lectins in innate immunity[J]. Developmental and Comparative Immunology,83:70-79.
Zhao L C,Shi L G. 2009. Metabolism of hydrogen peroxide in univoltine and polyvoltine strains of silkworm(Bombyx mori)[J]. Comparative Biochemistry and Physiology(Part B),152:339-345.
(责任编辑 兰宗宝)

