新疆某猪场母猪繁殖障碍病病原学检测和毒株鉴定
范士龙,刘丹丹,韦丽婷,巴音查汗,张 伟
(新疆农业大学动物医学学院,新疆乌鲁木齐 830052)
母猪繁殖障碍是影响规模化养猪稳定健康发展的重要因素之一,其特征为妊娠母猪发生流产,产死胎、木乃伊胎、畸形胎和弱仔,有的甚至不育[1]。母猪繁殖障碍病因复杂,有非传染性和传染性两大类。传染性因素主要包括病毒、细菌和寄生虫,有时会出现多种病原的混合感染,因而增加了疾病诊断的难度;非传染性因素主要包括先天遗传、机能障碍、营养不良和管理不当等,多为个体发病[2]。为确诊新疆地区某规模化繁育猪场母猪繁殖障碍的病因,本试验应用PCR、RT-PCR、realtime RT-PCR 方法,对猪繁殖与呼吸综合征病毒(PRRSV)、伪狂犬病病毒(PRV)、猪细小病毒(PPV)、弓形虫等4 种能够引起母猪繁殖障碍的常见病原进行检测,为新疆地区猪场繁殖障碍的病因调查提供检测依据。
1 材料
1.1 病料样品
2018 年4 月,新疆某规模化繁育猪场出现怀孕母猪后期流产,以及产仔死胎、木乃伊胎和弱仔等现象,发病母猪主要表现为精神沉郁、食欲减少或废绝、发热和不同程度的呼吸困难,出生仔猪体质较弱,不易成活,并出现后肢劈叉等神经症状。本试验采集新鲜死亡胎儿组织样品以及母猪流产排泄物棉拭子进行病原检测。
1.2 主要试剂
Prime Script 1 step Enzyme Mix、2×1 step Butter、RNase-free ddH2O、DL 2 000 bp Marker、AxyPerp 体液病毒DNA/RNA 小量试剂盒:购自TaKaRa 公司;PRRSV(北美株)通用实时荧光定量RT-PCR 诊断试剂盒、PRV 实时荧光PCR 检测试剂盒、弓形虫PCR 检测试剂盒:购自北京世纪元亨动物防疫技术有限公司;PPV 试剂检测盒(实时荧光PCR):购自武汉科前生物股份有限公司。
1.3 主要器材
Thermo Micro 21R 离心机、PCR 扩增仪:购自Thermo 公司。其他仪器包括:BIO-RAD CFX96实时荧光定量PCR 仪、电泳仪、组织研磨机等。
1.4 引物
参考孙海峰等[3]设计的PRRSV 特异性鉴别引物:NSP2 R-5' ATGTTGTGCTTCCTGGGGTTG3',NSP2 F-5' CTTGACAGGGAGCTGCTTGA3',由生工生物工程上海股份公司合成。
2 方法
2.1 病料处理及核酸提取
2.1.1 PRRSV 检测病料处理 取0.1 g 组织样品,加入1 mL 生理盐水,使用研磨器充分研磨,12 000 r/min 离心1 min;取上清液200 mL,使用AxyPerp体液病毒DNA/RNA小量试剂盒抽提核酸。
2.1.2 PRV 检测病料处理 取0.15 g 组织样品,加入1 mL 生理盐水,使用研磨器充分研磨,10 000 r/min 离心1 min;取上清液100 mL 加入无菌离心管中,再加入200 μL 消化液和20 μL 蛋白酶K,振荡混匀后,置56 ℃水浴消化1 h。
2.1.3 PPV 检测病料处理 PPV 病料处理同2.1.2。
2.1.4 弓形虫检测病料处理 将拭子置于无菌生理盐水中混匀,转至1.5 mL 灭菌离心管内,8 000 r/min离心2 min;取上清液100 μL 于1.5 mL 无菌离心管中,加入200 μL 消化液和20 μL 蛋白酶K,振荡混匀后,置56 ℃水浴消化1 h。
2.2 病原检测
2.2.1 PRRSV 使用PRRSV(北美株)通用实时荧光定量RT-PCR 诊断试剂盒检测,反应体系为25 μL,荧光信号采集为FAM 通道,预变性42 ℃5 min,95 ℃ 10 s,(95 ℃ 5 s,60 ℃ 30 s)×40循环。判定标准:Ct ≤35 为阳性,35 <Ct ≤37为可疑(需再次检测,若还是可疑,判为阳性),Ct >37 为阴性。
2.2.2 PRV 使用PRV 实时荧光PCR 试剂盒检测,反应体系为20 μL,荧光信号采集为FAM 通道,95 ℃ 52 min,(95 ℃ 5 s、60 ℃ 30 s)×40 个循环。判定标准:Ct ≤30,且有明显指数增长,为阳性;30 <Ct ≤35,为可疑,此时应重新检测荧光定量,如仍为可疑,且有明显指数增长,判为阳性;Ct >35,为阴性。
2.2.3 PPV 采用PPV 试剂检测盒(实时荧光PCR)检测,反应体系为25 μL,荧光信号采集为FAM 通道,UNG 处理50 ℃ 2 min,预变性95 ℃3 min,(95 ℃ 5 s、55 ℃ 1 min)×40 个循环。判定标准:Ct ≥36,且有明显指数增长,为阳性;36 <Ct ≤39,为可疑,此时样品应重新检测,如仍为可疑,判为阳性;Ct >39 或无Ct 值,为阴性。
2.2.4 弓形虫 使用弓形虫PCR 检测试剂盒,反应体系为20 μL,在PCR 扩增仪上进行以下程序:94 ℃预变性30 s,(94 ℃ 30 s、55 ℃ 30 s、72 ℃30 s)×35 个循环。阳性对照若出现319 bp 扩增带,阴性对照无带出现时,试验结果成立。PCR 产物经1.2%琼脂糖凝胶电泳检测。
2.2.5 毒株鉴定 采用AxyPerp 体液病毒DNA/RNA 小量试剂盒提取核酸:2×1step Butter 12.5 μL,RNase-free ddH2O 7.5 μL,NSP2 F/R各1 μL,核酸模板2 μL。使用PCR 扩增仪扩增,反应体系25 μL,94 ℃预变性5 min,(94 ℃ 50 s、50 ℃ 30 s、72 ℃ 40 s)×35 个循环,72 ℃延伸10 min,PCR 产物经1.2%琼脂糖凝胶电泳鉴别。
3 结果
3.1 PRRSV 通用荧光定量PCR 检测
检测样品两组Ct 值拷贝量分别为22.71、22.82,Ct <35,判定为阳性(图1)。
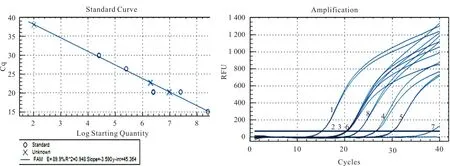
○. 标准品;×. 样品;1~5. 标准品;6. 阳性对照;7. 阴性对照;8. 检测样品。图1 PRRSV 荧光定量检测结果
3.2 PRV、PPV 荧光定量检测
PRV 样品检测Ct >35,判定为阴性(图2);PPV 样品检测无Ct 值,判定为阴性(图3)。

1. 阳性对照;2. 阴性对照;3. 检测样品。图2 PRV 荧光定量检查结果
3.3 弓形虫PCR 检测
根据PCR 产物电泳结果,样品未出现目的条带,结果判定为阴性(图4)

1. 阳性对照;2. 阴性对照;3. 检测样品。图3 PPV 荧光定量检测结果
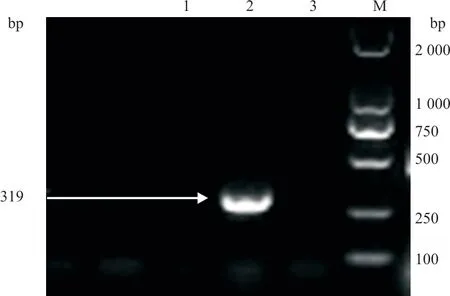
M. DL 2 000 bp DNA Maker;1. 阴性对照;2. 阳性对照;3. 检测样品。图4 弓形虫PCR 检测结果
3.4 毒株鉴定
对阳性样品PCR 扩增产物进行琼脂糖凝胶电泳,根据电泳结果,发现检测样品出现条带且较亮,大小为608 bp(图5),鉴定为PRRSV类NADC30株。

M. DL 2 000 bp DNA Maker;1. 阳性对照;2. 阴性对照;3. 检测样品。图5 PRRSV 毒株鉴定结果
4 讨论
由PRRSV 引起的猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)俗称蓝耳病,以母猪繁殖障碍和仔猪肺炎为主要特征。在我国大部分地区都有该病毒的流行,为猪场的常在性疾病。PRRSV 具有高变异性和免疫抑制性,给养猪业带来了巨大困扰[4]。该病毒分为两个基因型,即以LV 为代表的欧洲型和以VR2332 为代表的美洲型,在我国流行的主要为美洲型,而NADC30 是由美洲型变异而来的[5-6]。NADC30 是2008 年由美国国家动物疾病研究中心(NADC)研究人员首次分离并命名[7]。2014 年,周峰等[8]根据部分NSP2 基因和GP5 基因,首次报道了国内出现与NADC30 高度同源的PRRSV。目前已有的研究显示,NADC30 毒株和PRRSV高致病性毒株、经典毒株以及各种弱毒疫苗毒株均可以发生基因重组[9]。因此,自2014 年以来,PRRSV 类NADC30 毒株临床检出率呈现暴发式增长,大量研究报道证明,该类毒株在我国大部分省市已广泛流行,开始成为主要的PRRSV 流行毒株[10]。
由于本次试验的样品只对发病猪进行了采样,没有全群采样,况且仅对PRRSV、PRV、PPV 和弓形虫等4 种能够引起母猪繁殖障碍的常见病原进行检测,因此既不能排除该场还有其他母猪繁殖障碍疾病病原的存在,也不能排除该场临床健康猪群中存在PRV、PPV 和弓形虫等病原的可能。如吕美芹等[11]在2010—2017 年对全国大部分省市规模化猪场,通过血清学抗体检测进行连续跟踪分析,发现PRV 流行自2011 来呈上升趋势。李志飞等[12]对甘肃省凉山区规模场进行了PPV 流行病学调查,发现该地区PPV 引起的母猪繁殖障碍较为普遍。邱美珍等[13]采用间接酶联免疫吸附法(ELISA),对14 个规模化猪场共184 份母猪血清进行猪弓形虫抗体检测,发现母猪群弓形虫总感染率为58.7%,流产母猪弓形虫感染率为90.0%,可见弓形虫感染也是母猪流产的一个重要因素。引起母猪繁殖障碍病的病原有多种,因此今后需要开展系统的流行病学调查,明确引起母猪繁殖障碍的病因,这对于此病的综合防控具有重要意义。
PRRSV 对不同品种以及不同年龄和用途的猪群均可感染,可通过接触以及空气和精液传播,猪感染病毒后2~14 周,均可通过接触将病毒传播给其他易感猪群,直接接触或间接接触均可感染。感染猪的流动也是本病的重要传播方式。持续感染不仅会影响猪生长速度,而且还会不断向环境中排毒,造成健康猪群感染,使病毒很难在猪群中彻底清除。发病猪场为繁育场,以母猪和仔猪发病为主,病原很有可能来源于种公猪;其次,此繁育场为下游多家育肥场提供仔猪,如果来往于猪场间的运输车辆消毒不彻底,病原就极有可能被带入猪场,造成不同毒株交叉感染,增加了基因重组的几率;再次,此猪场使用时间较久,场内许多设施均有不同程度的损坏,例如消毒、通风、排水设施性能下降,导致猪舍内卫生环境不达标,不能及时消除病原,造成直接感染。以上各种因素的共同存在给该病防控造成很大困难。
对于类NADC30 毒株,此前在新疆未有报道。本次检测结果表明,类NADC30 毒株已经蔓延到新疆地区,并开始对本地区生猪养殖业造成危害。随着近几年经济的不断发展,新疆养殖业规模不断扩大,与内地养殖业交流不断加深,开始引进优质品种。在交流与引种过程中,如果生物安全措施不到位,就有可能导致病原被人为带入。
针对PRRSV 防控,我国主要依赖于高强度的疫苗免疫,但防控效果不佳,临床流行毒株的遗传多样性仍在继续加大,毒株遗传进化速度也在进一步加快[14]。因此,采取有效行动来阻止或者降低类NADC-30 毒株的暴发风险显得十分重要:第一,对猪场进行合理选址与规划,批次内全进全出;第二,建立完备的消毒防疫制度,普及生物安全重要性认识,定期检查,对从疫区内归来人员严格隔离;第三,根据临床症状和检测数据,及时淘汰敏感母猪;第四,后备猪进场必须隔离,并建立长期的病原监测程序,定期进行抗体监测。总之,原则上最好引进PRRSV 阴性后备猪,或自繁自养,实现后备猪的自我供应,逐渐淘汰阳性猪,保持猪群的稳定性,实现区域性的PRRSV 净化。
5 结论
检测表明,PRRSV 类NADC30 毒株是导致该繁育场大规模生产母猪繁殖障碍的重要病原,同时也说明该新型毒株已在新疆地区流行,并对当地养猪业形成了威胁,需引起关注,并做好定期监测和引种检疫工作。本研究为新疆地区母猪繁殖障碍病的病因调查提供了依据。

