石斑鱼病毒性神经坏死病的病原分离和鉴定
林 楠, 吴 斌, 李苗苗, 王巧煌, 林国清, 樊海平, 林克冰
(1.福建省水产技术推广总站,福建 福州 350002;2.福建省淡水水产研究所,福建 福州 350002;3.福建省水产研究所,福建 厦门 361000)
本试验采用SSN-1细胞株及其克隆细胞株E-11对从福建省漳州市采集到的疑似病毒性神经坏死病的石斑鱼苗进行病原分离和鉴定,并对分离的病毒株进行了温度、酸碱度敏感性试验,旨在为病毒性神经坏死病的防控及相关研究提供参考.
1 材料与方法
1.1 材料
1.1.1 细胞 SSN-1细胞由深圳海关动植物检验检疫技术中心提供;E-11细胞由福建省水产研究所提供.
1.1.2 试剂 RNA样品保存液、RNA提取试剂盒、反转录试剂盒、PCR预混试剂盒购自TaKaRa公司;L-15培养液、胎牛血清购自HyClone公司;戊二醛电镜固定液购自武汉赛维尔公司;磷钨酸负染色液(3%)购自上海晶都生物公司.
1.1.3 仪器与设备 主要仪器与设备有GBOX-F3凝胶成像仪(英国Syngene公司)、HT7700透射电镜(日本日立公司)、UC7超薄切片机(德国徕卡公司).
1.2 病鱼材料的提取
从福建省漳州市某水产养殖场收集疑似患病毒性神经坏死病的珍珠龙胆石斑鱼苗(体长2~5 cm)100尾,提取眼部、脑部组织各2份:一份低温保存在RNA样品保存液中,待研磨后用于RT-PCR的检测;一份置-20 ℃下保存,待研磨后用于病毒分离.
1.3 细胞培养
SSN-1、E-11细胞分别在含20% 胎牛血清的L-15培养液(27 ℃)中培养,细胞经胰蛋白酶消化传代,培养至汇合度达90%以上时使用.
1.4 病毒分离
1.4.1 病鱼材料的处理 在病鱼材料中加入适量1×PBS,充分研磨后于5 000 r·min-1离心10 min,取上清,按1∶10的比例加入含双抗(1 000 IU·mL-1青霉素、1 000 μg·mL-1链霉素)的L-15培养液,于4 ℃下过夜,经0.45 μm滤器过滤后,用含胎牛血清的L-15培养液作10、102、103、104倍稀释.准备培养至汇合度达90%的SSN-1、E-11细胞,吸出培养液.将以上各稀释度的病毒液、空白对照液(仅培养液)分别加入到细胞孔中,于培养箱(27 ℃)中吸附2 h,补加含胎牛血清的L-15培养液,放入培养箱(27 ℃)中培养,逐日观察、记录细胞的变化.
在家附近的巷口,弟弟碰见了爸爸。于是他一边跷起扎了绷带的脚给爸爸看,一边哭丧着脸诉苦,满以为会收获一点同情与怜爱,不料爸爸并没有安慰他,只是简单交代几句,便自己离开了。
1.4.2 细胞悬液的收集 待细胞出现病变时,冻融一次,收集细胞悬液,于2 000 r·min-1离心3 min,取上清继续接种细胞并观察细胞的病变情况.
1.5 RT-PCR鉴定
1.5.1 引物合成 石斑鱼病毒性神经坏死病病原检测引物参考GB/T 27531—2011[10]的方法合成,扩增的目标基因为:赤点石斑鱼VNNVRNA-2片段完整序列.引物序列为:F—5′-CGT GTC AGT CAT GTG TCG CT-3′;R:—5′-CGA GTC AAC ACG GGT GAA GA-3′,由生工生物工程(上海)股份有限公司合成.
1.5.2 病毒核酸的提取 病鱼材料用适量的1×PBS洗去残留的RNA样品保存液,充分研磨后,于5 000 r·min-1离心10 min,取上清备用.待检病鱼材料上清和上述细胞培养上清样品的病毒RNA参照Viral RNA/DNA Extraction Kit试剂盒说明书的步骤提取.
1.5.3 RT-PCR鉴定 RNA反转录参照PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit试剂盒说明书的方法进行.在PCR管中分别加入2 μL 10 mmol·L-1引物、4 μL模板、25 μL Premix Taq预混试剂、17 μL DEPC水,混匀后稍离心.PCR反应程序为:94 ℃预变性4 min;94 ℃变性1 min,58 ℃退火1 min,72 ℃延伸1 min,35个循环;最后于72 ℃延伸10 min,4 ℃保温.
1.5.4 产物检测 用TAE缓冲液配制含GelRed染料的1.0%琼脂糖凝胶,PCR产物于100 V恒压凝胶电泳,然后置凝胶成像仪下观察、拍照.产物送生工生物工程(上海)股份有限公司测序.
1.5.5 序列比对及系统树的构建 从NCBI公共数据库上查找病毒性神经坏死病4种基因型及诺达病毒科其他种属相关基因的序列(表1).采用BLAST比对样品测得序列和已知病毒株序列,使用MEGA 5.0软件构建系统发育树.
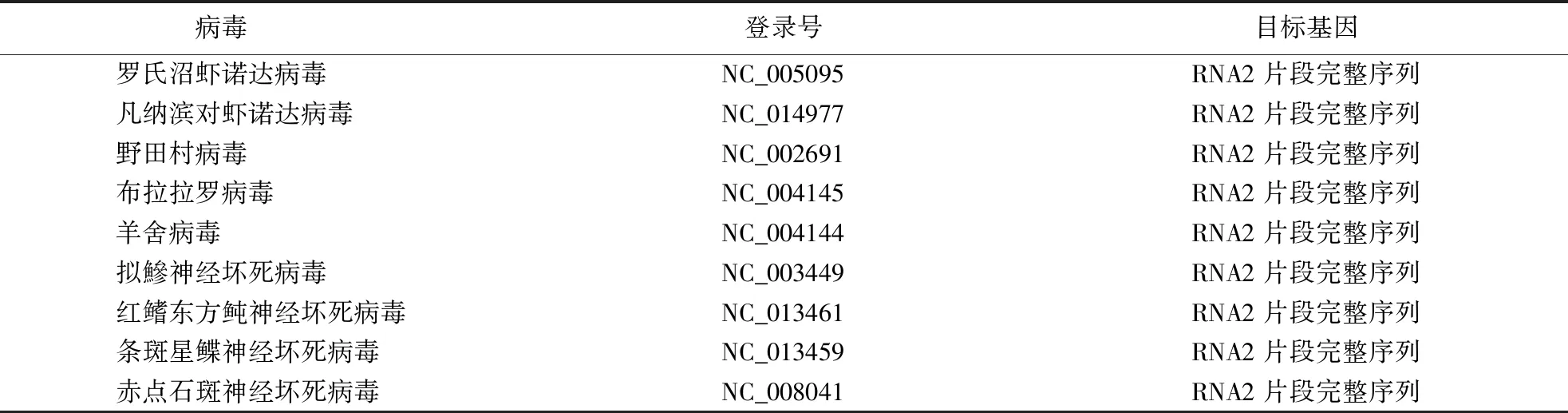
表1 用于构建系统发育树的病毒株及其NCBI登录号Table 1 Virus and accession numbers of gene sequences for molecular phylogenetic analysis
1.6 电镜观察
1.6.1 病毒颗粒负染观察 将感染病毒后的细胞培养上清于12 000 r·min-1离心40 min,取上清置3 ku超滤离心管中,于7 000 r·min-1离心40 min,弃去滤下液,加入等体积的ddH2O稀释浓缩液,于7 000 r·min-1离心40 min,收集浓缩液.
将上述收集液滴在铜网上3 min蘸取样品,用滤纸吸干多余液体,再将2%磷钨酸染色液滴在铜网上染色3 min,用滤纸吸干多余液体,电镜观察.
1.6.2 细胞超薄切片的观察 吹打使感染病毒3 d的E-11细胞脱落,吸出培养液加入电镜固定液于4 ℃固定2 h,于300 r·min-1低速离心细胞至管底,用1%琼脂糖包裹,洗涤.用1%锇酸室温固定2 h后洗涤.用乙醇和丙酮脱水,包埋,超薄切片机切片成60~80 nm的厚度,铀铅双染色,切片置室温下干燥过夜,电镜观察.
1.7 病毒特性分析
1.7.1 病毒滴度的测定 取铺满单层E-11细胞的96孔板,弃去培养液,将病毒上清连续10倍稀释至10-10,各稀释度8个复孔,接种至96孔板中,每孔100 μL,设立空白对照,于27 ℃吸附2 h,补加L-15培养液至每孔200 μL,于27 ℃下培养,每日观察细胞变化并记录细胞病变的情况,7 d后采用Reed-Muench法[11]计算病毒的半数组织细胞感染量(TCID50).
1.7.2 温度敏感性试验 取适量病毒上清,分别置30、40、50、60 ℃下处理30 min,设立空白对照,按照上述病毒滴度测定方法计算其TCID50.
1.7.3 酸碱度敏感性试验 配制0.1 mol·L-1HCl、0.1 mol·L-1NaOH,取适量病毒上清,分为2份,分别用HCl、NaOH调整pH至3、11,置27 ℃下处理30 min,设立空白对照,按照上述病毒滴度测定方法计算其TCID50.
2 结果与分析
2.1 发病鱼的临床症状
发病石斑鱼摄食量下降,浮于水面或趴底侧躺,体色发黑,有的呈螺旋状打转,有的出现发癫症状,部分鱼死亡时嘴大张,表现出不同程度的神经异常.
2.2 病毒的细胞分离
在27 ℃培养条件下,SSN-1、E-11细胞接种病料悬液后第3天开始出现细胞病变,第4天两株细胞的病变形态如图1A、1C所示.图1A、1C显示,细胞肿胀浑圆,呈颗粒状并出现空泡化,最后大批细胞溶解脱落.E-11细胞较SSN-1细胞更早出现病变,且病变更明显.SSN-1、E-11细胞空白对照形态正常(图1B、1D).

A:感染VNNV的SSN-1细胞;B:SSN-1细胞的空白对照;C:感染VNNV的E-11细胞;D:E-11细胞的空白对照.图1 SSN-1、E-11细胞感染VNNV后出现的病变形态Fig.1 Cytopathic effect of SSN-1 cell and infected E-11 cells
2.3 病毒的RT-PCR鉴定
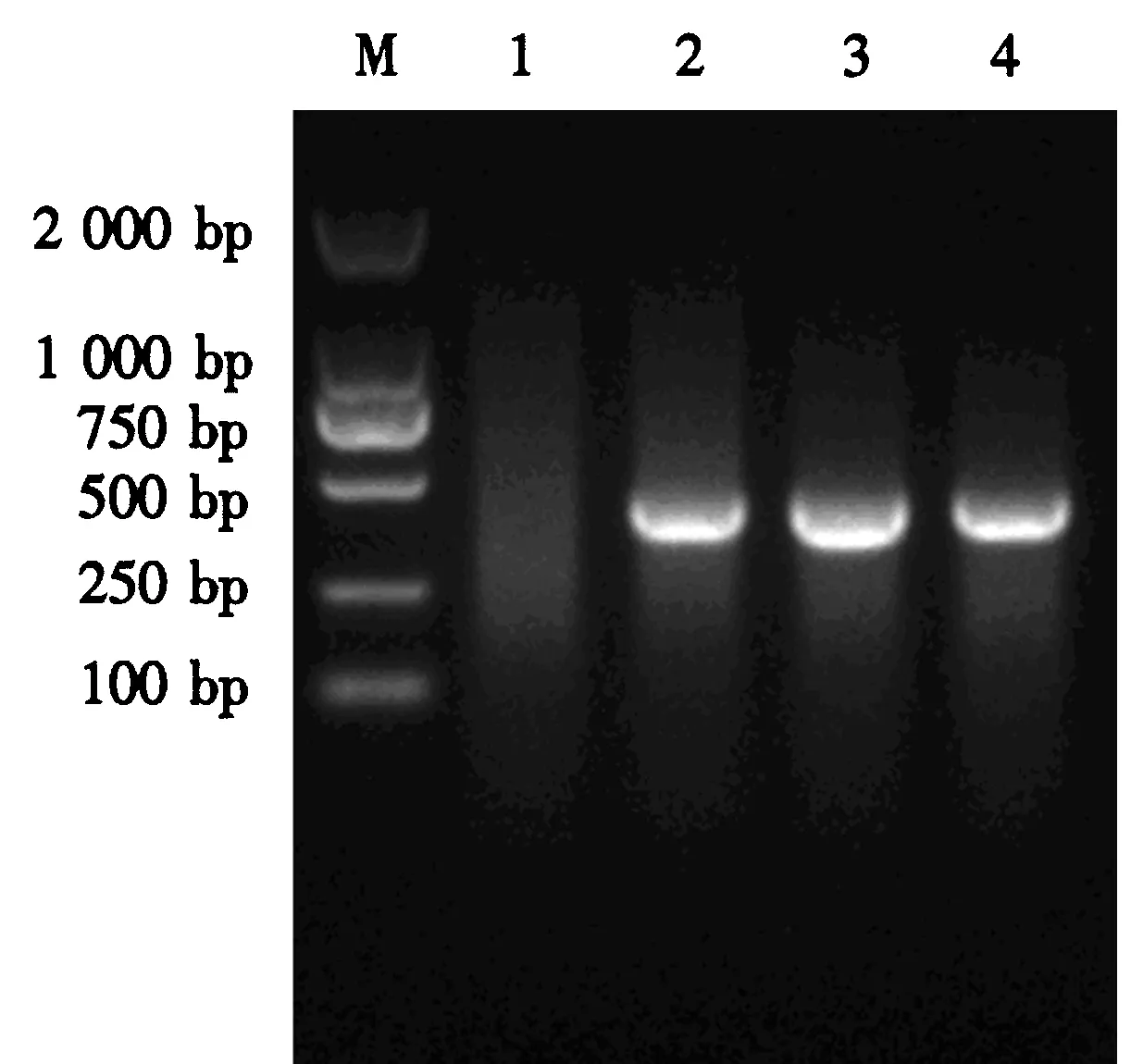
M:DL2000 DNA Marker;1:空白对照;2:病鱼材料的研磨样品;3:感染VNNV的SSN-1细胞上清样品;4:感染VNNV的E-11细胞上清样品.图2 RT-PCR鉴定结果Fig.2 RT-PCR identification of the sample
病鱼样品RT-PCR检测电泳结果(图2)显示,病料研磨样品及SSN-1、E-11细胞培养上清样品均出现特异性条带,目的片段大小约427 bp.扩增产物送生工生物工程(上海)股份有限公司测序,测序结果经序列比对分析显示,3份样品基因序列的相似性达100%.构建的系统发育树(图3)显示,本试验分离到的病毒株与赤点石斑鱼神经坏死病毒(redspotted grouper nervous necrosis virus, RGNNV)的亲缘关系最近,鉴定该病毒为RGNNV.
2.4 病毒的电镜观察
病毒液浓缩后经磷钨酸负染色,干燥后置电镜观察,可见粒径为25~35 nm、近二十面体的VNNV颗粒(图4A).将感染VNNV 3 d的E-11细胞制成超薄切片后置电镜下观察,可见细胞质内大量病毒颗粒聚集成团,细胞膜结构被破坏,细胞器受损,细胞质出现大量空泡,但细胞核结构完整(图4B、4C).
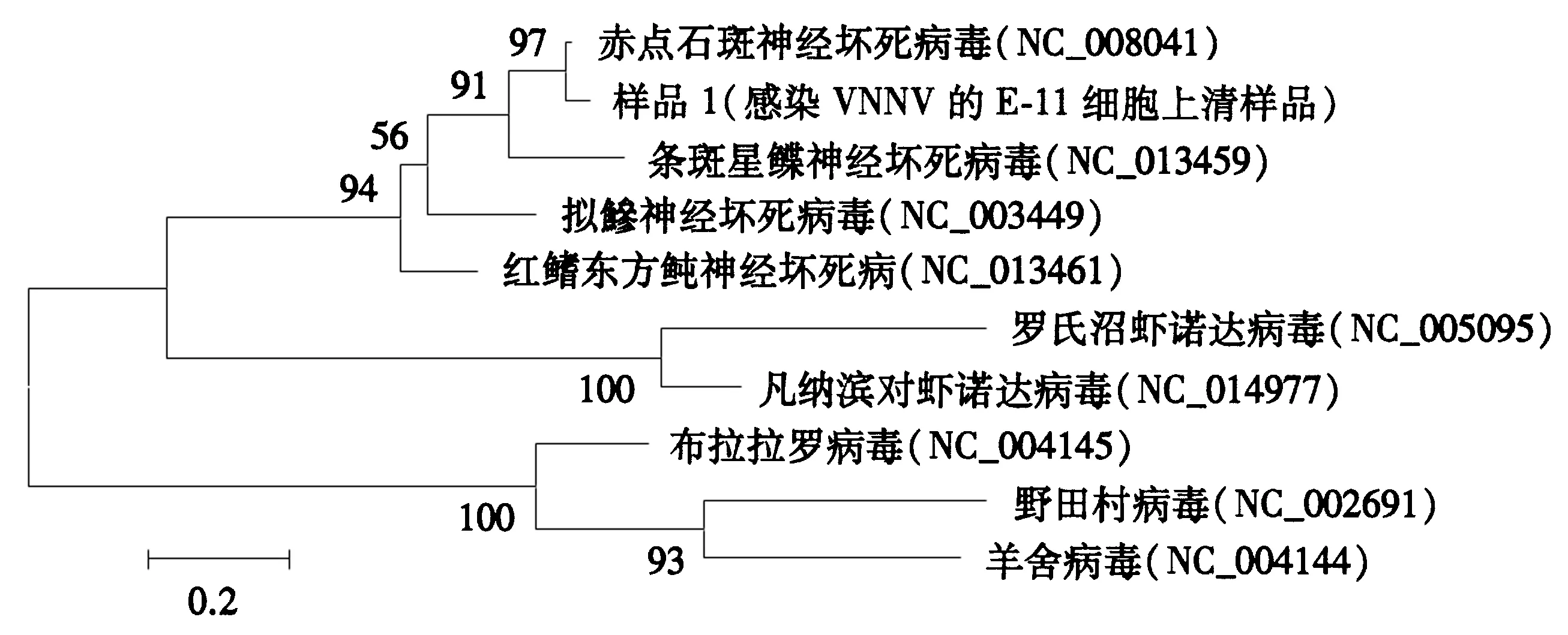
图3 分离到的VNNV系统发育树Fig.3 Phylogenetic tree of VNNV
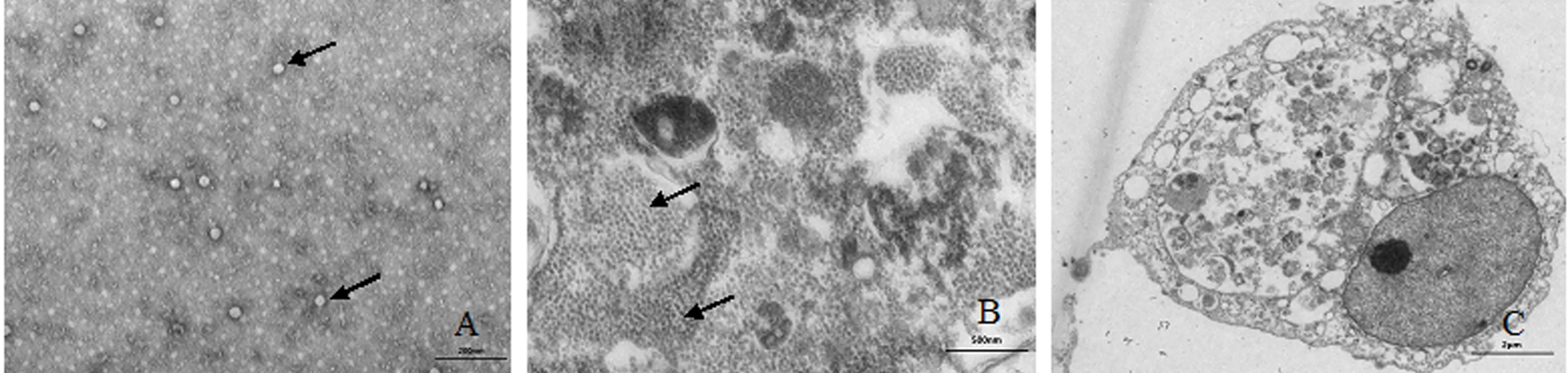
A:负染后的VNNV病毒颗粒(箭头示病毒颗粒,25 000×);B:病毒感染后的E-11细胞切片(箭头示病毒颗粒,10 000×);C:E-11细胞质出现大量空泡(2 500×).图4 VNNV的电镜观察结果Fig.4 Electron micrograph of VNNV
2.5 病毒滴度
接种VNNV的E-11细胞置27 ℃下培养,每日观察并记录细胞的变化,7 d后病毒的滴度达105.07TCID50·mL-1.
2.6 病毒的温度敏感性
接种细胞前将VNNV病毒液分别置30、40、50、60 ℃处理30 min后,每毫升VNNV病毒液的TCID50分别为104.63、104.30、103.30、0,空白对照组为105.07.结果显示,50 ℃下处理30 min后病毒滴度明显下降,60 ℃处理30 min后病毒失活.
2.7 病毒的酸碱度敏感性
将VNNV病毒液的pH分别调节至3、11,置27 ℃处理30 min后,每毫升VNNV病毒液的TCID50分别为102.89、102.08,空白对照组为105.45.结果显示,在pH为3、11的条件下,本试验分离的VNNV滴度均明显下降.
3 讨论
病毒性神经坏死病是世界范围内海水鱼类最常见、危害最严重的传染病之一,除石斑鱼外,牙鲆、鲈、东方鲀、军曹鱼等品种均有感染病毒性神经坏死病的报道[12].1991年Mori et al[13]根据柯克原则确定病毒性神经坏死病是由鱼类VNNV引起的.根据病毒颗粒衣壳蛋白基因的不同序列,将VNNV分成4个基因型,即RGNNV、红鳍东方鲀神经坏死病毒、条斑星鲽神经坏死病毒、黄带拟鲹神经坏死病毒(striped jack nervous necrosis virus, SJNNV)[14].不同基因型产生细胞病变所需的温度、时间不一样,且细胞病变形态也不同.福建闽南地区感染石斑鱼的神经坏死病毒主要为RGNNV基因型[15].本试验对福建省漳州市某水产养殖场发生的疑似石斑鱼病毒性神经坏死病进行了病原分离和鉴定,结果显示该病原为VNNV,基因型为RGNNV,下一步计划对该株VNNV进行全基因组测序,进一步分析其病原学特征.
目前能用于VNNV培养的细胞主要有SSN-1[16]、E-11[9]、石斑鱼鳍细胞系(GF-1)[17]、石斑鱼脑细胞系(GB)[18]、石斑鱼脾细胞系(GS)[19]等细胞.E-11细胞是Iwamoto et al[9]采用SSN-1细胞成功克隆出的对诺达病毒高度敏感,且能持续增殖的细胞株.RGNNV、SJNNV、红鳍东方鲀神经坏死病毒、条斑星鲽神经坏死病毒4种基因型VNNV在E-11细胞上的最适生长温度分别为25~30、20~25、20、15~20 ℃[9].与SSN-1细胞相比,E-11细胞生长更快、更稳定,且细胞病变更明显.本试验中,在27 ℃的培养条件下,E-11细胞较SSN-1细胞表现出对VNNV更高的敏感性及更明显的病变,这也与上述相关的研究结果相符.
温度、pH、辐射等理化因子能影响病毒核酸的复制、转录和翻译等功能,或改变、破坏病毒颗粒的衣壳蛋白,影响病毒颗粒对宿主细胞的吸附和侵入,从而使病毒失去感染性,研究病毒的理化性质对于养殖生产中病原的预防控制具有重大的意义.Arimoto et al[20]研究表明,于20 ℃、pH 12的条件下处理10 min能够使当地SJNNV失去活性,因此将在pH为12的条件下处理10 min作为当地SJNNV的灭活程序.台湾地区的Chi et al[21]研究表明,石斑鱼的VNNV在60 ℃下处理1 h后完全失活,在pH为3和10~12的条件下处理后滴度明显下降.本试验结果显示,本试验分离到的VNNV经50 ℃及以上温度处理30 min后,滴度明显下降,至60 ℃病毒完全失活,推测该过程可能与病毒蛋白高温变性有关;此外,酸碱度敏感性检测结果显示该株VNNV对强酸或强碱敏感.针对VNNV理化特性的研究虽然采用的处理条件各不相同,但从研究结果可以推测VNNV对于强酸(pH<3)、强碱(pH>12)、高温(60 ℃以上)条件敏感.以上结果可为当地石斑鱼养殖场的病毒性神经坏死病预防控制提供参考.

