青钱柳内生真菌多样性及其代谢产物的特性
寇晓琳, 谢 楠, 吴彩娥,, 范龚健,, 洑香香
(1.南京林业大学轻工与食品学院,江苏 南京 210037;2.南方现代林业协同创新中心,江苏 南京 210037)
青钱柳(Cyclocaryapaliurus)又名青钱李、摇钱树等,系胡桃科(Juglandaceae)青钱柳属(Cyclocarya)植物,是我国特有的单种属植物,也是国家重点保护的濒危植物之一,属三类保护植物.《中国中药资源志要》[1]记载,其树皮、叶均具有清热消肿、止痛的功能,可用于治疗顽癣[2].长期以来,江西、湖南等地的人们取其叶制作饮料,因其味甜,有清热解暑、降血压、降血糖等功能,又称甜茶、神茶[3].2013年10月30日国家卫计委正式批准青钱柳叶为新食品原料,并规定其使用方式为“冲泡”.近年来,国内外学者对青钱柳的种植、活性物质提取以及胶囊冲剂等保健品开发进行了广泛研究[4-5].
植物内生菌是指生活在植物组织内而不引起任何直接、明显植物病变的一大类微生物,包括寄生或共生在植物体内的真菌和细菌,以及植物侵袭性腐生菌或植物机会致病菌[6].100多年前,Bacon et al[7]就从黑麦草种子中分离出第一株内生真菌,但直到1993年Stierle et al[8]从短叶红豆杉韧皮部分离到一株能产抗癌活性物质紫杉醇的内生真菌才真正引起人们对植物内生真菌的功能性质的注意.近年来,植物内生菌特别是药用植物内生菌,作为一种新的微生物资源引起了广泛关注,人们从其代谢产物中分离出多种生物活性物质,包括具有抗菌、抗肿瘤、杀虫、免疫抑制、抗氧化等特点的天然化合物,其中不少是新物质,具有特殊生物活性[9-12].黄酮类化合物是一类天然多酚化合物,具有抗氧化、清除自由基的功效,目前已证实其对动脉粥样硬化、骨质疏松症、糖尿病和某些癌症有一定的治疗效果[13].研究表明,植物内生菌能够产生与宿主相同或相似成分的活性物质[14].张海龙等[15]、张婷等[16]及赵晓璐等[17]都从植物中分离出多株产黄酮类物质的内生真菌.野生青钱柳的直接利用由于其属于国家珍稀濒危植物受到很大限制,不能满足开发和应用的需求,获得其活性物质的途径有待进一步的创新和拓宽,青钱柳活性内生菌的开发研究意义重大.
本研究以江苏镇江的青钱柳为材料,采用组织分离的方法从植物的枝、叶、根、皮部位大量分离内生真菌,研究青钱柳内生真菌的多样性及分布部位.通过抑菌活性跟踪,筛选具有抑菌作用和产黄酮的青钱柳内生真菌,研究青钱柳内生真菌发酵产物对供试菌株的抑菌活性以及产黄酮的能力,旨在为青钱柳功能性内生真菌进一步的研究提供理论依据.
1 材料与方法
1.1 试验材料
1.1.1 供试植物、菌株与黄酮提取物 青钱柳植株枝、皮、叶、根均采自江苏镇江.大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphyloccocusaureus),由南京财经大学食品实验室提供;白色念珠菌(Moniliaalbican)由南京师范大学食品实验室提供;青钱柳黄酮提取物由南京林业大学食品实验室提供;异槲皮苷标品(纯度≥98%)、山奈酚标品(纯度≥98%)、槲皮素标品(纯度≥90%)从SIGMA公司购入.
1.1.2 培养基 青钱柳内生真菌分离培养基:马丁氏培养基、察氏培养基、马铃薯葡萄糖培养基(PDA培养基).青钱柳内生真菌发酵培养基:马铃薯肉汤培养基(PDB培养基).供试细菌培养基:牛肉膏蛋白胨培养基.供试真菌培养基:PDA培养基[18].
1.2 试验方法
1.2.1 内生真菌的分离 用自来水将无病害青钱柳的枝、皮、叶、根冲洗1 h,晾干后,将叶摘下,皮剥下,枝剪成5 cm长小段.在超净工作台上,按无菌操作方法进行以下工作:先用5%的NaClO溶液浸泡材料5 min,再用75%的乙醇溶液浸泡30 s,用无菌水漂洗4次,无菌纱布蘸干水分,剪去枝条和根部两头褐变部分,将其剪成0.5 cm小段,去除木质部,保留韧皮部.将韧皮部、叶片和树皮剪成0.5 cm×0.5 cm小片.把处理过的各部分组织分别植入PDA培养基、马丁氏培养基、察氏培养基平板中,每皿植入4~5片,置于28 ℃培养箱倒置培养,所有样品在4 h内完成内生真菌的分离工作,每种处理设3组重复.24 h观察一次,待枝、叶、根、皮切面处长出菌丝后,挑取其尖端部分移至新的PDA培养基平板上,28 ℃培养,经反复几次纯化后,即得到青钱柳内生真菌纯培养物.对照试验:将表面消毒后的枝、皮、叶、根不作切割,置相同条件下培养,结果无任何微生物长出,证明表面消毒彻底,分离到的真菌是青钱柳的内生真菌.分离纯化后,于4 ℃保存备用[19-21].
1.2.2 内生真菌的形态学观察 观察28 ℃下培养4~7 d的内生真菌菌落形态特征.挑取纯化的尖端菌丝,用乳酸石炭酸棉蓝染色液染色,进行常规镜检.参照《真菌鉴定手册》[22]及相关文献[23-25]对分离的内生真菌进行显微形态特征的观察和初步分类.
1.2.3 内生真菌胞内产物的提取 将内生真菌转接到装有100 mL PDA液的250 mL三角瓶中,放在恒温摇床上,在28 ℃、150 r·min-1的条件下培养7~10 d,同时留取空白培养基作对照.将菌体进行细胞破碎,离心后量体积,将其浓缩30倍后用0.22 μm的滤膜过滤,得到胞内产物浓缩液;空白培养基离心后,做相同处理,作为对照发酵浓缩液,备用[26].
1.2.4 内生真菌发酵液制备 使用接种针挑取枝、皮、叶、根内生菌培养基中面积为0.5 cm×0.5 cm平板培养物接到发酵瓶中,置于28 ℃、140 r·min-1的恒温摇床上继续培养7 d.发酵结束后,用超声波细胞破碎仪对发酵瓶中菌体进行破碎,每瓶破碎30 min,使用甲醇静置浸泡24 h.浸提后的溶液在4 000 r·min-1下,离心15 min后收集浸提液,于60 ℃水浴旋转蒸发浓缩样品得棕色粘稠物,加入70%的甲醇充分混匀,定容至5 mL后备用.
1.2.5 抑菌试验 以常见的2种细菌(大肠杆菌、金黄色葡萄球)和1种真菌(白色念珠菌)为检测菌,采用滤纸片法检测浓缩液的抑菌活性[27].方法为:分别取1.2.3中的胞内产物浓缩液5 mL于无菌具塞试管内,取直径为10 mm的滤纸片若干放入试管中,使其充分吸收;然后在无菌操作台上,用镊子夹取略微风干后的滤纸片平放于含有测试菌的培养皿中,测试各内生真菌的发酵液和其菌丝提取液(从内生真菌培养基中挑取不同部位内生真菌与5 mL无菌水混合)对3种测试菌的抑菌效果;同时,分别取5 mL上述对照发酵浓缩液和无菌水于试管中,浸泡滤纸后,作为对照.将制好后的大肠杆菌、金黄色葡萄球菌培养皿在37 ℃恒温培养箱中培养36 h,将制好的白色念珠菌的培养基置于28 ℃恒温培养箱中培养36 h,然后观察,测其抑菌圈大小,并拍照记录.
抑菌活性表示方法:滤纸片直径10 mm,“-”表示无抑菌圈,“+”表示抑菌圈直径<5 mm,“++”表示5 mm≤抑菌圈直径<10 mm,“+++”表示抑菌圈直径≥10 mm.抑菌活性以抑菌圈直径的大小进行衡量,其中,抑菌圈直径等于抑菌外径与滤纸片直径之差[28].
1.2.6 显色反应 硼酸显色反应:取1.2.4制备的发酵液5 mL置于试管中,加入2%的硼酸溶液数滴,置于振荡器上摇匀,静置30 min观察有无棕黄色出现,并拍照记录.3% AlCl3显色反应:取样品1滴置于滤纸中央,并在滤纸表面喷洒3% AlCl3乙醇溶液,自然风干后,放在紫外灯下观察有无黄绿色荧光,并拍照记录.4% NaOH显色反应:取青钱柳内生真菌发酵液2 mL置于试管中,加入4% NaOH溶液数滴,置于振荡器上摇匀,静置30 min观察有无黄色出现,并拍照记录[29].
1.2.7 薄层层析 对青钱柳内生真菌所产黄酮进行薄层层析,采用硅胶G薄板,选用20种展开剂,3% AlCl3乙醇溶液(显色剂),其组分比例见表1[30-33].
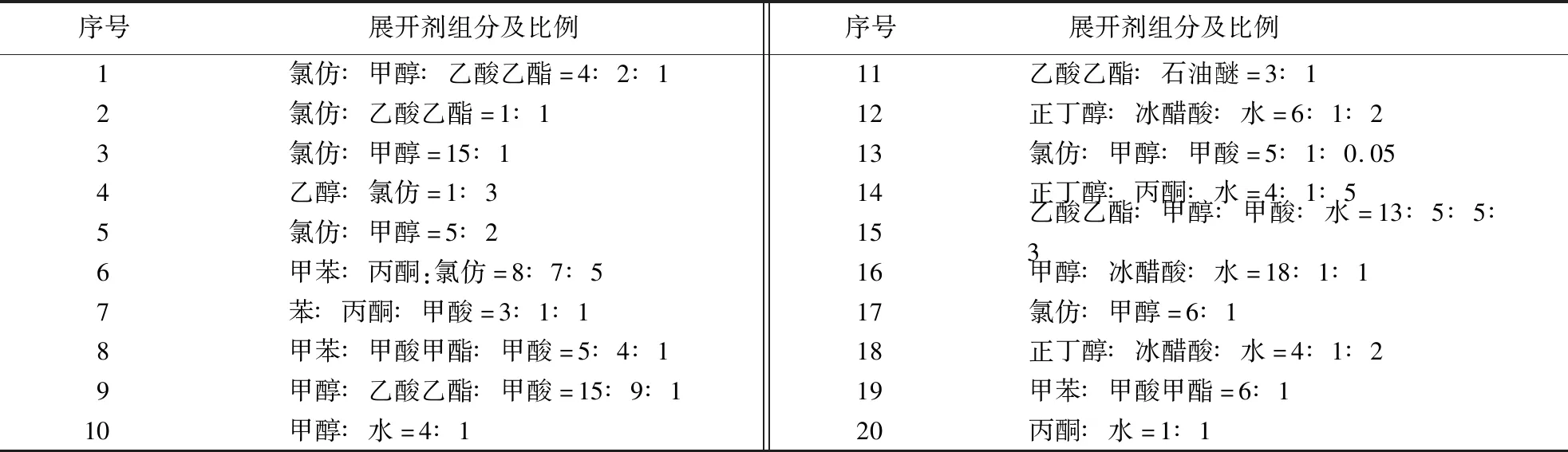
表1 薄层层析的展开剂组分及比例Table 1 Composition and ratio of developers for thin layer chromatography
2 结果与分析
2.1 内生真菌的形态学特征及初步分类
本试验共从青钱柳中共分离获得内生真菌共67株.经肉眼观察菌落表面形态,并结合光学显微镜观察其微观特征,初步判定分离得到的内生真菌分别属于3纲4目6科10属,其特征及分类见表2,10个代表性菌株的形态特征见图1.
2.2 青钱柳内生真菌的分布
2.2.1 不同组织中内生真菌的分离结果 如表3所示,从青钱柳的枝、皮、叶、根4个部位中分离获得的67株内生真菌中,根部分布的内生真菌从数量和种属上都占优势,其内生真菌共9属27株,占分离菌株总数的40.3%,以木霉属为优势菌群,占根部菌株数的25.9% ;枝部内生真菌共7属14株,占分离菌株总数的20.9%,以镰刀菌属为优势菌群,占枝部菌株数的35.7%;皮部内生真菌共8属19株,占分离菌株总数的28.4%,以链格孢属为优势菌群,占皮部总菌株数的26.3%;叶部内生真菌共6属7株,占分离总菌株数的10.4%.

表2 青钱柳内生真菌的形态特征Table 2 Morphological characteristics of endophytic fungi
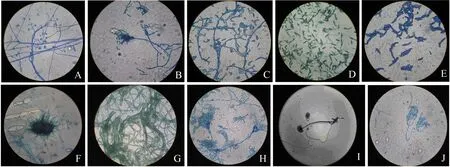
A:木霉属×400;B:青霉属×1000;C:地霉属×400;D:链格孢属×1000;E:镰刀菌属×1000;F:刺盘孢属×400;G:丝核菌属×400;H:拟青霉孢属×1000;I:根霉属×100;J:棒束梗霉属×1000.图1 青钱柳内生真菌的个体形态Fig.1 Individual form of endophytic fungi isolated from Cyclocaryapaliurus
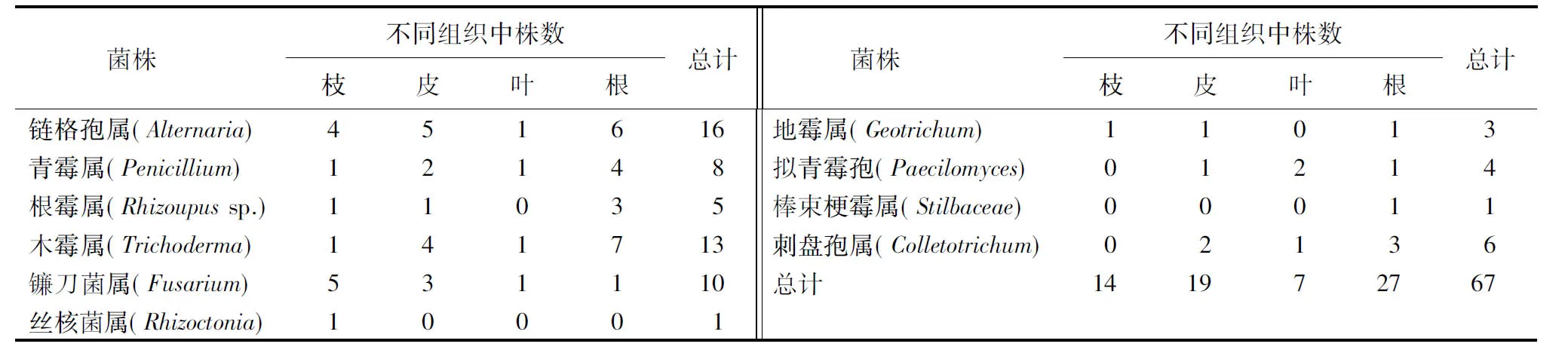
表3 青钱柳不同组织内生真菌的分布Table 3 Distribution of endophytic fungi in different organs of Cyclocaryapaliurus
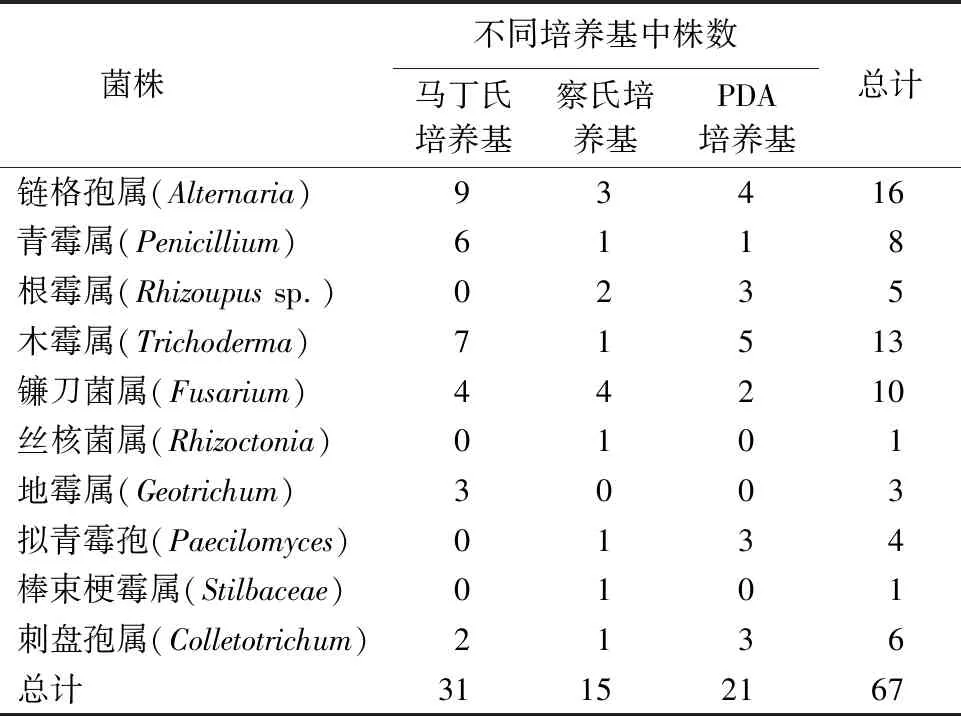
表4 不同培养基中内生真菌的分布Table 4 Distribution of endophytic fungi in different culture mediums
2.2.2 不同培养基内生真菌的分离结果 如表4所示,马丁氏培养基共分离得到31株,分离频率为46.3%,其优势菌群为链格孢属;察氏培养基共分离得到15株,分离频率为22.4%,镰刀菌属为优势菌群;PDA培养基中共分离得到21株,分离频率为31.3%,木霉属为优势菌群.马丁氏培养基分离得到的菌株虽然较多,但是真菌的种类只有6种;察氏培养基分离得到的菌株数少,但菌属种类较多,达到9种,且棒束梗霉属、丝核菌属只在察氏培养基中有发现.
2.3 抑菌试验结果
从67株内生真菌次生代谢产物的抑菌活性测试结果(表5)可以看出,其发酵产物对至少1种指示菌有抑制作用的菌共有13株,占总分离菌株的19.4%;对3种指示菌均有抑制作用的菌株有7株,占总分离菌株的10.4%.青钱柳内生真菌对金黄色葡萄球菌有抑菌作用的菌株最多,有10株,占总分离菌株的14.9%,抑制白色念珠菌的菌株最少,为8株,占总分离菌株的11.9%.抑菌效果显著的是编号为PP03、PP08、PP11、PP19、PZ11、PG07、PG11的7株青钱柳内生真菌.这些内生真菌抑菌谱广,而抑菌效果最显著的是编号为PP08和PG11的两株青钱柳内生真菌.其中PP08属于青霉属,PG11属于链格孢属.其发酵产物对指示菌的抑菌圈直径均大于5 mm,其中PP08胞内发酵产物对金黄色葡萄球菌的抑菌圈直径达到14.5 mm,PG11胞内发酵产物对于白色念珠菌的抑菌直径达到13.2 mm(图2),表明其具有显著的抑菌性.

表5 内生真菌发酵产物对供试菌的抑菌作用1)Table 5 Antibacterial activities of the secondary metabolites from endophytic fungi
1)-:没有抑菌圈;+:抑菌圈直径<5 mm;++:5 mm≤抑菌圈直径<10 mm;+++:抑菌圈直径≥10 mm.
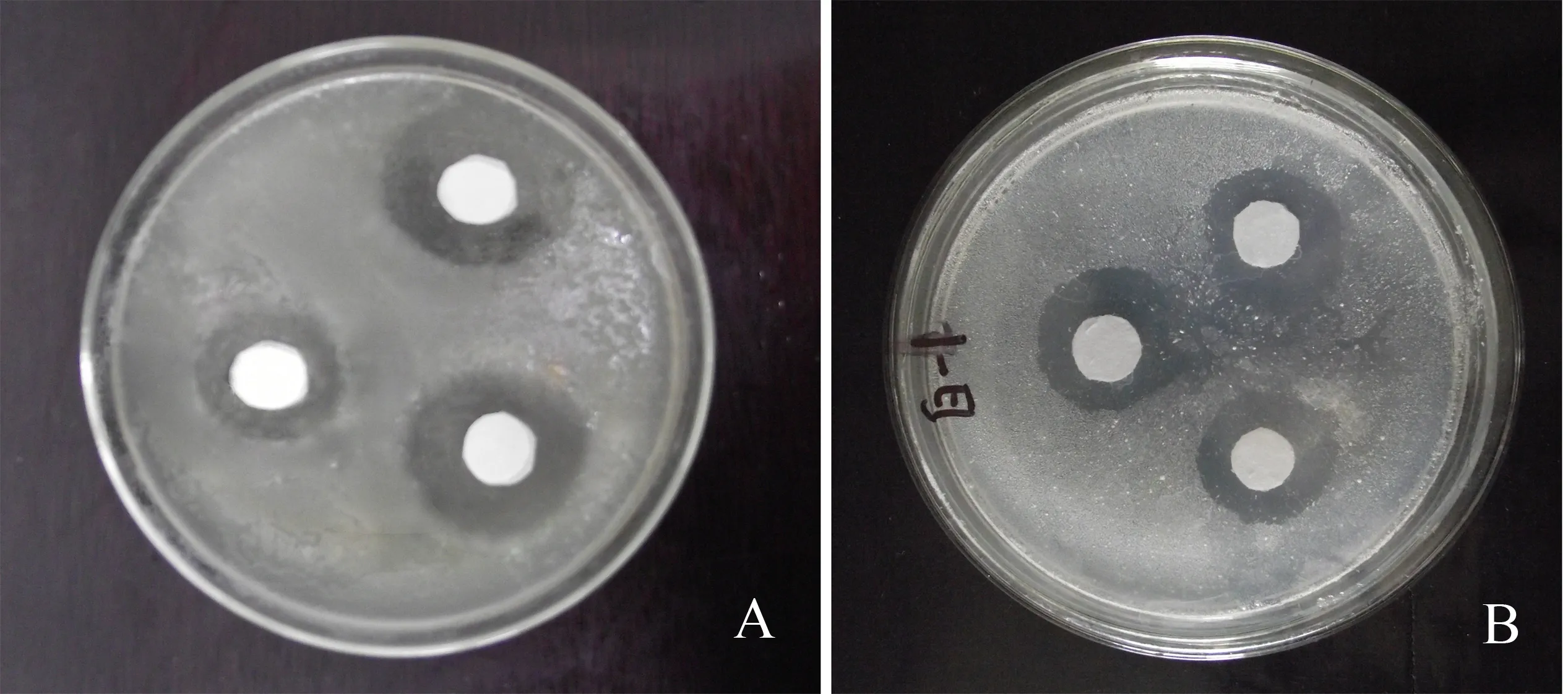
A:金黄色葡萄球菌; B:白色念珠菌.图2 内生真菌PP08和PG11胞内发酵产物对金黄色葡萄球菌和白色念珠菌的抑菌效果Fig.2 Inhibition effects of endophytes PP08 and PG11 on Staphylococcus aureus and candida albicans
2.4 显色试验结果
青钱柳内生真菌部分菌株培养液经细胞破碎,离心并浓缩上清液,得到供试发酵液,进行显色反应.由表6可以推论,显色反应中,下述7株菌株(PP03、PY01、PG11、PZ06、PY12、PP12、PP06)具有产生黄酮类化合物的能力.

表6 青钱柳内生真菌发酵液显色反应Table 6 Color reaction of the fermented liquids
2.5 薄层层析试验结果
对青钱柳内生真菌浓缩液以不同的层析条件进行多次薄层层析,结果发现8号层析液(甲苯∶甲酸甲酯∶甲酸=5∶4∶1)和18号层析液(正丁醇∶冰醋酸∶水=4∶1∶2)可将黄酮对照品分为几个迁移率明显不同的斑点,其余10多种展开剂层析时均出现严重拖尾现象,而在上述2种展开剂中18号层析液层析效果最稳定,故认为正丁醇∶冰醋酸∶水=4∶1∶2最适合青钱柳内生真菌黄酮的TLC分离.
选用上述展开剂对青钱柳内生真菌培养液的浓缩液进行展开,发现该层析条件下培养液能够得到很好的分离.用3% AlC13乙醇溶液喷雾显色后,用GDS-760图象及分析系统(UVP)经紫外检测成像,结果如图3所示.
样品PP06(S1)和样品PP03(S2)都只产生了一个层析斑点,其迁移率与异槲皮苷标准品(M1)的相同,推测为同种成分;样品PY12(S3)产生2个斑点,斑点1对应异槲皮苷标准品(M1),斑点2对应山奈酚标准品(M3),由于槲皮素(M2)和山奈酚标准品的迁移率极为相近,也对应青钱柳黄酮提取物中的相同的斑点,可确定该种活性物质为青钱柳黄酮中的一种,但其具体种类仅通过迁移率并不能完全确定,有待于高效液相色谱的进一步检测;样品PZ06((S4)的薄层层析出现4个显色斑点,但斑点1不太明显,可能是由于其含量过低,导致显色反应不明显,其它3个斑点中,斑点3和斑点4分别对应异槲皮苷标准品和槲皮素标准品,而斑点2和青钱柳黄酮的提取物有相对应的点,推测其为青钱柳黄酮中的一种,但和上述3种标准品不同.
薄层层析试验结果表明青钱柳生真菌产生的黄酮类物质中有与青钱柳黄酮相同或相似的成分,且进行3次重复试验,均能出现同样的结果,这表明青钱柳内生真菌产黄酮的能力具有很好的稳定性.
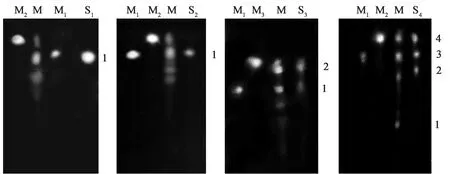
M:青钱柳叶黄酮提取物;M1:异槲皮苷;M2:槲皮素;M3:山奈酚;S1:PP06;S2:PP03;S3:PY12;S4:PZ06.图3 青钱柳内生真菌发酵液的薄层层析图谱Fig.3 Thin layer chromatograph of the organic extractants from the endophytic fungi of Cyclocaryapaliurus
3 讨论
本试验从青钱柳不同组织共分离得到67株内生真菌,其种群差异明显,各组织中的优势种群各不相同,通过菌落形态和显微形态对分离得到的青钱柳内生真菌进行分类鉴定,分别隶属于3纲4目6科10属,青钱柳中的枝、皮、叶、根不同部位分离出的内生真菌的种类和数量不尽相同.植物内生真菌的分布不仅受宿主植物影响,还受外界环境的影响.即使同一种植物,不同组织中内生真菌的数量和种类也不尽相同,存在复杂的多样性[34-35].Rosenblueth et al[36]认为内生真菌在植物体内的分布通常下部组织多于上部组织,越往植株顶部,内生真菌越少.目前对植物可培养内生真菌的分离结果表明,内生真菌在林木组织中以根部最多,枝次之,叶部较少,而在一年生和多年生的经济作物中,根部最多,叶枝中数量相近[37].本研究表明青钱柳根部的内生真菌密度大、数量多,皮次之,枝和叶中内生真菌的数量最少,与已有的研究结果基本一致[37].青钱柳不同组织共有的种群相对较多,表明内生真菌在植物的不同部位、不同组织中分布广泛;而其各自的特有种群在种类上也较为丰富,显示出内生真菌在植物中的分布有一定的组织专一性.同种植物不同部位内生真菌分布差异的原因,可能是不同部位的微环境如通气状况、酶和其它化学成分不同适合不同的内生真菌类群侵入、生长.并且,本试验的青钱柳从江苏省镇江取样,不同地区的青钱柳植物体内的活性物质及内生真菌有一定的相似性,但是也有地域差异[38].目前普遍认为土壤是内生真菌的主要来源,因而地下部位内生真菌的数量多于地上部位.
从不同培养基分离的菌株可以看出,马丁氏培养基培养的菌株种类少、数量多,而察氏培养基和PDA培养基培养的菌株种类较多、菌株较少,体现出不同培养基的特性不同.可以推断,植物内生真菌的数量与种类与植物自身状况及所处的环境密切相关.但是影响内生真菌分离结果的因素较多,首先很难将植物体内的内生真菌全部分离出来,这主要是因为人工培养基不可能完全模拟植物体内环境.其次,即使用不同的培养基来分离植物组织的内生真菌,也不能保证所有生活在植物体内的内生真菌全部被分离出来,因为有的内生真菌不能在人工培养基上培养[39].
青钱柳内生真菌的抑菌试验结果共得到13株具有抑菌作用的内生真菌,其中有2株内生真菌的发酵产物对供试菌株均表现出较强的抑菌活性,分别属于青霉属和链格孢属.结果表明,不同菌株的抑菌活性存在很大差别.研究表明,内生真菌在与植物协同进化过程中,不但自身能够产生特殊的化学物质,还能诱导宿主植物次生代谢产物的合成和积累,作为药食两用经济植物,青钱柳所具有的药用价值是否与其体内的内生真菌有关,这些内生真菌是通过何种途径作用于宿主植物的,其代谢产物化学成分的明确以及功能性内生真菌的产物等问题,有待于进一步研究[40].
本研究在青钱柳内生真菌中筛选出7株菌株(PP03、PY01、PG11、PZ06、PY12、PP12、PP06)具有稳定的产生黄酮类化合物的能力.目前,已报道的可产黄酮类物质的内生真菌有刺盘孢属[41]、青霉属[42]、曲霉属和茎点霉属[43]等,但就产黄酮的7株菌株的进一步鉴定的工作正在开展中以期后续发表.同时,由于槲皮素和山奈酚的迁移率相似,因此还需采用高效液相色谱进一步确定其成分.青钱柳黄酮类物质主要从青钱柳叶中提取,对珍贵的青钱柳资源消耗较大.如果能利用内生真菌,实现青钱柳黄酮的微生物体外发酵,则可使青钱柳黄酮的工业化生产不受植物资源的限制,并可防止资源的日益短缺.

